超声波法优化沙棘果实多糖及结构的初步研究
蔡 菲,安美忱,刘安妮
(1.中粮营养健康研究院有限公司营养健康与食品安全北京市重点实验室,北京 102209;2.东北农业大学园艺学院,黑龙江哈尔滨 150030)
沙棘(Hippophae rhamnoides L.),俗称醋柳、黑刺、酸刺,胡颓子科沙棘属的灌木或小乔木[1]。其成熟果实为橙黄色的小浆果,近球形,味酸甜,清香且营养丰富[2]。沙棘果实富含多糖、蛋白质、矿物质、维生素、脂肪酸、玉米黄素、蕃茄红素、黄酮和酚类等营养成分,具有较高的营养价值和保健功效[3]。
多糖,也称为多聚糖,大多数多糖具有增强机体的细胞和体外免疫功能,诱导细胞因子产生,具有抗感染、抗辐射、抗肿瘤、降血脂、抗氧化、抗凝血等活性,既可以作为药物临床治疗,也可作为功能食品[4]。
研究表明,沙棘果实中的多糖具有免疫调节、抗氧化、抗肿瘤、降血脂、增强免疫力等生物活性[5-6],同时对于肝炎、心血管系统疾病、动脉粥样硬化、过敏、促进新陈代谢等[7]也起到了治疗作用。
超声波辅助提取法是天然产物活性成分提取的一种经典方法,目前广泛应用于天然产物有效成分的提取过程中。超声波辅助提取法节省试剂,并且提取率高[8]。
试验采用超声波法提取沙棘果实多糖,探讨最佳提取工艺条件,并用纤维素DEAE和Sepharose CL-6B柱层析进行分离纯化,并对沙棘多糖的结构进行初步测定。为今后开发利用沙棘资源提供科学依据。
1 材料与方法
1.1 材料与试剂
沙棘HS-12,黑龙江省农科院浆果研究所提供;木瓜蛋白酶,北京奥博星生物技术责任有限公司提供;纤维素-DEAE,Whatman公司提供;Sepharose CL-6B,Pharmacia公司提供;葡聚糖T-10,T-40,T-70,T-110和T-2000,上海西格玛奥瑞奇公司提供。
1.2 主要仪器
JY92-2D型超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品;755PC型紫外可见分光光度计,上海光谱仪器有限公司产品;FTS 135型傅立叶变换红外光谱仪,美国BID-BAD公司产品;高效液相色谱仪,日本岛津公司LC-10A产品。
1.3 试验方法
1.3.1 超声波辅助提取沙棘多糖工艺的研究
(1)沙棘多糖的制备。取5.0 g沙棘果果浆,按一定的料液比加入去离子水,在一定的时间和超声功率下进行超声波辅助提取多糖。提取液抽滤、浓缩(50℃,真空度<0.09 MPa),80%乙醇溶液醇沉,静置过夜(4℃),用微孔滤膜(0.45 μm) 抽滤得沉淀固体,冻干,得到沙棘果粗多糖。利用蒽酮-硫酸法[9]测定提取液中的多糖得率。
(2)超声波辅助提取沙棘多糖工艺的单因素试验。以沙棘果果浆为原料(5.0 g),分别研究提取时间、料液比和超声功率对多糖得率的影响,每次试验平行3次。
超声波提取法的单因素试验见表1。

表1 超声波提取法的单因素试验
(3)超声波法提取沙棘多糖工艺优化试验。在单因素试验的基础上,考查超声功率、超声时间和料液比这3个因素的相互影响,进行三因素三水平的正交试验,采用L9(34)正交表进行正交试验设计,以沙棘多糖的提取量为指标,确定沙棘多糖的最佳提取工艺。
超声波提取法的正交试验因素与水平设计见表2。

表2 超声波提取法的正交试验因素与水平设计
1.3.2 沙棘多糖分离纯化的研究
(1) 脱蛋白方法比较。分别称取1 g沙棘粗多糖,采用Sevag法、木瓜蛋白酶法、木瓜蛋白酶同Sevag法联用这3种方法来进行脱蛋白处理,比较这3种方法的脱蛋白效果。
(2) DEAE-纤维素分离纯化沙棘多糖的研究。将脱蛋白后的沙棘多糖配制成10 mg/mL溶液,利用阴离子交换剂DEAE-纤维素(2.0 cm×30 cm)柱层析进一步分离纯化,上样量为5.00 mL,0~1 mol/L NaCl溶液进行梯度洗脱,洗脱剂流速1 mL/min。蒽酮-硫酸法跟踪检测至无糖检出,收集多糖洗脱液,得到2个组分,富集主要多糖组分,再进一步纯化。
(3) Sepharose CL-4B凝胶柱层析。将富集主要多糖组分配制成10 mg/mL溶液,利用琼脂糖凝胶Sepharose CL-4B柱(1.8 cm×40 cm) 分离纯化,上样量为5.00 mL,0.2 mol/L NaCl溶液进行洗脱,洗脱流速为1 mL/min,每1.00 mL为一管,收集洗脱液,蒽酮-硫酸法跟踪检测至无糖检出。根据洗脱曲线收集多糖组分,经浓缩、冻干,得到均一组分沙棘多糖(HRP),采用蒽酮-硫酸法测定纯度。
1.3.3 沙棘多糖(HRP) 分子量测定
(1)液相色谱条件。LC-10A型高效液相色谱仪,检测器,RID-10A型示差折光检测器,数据处理工作站:Shimadzu CLASS-Vp工作站;色谱柱:Waters Ultrahydrogel 2000,7.8×300 mm;洗脱剂:超纯水;进样量:10 μL;流速:0.7 mL/min;压力:1.6 MPa。
(2) HRP分子量测定。准确称取葡聚糖标准品T-10,T-40,T-70,T-110,T-2000 各 2.0 mg,使用去离子水,配制质量浓度为2.0 mg/mL的标准溶液,0.45 μm微孔滤膜过滤,取10 μL进样,分别获得每种葡聚糖标准品的色谱峰保留时间。通过葡聚糖标准品的分子量对数值与色谱峰保留时间来绘制标准曲线,得到回归方程。
取2.0 mg沙棘多糖HRL通过以上方法进行操作,可以得到色谱峰的保留时间,采用回归方程,计算HRL的分子量。
1.3.4 沙棘多糖的红外光谱分析
通过KBr压片法,采用FIR-8400s傅立叶变换红外光谱仪,对HRP的主要官能团进行分析,红外光谱扫描范围4 000~500 cm-1。
1.3.5 数据处理
所有试验均重复进行3次,数据均采用平均值±标准偏差(mean±SD) 表示。
2 结果与讨论
2.1 单因素试验结果
超声功率对沙棘多糖提取量的影响见图1,超声时间对沙棘多糖提取量的影响见图2,料液比对沙棘多糖提取量的影响见图3。

图1 超声功率对沙棘多糖提取量的影响

图2 超声时间对沙棘多糖提取量的影响
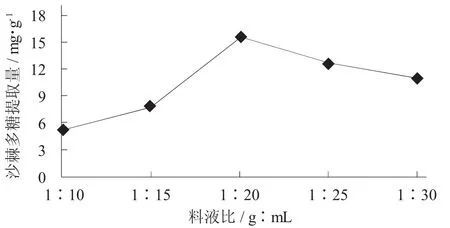
图3 料液比对沙棘多糖提取量的影响
由图1可知,超声功率对沙棘多糖的提取量影响显著。当料液比1∶20,超声时间45 min,超声功率在120~480 W时,沙棘多糖的提取量会逐渐增高。当超声功率为480 W时,多糖提取量最大是12.46±0.61 mg/g。当超声功率在480~600 W时,多糖的提取量随功率的增大而下降。可能是因为随着超声波功率的增大,植物细胞的破碎作用增强,加速了有效成分的溶解,因此提高了提取量;但当超声波的功率超过480 W时,溶解的杂质增多,有效成分减少,使得提取量降低。因此,确定最佳超声功率为480 W。
由图2可知,当料液比1∶20,超声功率480 W,超声时间15~30 min时,沙棘多糖的提取量随着超声时间的增加上升缓慢。当提取时间为30~60 min时,超声时间对沙棘多糖提取量的影响随着时间的增加而增大。提取时间大于60 min时,增加逐渐缓慢。也许是随着时间的增加,膜破碎程度渐渐增强,溶出物较多,得率较高。但当继续破碎时,杂质相应增加,有效成分溶解量减少,得率没有显著提高。为节省提取时间,因此选择超声时间为45 min,此时沙棘多糖的提取量为6.11±0.24 mg/g。
由图3可知,当超声时间为45 min时,功率为480 W时,料液比在1∶10~1∶30,沙棘多糖提取量随着料液比的升高先增加再减少。料液比在1∶10~1∶20,多糖提取量随着料液比的增加而升高。当料液比为1∶20时,多糖提取量达到最大,为15.65±0.70 mg/g。这可能是由于溶剂少时体系黏稠不利于多糖的提取,当溶剂达到合适值时,多糖溶出最多,得率最高。当料液比在1∶20~1∶30时,沙棘多糖提取量随着料液比的增加而降低。因此选取料液比为1∶20作为提取最佳料液比。当料液比为1∶20时,沙棘多糖的提取量达到最大值15.65±0.70 mg/g。然后提取量呈下降趋势,所以选择料液比为1∶20。
2.2 正交试验结果
通过对超声功率、超声时间、料液比的单因素试验,选择出最佳条件分别为超声功率480 W,超声时间30 min,料液比1∶20。在此基础上进行正交试验。
超声波法提取沙棘多糖正交试验结果见表3。

表3 超声波法提取沙棘多糖正交试验结果
由表3可知,3个因素影响总糖提取率的大小分别为A>C>B,主要影响参数为A2B3C2。即最佳提取参数为超声功率480 W,超声时间55 min,料液比1∶20。因为最佳提取工艺A2B3C2不包括在正交试验设计表内,考虑验证结论的准确性,而进行了验证试验。其结果为在最佳条件下,总糖提取量达到48.63 mg/g。确定了A2B3C2为最佳工艺,即超声功率480 W,超声时间55 min,料液比1∶20。
2.3 沙棘多糖分离纯化
2.3.1 不同脱蛋白方法结果比较
脱蛋白方法比较见表4。

表4 脱蛋白方法比较
由表4可知,Sevag法脱蛋白,能够去除蛋白质51.10%,但是多糖损失率高;单独使用木瓜蛋白酶法脱蛋白,虽然多糖损失率较低,但是脱蛋白效果差。利用木瓜蛋白酶与Sevag法,在保证多糖含量的同时,最大限度地去除了多糖中的蛋白质,清除率为88.17%±0.43%,此法除蛋白工艺操作简易、省时,是一种较为理想的除蛋白方法。
2.3.2 DEAE-纤维素和Sepharose CL-4B纯化多糖
DEAE-纤维素纯化多糖洗脱曲线见图4,琼脂糖凝胶CL-4B纯化多糖洗脱曲线见图5。

图4 DEAE-纤维素纯化多糖洗脱曲线

图5 琼脂糖凝胶CL-4B纯化多糖洗脱曲线
脱蛋白的沙棘多糖采用DEAE-纤维素柱层分离纯化多糖的洗脱曲线见图4,可见得到2个组分。收集主要组分,采用琼脂糖凝胶Sepharose CL-4B进一步分离纯化,得均一组分沙棘多糖(HRL),洗脱曲线见图5。图5显示,洗脱峰是单一的吸收峰,峰形狭窄且对称,并无拖尾现象,表明沙棘多糖(HRL)纯度较高,蒽酮-硫酸法检测其纯度为90.53%±0.47%。
2.4 多糖分子量
利用高效液相色谱可以得到的标准品Dex tranT-10,DextranT-40,DextranT-70,DextranT-110,DextranT-2000保留时间TR及其相对分子量Mw。通过分子量的对数值为纵坐标,以其相应的色谱峰保留时间作为横坐标,获得回归方程lgMw=-0.484 2TR+11.18,相关系数R2=0.997 9。其中,Mw为葡聚糖标准品的相对分子质量,TR为色谱峰保留时间(min)。
试验计算所得,HRL-3保留时间为12.65 min,通过回归方程,得到HRL-3的相对分子量Mw为1.32×105U。
2.5 红外扫描
沙棘精多糖的红外光谱见图3。
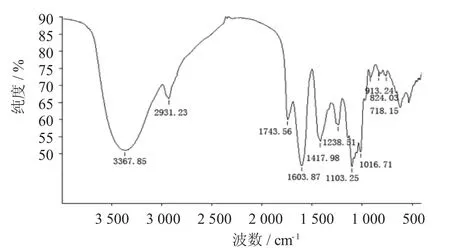
图3 沙棘精多糖的红外光谱
在3 367.85 cm-1处有一个强宽峰为多糖中O-H的伸缩振动峰;在2 931.23处的小肩峰为C-H伸缩振动特征峰;1 743.56 cm-1处为酯化羰基(C=O) 的特征峰,说明多糖HRL-3中存在乙酰基。在1 603.87 cm-1处有特征峰,为羧基(COO-) 的特征峰,表明多糖HRL-3含有糖醛酸。1 417.98 cm-1处为C-H的伸缩振动峰;1 238.51 cm-1处为C-H的变角振动峰。1 016.71 cm-1处为羟基C-O-C键伸缩振动峰。913.24 cm-1处为吡喃环的伸缩振动峰;842.83 cm-1处显示HRL-3含有α-糖苷键的特征吸收峰;在718.15处的小肩峰为C-H伸缩振动特征峰。
红外光谱的分析结果显示,HRL-3具有多糖的特征吸收峰,同时具有α-糖苷键和吡喃糖环。
3 结论
从沙棘(HS-12) 中提取出多糖,确定了超声波法的适宜提取条件为超声功率480 W,超声时间55 min,料液比1∶20,沙棘多糖的提取量为48.63±0.59 mg/g。选取木瓜蛋白酶与Sevag法联用可有效地去除沙棘多糖的蛋白,清除率达到88.17%±0.43%。通过DEAE-纤维素、SepharoseCL-4B凝胶柱纯化后,得到均一组分沙棘多糖,
分子量为1.32×105U,纯度90.53%±0.47%。红光谱扫描显示沙棘中可能具有多糖的特征吸收峰,并含有吡喃糖环和α-糖苷键。
[1]P Dolkar, D Dolkar, S Angmo, et al.An improved method for propagation of seabuckthorn(Hippophae rhamnoides L).by cuttings[J].National Academy Science Letters,2016,39 (5):1-4.
[2]赵宁,程玉钏,李伟泽,等.以沙棘多糖为骨架材料的沙棘油凝胶乳的制备及性质研究 [J].中国油脂,2016,41 (2):79-82.
[3]吕志琴,童军茂,陈国刚.沙棘多糖提取纯化工艺 [J].农产品加工,2014(9):44-45.
[4]王海燕,张隆龙,张凤兰,等.黑松露多糖分离纯化与抗炎活性研究 [J].现代食品科技,2017,33(3):1-6.
[5]张立明,杨凤琴,袁本香,等.沙棘总黄酮对4种念珠菌的体外抑菌作用 [J].中国医院药学杂志,2010(16):1 355-1 357.
[6]焦岩,常影,王振宇.大果沙棘与3种野生浆果协同抗衰老作用研究 [J].食品科技,2012(7):49-52.
[7]Guo Ruixue, Guo Xinbo, Li Tong, et al.Comparative assessment of phytochemical profiles,antioxidant and antiproliferative activities in sea buckthorn(Hippophae rhamnoides L).Berries[J].Food Chemistry,2017(2):997-1 003.
[8]包怡红,秦蕾.沙棘叶多糖的超声波辅助提取及抑菌作用研究 [J].食品与发酵,2010,36(5):161-166.
[9]张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究 [J].食品科学,2017,37(4):153-158.◇

