肾移植术后急性排斥反应患者血浆miRNA特异性表达谱筛选
晋力,曾仲,刘涛
(昆明医科大学第一附属医院,昆明650000)
目前肾移植已成为治疗终末期肾病的有效手段,但术后排斥反应仍然是引起慢性肾功能不全(CRAD)的重要因素,其中急性排斥反应(AR)被认为是引起CRAD主要免疫性危险因素。microRNA(miRNA)是一类在人体内广泛分布的内源性非编码小分子单链RNA,通常由18~22个核苷酸组成。目前研究证据表明miRNA参与调控超过60%的人类编码基因[1],许多miRNA随着免疫细胞的生长和激活而发生动态变化,其在先天性及获得性免疫中均发挥重要作用[2]。研究证明,miRNA与多种疾病病理相关,如移植肾排斥反应[3]及纤维化[4]等。本研究利用高通量miRNA芯片检测技术,筛选出肾移植AR患者血浆miRNA的特异性表达谱,并采用独立样本通过RT-qPCR技术对芯片结果进行验证,以期寻找血浆中可稳定检测到的、与肾移植AR发生密切相关的miRNA,作为诊断AR的新型生物学标记物。
1 资料与方法
1.1 临床资料 选取本院器官移植科2014年3月~2015年5月首次行同种异体供肾移植术的患者26例,其中男17例、女9例,年龄19~51岁、平均32.9岁,群体反应性抗体<10%,原发性肾小球肾炎导致的慢性肾衰竭19例、糖尿病肾病6例、高血压肾小动脉硬化1例;供受体血型均相配,细胞淋巴毒试验阴性;均服用免疫抑制剂他克莫司、吗替麦考酚酯和强的松。其中AR 13例,纳入标准:出现尿量减少、血压升高、发热、体质量增加、移植肾区胀痛等临床症状;血清肌酐水平升高15%以上,尿蛋白增多,彩色多普勒提示血管阻力指数升高;移植肾活检,按Banff 97标准诊断;抗移植排斥治疗后临床症状改善。非AR 13例,纳入标准:无排斥反应症状,肌酐波动<10%,接受程序性移植肾穿刺活检,且病理结果正常。选取同期本院体检中心体检健康者10例,男6例、女4例,年龄21~45岁、平均32.7岁。AR患者、非AR患者、体检健康者年龄、性别比较差异无统计学意义(P均>0.05);均签署知情同意书。本研究经医院伦理委员会批准。
1.2 标本采集 采集研究对象空腹肘静脉血4 mL,装入涂有乙二胺四乙酸二钾的采血管中,用移液器将血液样本转移至1.5 mL的EP中,4 ℃、1 700 r/min离心10 min,取上清液置于1.5 mL的EP管中,4 ℃、2 000 r/min离心10 min,取血浆置于1.5 mL的EP管中,-80 ℃保存待用。以上过程于4 h内完成。
1.3 miRNA标记物筛选 采用微阵列芯片技术。随机选取3份AR患者及3份非AR患者的血浆,采用TRIzol法提取血浆总RNA,RNA纯度A260/A280≥1.80,表明提取的RNA中蛋白或其他有机物的污染在可接受范围内;另各样本总量≥1 μg,表明样本均满足实验要求。按照miRNA Complete Labeling and Hyb Kit(Agilent)试剂盒说明书进行操作,芯片扫描结果整体背景较低,信号强度较强,且信号点大小近乎均一,表明芯片杂交结果理想。用Agilent Feature Extraction(v10.7)及Agilent GeneSpring 软件提取与分析数据,检测AR与非AR患者血浆miRNA的表达谱。计算两组样品miRNA表达的差异倍数(FC),FC正值表明AR患者血浆miRNA比非AR患者表达高,负值表明AR患者血浆miRNA比非AR患者表达低。差异miRNA筛选标准:FC值>2。
1.4 miRNA临床验证 根据miRNA标记物筛选结果,选择表达显著上调的3种miRNA:miR-142-5p、miR-144-5p及miR-130a-3p作为PCR实验阶段所检测的目标miRNA。提取剩余的10份AR患者、10份非AR患者及10份体检健康者的血浆总RNA,按Qiagen公司的miRNaesy Mini Kit(Cat No./ID 217004)说明书进行操作。根据在miR Base数据库中获得的3个目标miRNA的成熟序列设计3条引物:1条通用的下游引物(GR)、1条特异性上游引物(AS)、1条特异性逆转录引物(RT)。并使用U6作为内参。miR-142-5p的3条引物分别为:5′-GTGCAGGGTCCGAGGT-3′(GR)、5′-CGGGCATAAAGTAGAAAGCAC-3′(AS)、5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACagtagt-3′ (RT);miR-144-5p的3条引物分别为:5′-GTGCAGGGTCCGAGGT-3′(GR)、5′-CGGGCGGATATCATCATATACTG-3′(AS)、5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACcttaca-3′(RT);miR-130a-3p的3条引物分别为:5′-GTGCAGGGTCCGAGGT-3(GR)、5′-CGGCAGTGCAATGTTAAAAGG-3′(AS)、5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACatgccc-3′(RT);内参U6的2条引物分别为:5′-CTCGCTTCGGCAGCACA-3′(F)、5′-AACGCTTCACGAATTTGCGT-3′(R)。按Thermo Fisher公司的RevertAid First Strand cDNA Synthesis Kit(K1622)试剂盒说明书使用茎环法对3个目标miRNA进行逆转录,获得cDNA。以第1链cDNA为模板进行PCR扩增,扩增体系:模板1 μL、Syber Green Master 6 μL、特异性上游引物1 μL、通用的下游引物1 μL、RNase-Free water 3 μL;反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行50~55个循环;4 ℃/s匀速升温至95 ℃后恒温15 s;4 ℃/s匀速降温至60 ℃后恒温1 min;4 ℃/s匀速升温至95 ℃后恒温15 s;在最后步骤中每升温1 ℃采集1次荧光信号绘制熔解曲线。用U6作为内参照,使用软件直接得到各样本中has-miR-142-5p、has-miR-144-5p及has-miR-130a-3p的循环数值(Ct值)。用2-ΔΔCt法计算各miRNA的相对表达量。
2 结果
2.1 AR患者与非AR患者miRNA表达谱比较 AR患者与非AR患者共检测出96个差异表达的miRNA,其中13个(13.5%)表达上调(P<0.05)、7个(7.3%)表达下调(P均<0.05)。见表1。
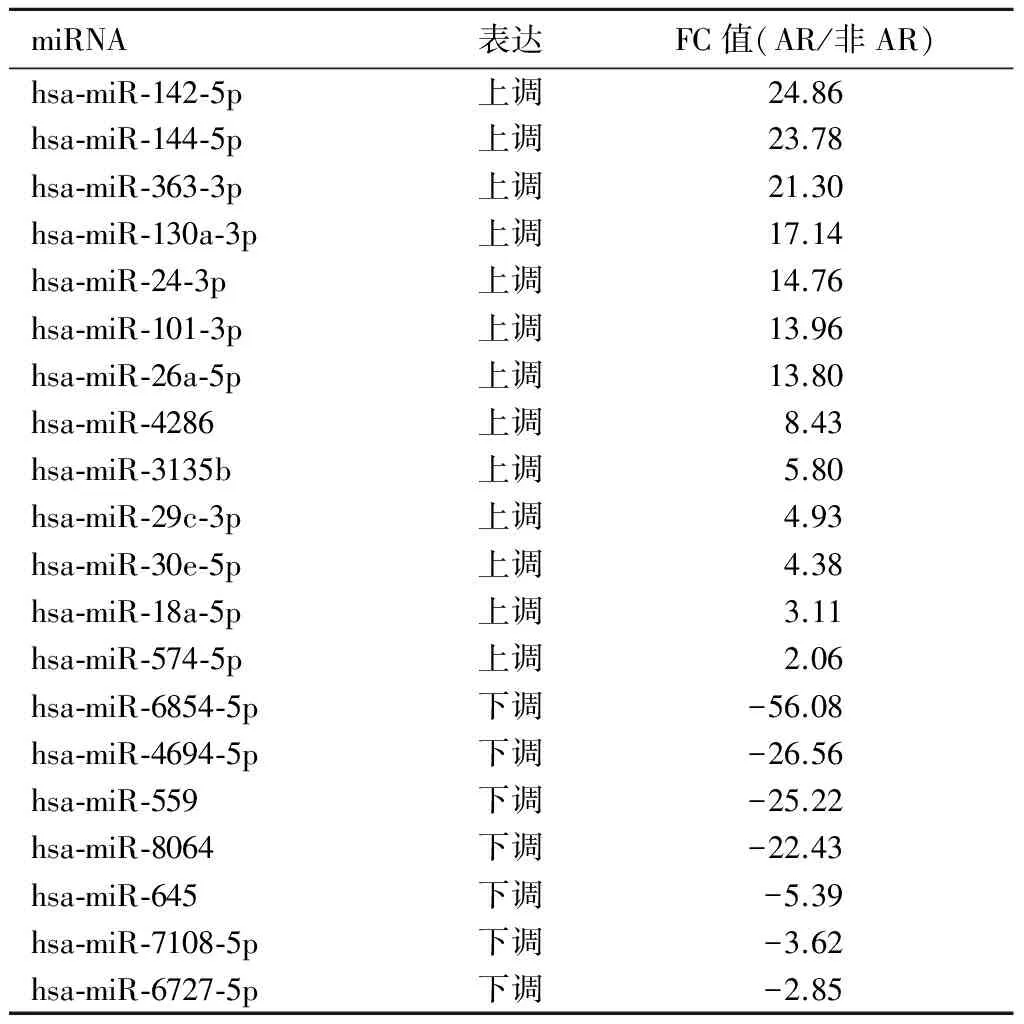
表1 AR患者与非AR患者miRNA表达谱比较
2.2 miRNA表达谱临床验证结果 AR患者血浆miR-142-5p、miR-144-5p、miR-130a-3p相比表达量均高于非AR患者、体检健康者(P均<0.05),非AR患者、体检健康者血浆miR-142-5p、miR-144-5p、miR-130a-3p相比表达量比较差异无统计学意义(P均>0.05)。见表1。
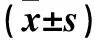
表1 AR患者、非AR患者、体检健康者血浆miR-142-5p、miR-144-5p、miR-130a-3p表达比较
3 讨论
AR是影响移植肾长期存活的主要因素之一,早期诊断并及时治疗AR可有效降低移植肾的病理损害程度,并延长其存活时间。移植肾急性排斥反应诊断的金标准为肾穿刺病理检查,但为有创检查,且可能需多次穿刺才能符合AR的病理诊断标准;同时受抽样误差、病理医师水平等因素的影响,均可增加误诊风险[5,6]。因此,临床迫切需要具有高度敏感性及特异性,可稳定检测的、与肾移植AR密切相关的指标,作为诊断AR的新型生物学标记物。
近年来,研究表明miRNA与肾移植术后AR的发生密切相关。Sui等[7]通过比较3例AR患者肾活检样本与3例正常肾皮质样本之间的miRNA表达谱,发现AR组中有8种miRNA表达上调,12种miRNA表达下调。Anglicheau等[8]研究发现,AR患者有7种miRNA表达上调,10种表达下调。以上研究均采用肾脏组织作为芯片检测样本,这与从患者血液或尿液中无创检测出目标miRNA存在一定差异。Lorenzen等[3]用实时定量PCR技术,分别检测了AR组与非AR组患者尿液中miR-10a、miR-10b及miR-210的表达,结果显示AR组相比非AR组,其miR-10a表达上调,而miR-10b及miR-210表达下调。刘小友等[9]获取了12例肾移植术后发生AR患者及21例未发生AR患者的血液样本,AR组外周血中miR-223表达升高,并在术后一直维持高表达状态,且灵敏度为0.92、特异度为0.90。该研究同样检测了外周血单个核细胞在激活与非激活状态下的miR-223表达,结果显示激活组中miR-223的表达增加3.76倍。本研究通过获取被检人群的血浆作为试验样本,利用芯片及PCR技术,比较miRNA的表达。结果显示,肾移植AR组与非AR组之间共检测出96个差异表达的miRNA,其中20个miRNA表达差异显著,13个表达上调,7个表达下调。以上表达差异的miRNA可作为进一步筛选AR发生的依据。进一步采用独立样本,对芯片检测结果中表达上调的3个目标miRNA进行PCR定量检测,结果显示相比非AR组及正常对照组,AR组中miR-142-5p、miR-144-5p及miR-130a-3p的表达上调,这与芯片结果相一致。提示以上3个miRNA可能与肾移植术后AR的发生有关。
研究表明miR-142-5p不仅在肾移植AR患者的活检标本中高表达,在其他病理过程中也有高表达的情况发生,如肿瘤、免疫相关障碍、小肠炎等。Anglicheau等[8]研究认为肾移植AR患者移植肾活检组织中miR-142-5p的表达上调,可能与淋巴细胞的直接浸润相关。考虑到造血细胞系中存在的大量miR-142-5p[10,11],推测miRNA可能是由淋巴细胞携带进入异体移植物,从而影响局部炎症反应。另有研究认为,异体移植物本身可诱导发生一系列阻止排斥反应发生的调节过程,但在调节的同时仍有排斥反应在发生,可能是由于异体抗原的持续暴露[12]。
Su等[13]指出miRNA主要调节免疫细胞的功能,但其在巨噬细胞主导的纤维化中的作用还不明确;在巨噬细胞内,IL-4及IL-13共同诱导miR-142-5p及miR-130a-3p表达上调,以维持巨噬细胞的纤维化;同时指出miR-142-5p及miR-130a-3p可在慢性炎症中调控巨噬细胞纤维化相关基因的表达。本研究发现,AR患者中miR-142-5p及miR-130a-3p表达上调,推测相关miRNA可能通过提高移植肾内炎症因子的表达,增加巨噬细胞的趋化性,以影响肾移植AR微环境的炎症反应。另外,Ouyang等[14]研究发现,在三阴乳腺癌组织中miR-130a-3p及miR-451a表达下调,提示miR-130a-3p还可能与乳腺癌的发生有关。
Matsushita等[15]研究发现,在膀胱癌细胞中miR-144-5p的表达下调,并显著抑制肿瘤细胞增殖,且直接调控细胞周期调控基因CCNE1、CCNE2及CDC25A的表达。在乳腺癌患者外周血单核细胞中,miR-144-5p表达上调,miR-144-5p可作为预测乳腺癌发生的潜在非侵入性生物学标记物,但对于肾移植AR则无相关报道。
排斥反应是移植后肾功能异常的主要影响因素,从术后4 d至10年都有可能发生AR。术后5年内,在发生移植肾功能异常的受者中,AR占据了很大的比例。有统计显示,在程序性移植肾穿刺时,AR患者的肌酐水平较高,但在施加干预措施后,其肌酐水平明显下降,1年后移植肾功能丧失比例较低,相反在肾穿刺时慢性排斥反应患者的肌酐水平较低,但穿刺活检后1年移植肾功能丧失比例较高,且预后较差。以上表明,AR如能早发现、早治疗,可以逆转,且能取得良好的治疗效果。
本研究用高通量miRNA芯片检测技术,筛选肾移植AR患者血浆中miRNA的特异性表达谱;并用独立样本通过定量PCR技术验证芯片结果,发现肾移植术后患者血浆中miR-142-5p、miR-144-5p、miR-130a-3p表达上调,这可能与移植肾急性排斥反应的发生发展相关,其各自在移植肾排斥反应中的作用值得进一步研究。AR患者与非AR患者检测出差异表达的miRNA,为今后研究其在肾移植AR发生中的作用机制提供依据。
[1] Friedman RC, Farh KK, Burge CB, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009,19(1):92-105.
[2] Lindsay MA. MicroRNAs and the immune response[J]. Trends Immunol, 2008,29(7):343-351.
[3] Lorenzen JM, Volkmann I, Fiedler J, et al. Urinary miR-210 as a mediator of acute T-cell mediated rejection in renal allograft recipients[J]. Am J Transplant, 2011,11(10):2221-2227.
[4] Scian MJ, Maluf DG, David K, et al. MicroRNA profiles in allograft tissues and paired urines associate with chronic allograft dysfunction with IF/TA[J]. Am J Transplant, 2011,11(10):2110-2122.
[5] Williams WW, Taheri D, Tolkoff-Rubin N, et al. Clinical role of the renal transplant biopsy[J]. Nat Rev Nephrol, 2012,8(2):110-121.
[6] Furness PN, Taub N. Convergence of european renal transplant pathology assessment procedures. international variation in the interpretation of renal transplant biopsies: report of the CERTPAP Project[J]. Kidney Int, 2001,60(5):1998-2012.
[7] Sui W, Dai Y, Huang Y, et al. Microarray analysis of MicroRNA expression in acute rejection after renal transplantation[J]. Transpl Immunol, 2008,19(1):81-85.
[8] Anglicheau D, Sharma VK, Ding R, et al. MicroRNA expression profiles predictive of human renal allograft status[J]. Proc Natl Acad Sci U S A, 2009,106(13):5330-5335.
[9] 刘小友,徐健.Micro-RNA-223参与肾移植后急性排斥反应中的作用[J].细胞与分子免疫学杂志,2011,27(10):1121-1123.
[10] Basso K, Sumazin P, Morozov P, et al. Identification of the human mature B cell miRNome[J]. Immunity, 2009,30(5):744-752.
[11] Chen CZ, Li L, Lodish HF, et al. MicroRNAs modulate hematopoietic lineage differentiation[J]. Science, 2004,303(5654):83-86.
[12] Hamano K, Rawsthorne MA, Bushell AR, et al. Evidence that the continued presence of the organ graft and not peripheral donor microchimerism is essential for maintenance of tolerance to alloantigen in vivo in anti-CD4 treated recipients[J]. Transplantation, 1996,62(6):856-860.
[13] Su S, Zhao Q, He C, et al. MiR-142-5p and miR-130a-3p are regulated by IL-4 and IL-13 and control profibrogenic macrophage program[J]. Nat Commun, 2015,6:8523.
[14] Ouyang M, Li Y, Ye S, et al. MicroRNA profiling implies new markers of chemoresistance of triple-negative breast cancer[J]. PLoS One, 2014,9(5):e96228.
[15] Matsushita R, Seki N, Chiyomaru T, et al. Tumour-suppressive microRNA-144-5p directly targets CCNE1/2 as potential prognostic markers in bladder cancer[J]. Br J Cancer, 2015,113(2):282-289.

