荔枝核总黄酮对TGF-β1诱导人肝星状细胞凋亡的影响及机制
曹杰,林丽馨,覃桂金,肖绪华,霍群,赵永忠
(1桂林医学院附属医院,广西桂林541000;2广西壮族自治区南溪山医院;3桂林医学院)
肝纤维化(HF)的主要特征为细胞外基质(ECM)在肝内过度沉积,是一种常见的慢性组织损伤的细胞创伤愈合反应[1]。活化的肝星状细胞(HSC)是ECM的主要来源,在HF的发展过程中扮演重要角色。研究表明,HF处于动态变化过程中是可逆的[2],故使活化及增殖的HSC被抑制并诱导其凋亡有望成为抗HF的有效方法[1]。Toll样受体4(TLR4)/核因子κB(NF-κB)信号通路在HF过程中起重要作用,是肝细胞凋亡途径之一。目前常规西药对HF的治疗效果不理想[3]。抗纤维化的相关中药受到了广泛重视。荔枝盛产于两广地区,荔枝核中具有药理活性的主要物质之一为荔枝核总黄酮(TFL)。研究证明,TFL对胆汁淤积性大鼠有较好的抗纤维化效果,且可阻滞HSC增殖、诱导其凋亡,达到抗HF的效果[4~6]。2015年12月~2016年5月,本研究以人肝星状细胞(HSC-LX2)为研究对象,探讨TFL对活化的HSC-LX2凋亡的影响,进一步明确其干预HF进展的相关分子机制,为TFL的临床应用提供理论依据。
1 材料与方法
1.1 细胞、试剂及仪器 HSC-LX2(中美合资博慧斯生物医药科技有限公司)。TFL(南京泽朗医药科技有限公司,纯度 80%)。DMEM 高糖培养液(GIBCO公司);胎牛血清FBS(GEMINI公司);转化生长因子β1(TGF-β1,美国Peprotech公司);TLR4单克隆抗体(Abcam公司);NF-κB p65单克隆抗体(ProMab公司);Anti白细胞介素1受体Ⅰ(IL-1RⅠ)多克隆抗体(Abcam公司);β-Actin单克隆抗体、山羊抗小鼠IgG 抗体(北京中杉金桥公司);山羊抗兔IgG 抗体(北京中杉金桥公司);流式凋亡试剂盒(美国BD公司);流式周期试剂盒(北京四正柏生物科技有限公司);Hoechst33258(碧云天公司)。流式细胞仪(美国BD 公司),电泳仪(北京六一仪器厂),全自动凝胶成像分析系统(上海培清JS-780),全自动化学发光图像分析系统(上海Tanon 5200),倒置相差显微镜(德国蔡司)。
1.2 试剂配制 配制TGF-β1:用pH=3的柠檬酸钠试剂将TGF-β1粉末充分溶解,配制成168 ng/μL的母液,-20 ℃保存;取母液,配制成20 μg/L的储存液,4 ℃保存。配制TFL:用DMSO试剂将纯度80%的TFL充分溶解,将溶解的TFL溶于DMEM(含10%FBS及靑链霉素)中,配制成1 g/L的母液。将母液配制成实验所需的药物浓度,同时使各组中(除正常组外)TGF-β1的终浓度为5 μg/L[7]。
1.3 细胞培养 将细胞接种于含10% FBS的DMEM(含青霉素+链霉素)培养液中,于37 ℃、5% CO2及合适湿度的培养箱中培养。当细胞处于对数生长期时,用含EDTA的胰蛋白酶消化传代。将细胞随机分为正常组、TGF-β1组及150、300、600 mg/L TFL组。正常组常规培养;其他四组接种于含10% FBS的DMEM+5 μg/L TGF-β1、10 cm培养皿中,培养24 h后,150、300、600 mg/L TFL组分别加入150、300、600 mg/L TFL培养48 h[5]。
1.4 细胞形态学变化观察 采用Hoechst33258染色法。收集各组细胞,吸尽培养液,PBS洗2次,固定10 min,PBS洗2次;加Hoechst 33258染色液,避光染色5 min;PBS洗2次,封片。用倒置相差显微镜观察并拍照,实验重复3次。
1.5 细胞周期检测 采用流式细胞术。收集各组细胞,用含EDTA的胰酶进行消化,收集细胞于EP管中,PBS冲洗2 次,1 000 r/min离心5 min,弃上清液,用PBS 1 mL 悬浮细胞,95%乙醇(4 mL)冰浴,4 ℃冰箱过夜。1 000 r/min 离心5 min,PBS 冲洗1次,每个样本加入400 μL PI染色液(1倍),重悬细胞,37 ℃ 避光孵育30 min,上机检测各周期细胞比例。实验重复3次。
1.6 细胞凋亡检测 采用FITC Annexin V/PI双染色法。收集各组细胞,用不含EDTA的胰酶进行消化,收集细胞于EP管中,PBS冲洗2次,4 ℃离心机离心,2 000 r /min,10 min;弃上清液,加入Buffer缓冲液100 μL,混匀;避光加入FITC Annexin V 5 μL+PI 5 μL,室温避光孵育30 min,上机前加Buffer缓冲液200 μL,混匀,200~300目过滤,流式细胞仪检测细胞早期(细胞膜外翻)、晚期(细胞膜外翻,细胞释放其他物质)凋亡情况,计算细胞凋亡率。实验重复3次。
1.7 细胞内TLR4、NF-κB、IL-1RⅠ蛋白表达检测 采用Western blotting法。收集各组细胞,用胰蛋白酶进行消化,收集细胞于EP管,PBS清洗3遍,1 000 r/min离心,离心3次,每次5 min,加入足量蛋白裂解液,冰上充分裂解,4 ℃,15 000 r/min离心后,上清液即为所提蛋白。采用BCA法测定蛋白浓度。SDS-PAGE凝胶电泳,湿转法转膜,BSA封闭,孵育一抗,孵育二抗,发光显色,实验重复3次。蛋白相对表达量=目的蛋白条带灰度值/内参蛋白条带灰度值。
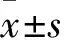
2 结果
2.1 各组细胞形态学变化比较 TGF-β1组细胞增殖活跃,呈聚集状,胞体增大,胞突伸展、延长,数量明显增加。正常组、TGF-β1组细胞核形态完整;150、300、600 mg/L TFL组可见细胞核固缩、裂解、凋亡小体形成等细胞凋亡形态学变化,并随TFL浓度的升高,细胞数量减少,凋亡细胞增多。
2.2 TFL对HSC-LX2周期的影响 随TFL浓度升高,TFL组G0/G1期细胞增多(P<0.05),S期细胞减少(P<0.05)。见表1。
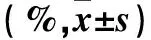
表1 各组不同周期细胞分布比较
注:与TGF-β1组比较,*P<0.05;与150 mg/L TFL组比较,△P<0.05;与300 mg/L TFL组比较,▲P<0.05。
2.3 TFL对HSC-LX2凋亡的影响 随TFL浓度的升高,TFL对HSC-LX2细胞凋亡促进作用增强,更倾向于促进细胞晚期凋亡。见表2。
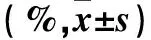
表2 各组细胞凋亡率比较
注:与TGF-β1组比较,*P<0.05;与150 mg/L TFL组比较,△P<0.05;与300 mg/L TFL组比较,▲P<0.05。
2.4 TFL对HSC-LX2内TLR4、NF-κB、IL-1RⅠ蛋白表达的影响 150、300、600 mg/L TFL组TLR4、NF-κB、IL-1RⅠ蛋白表达量低于TGF-β1组(P均<0.05),且随TFL浓度升高,HSC-LX2内TLR4、NF-κB、IL-1RⅠ蛋白表达量逐渐降低(P均<0.05)。见表3。
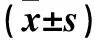
表3 各组TLR4、NF-κB、IL-1RⅠ蛋白相对表达量比较
注:与TGF-β1组比较,*P<0.05;与150 mg/L TFL组比较,△P<0.05;与300 mg/L TFL组比较,▲P<0.05。
3 讨论
HF是各种因素引起的病理性慢性炎症修复反应。当肝细胞损伤时,促发炎症反应,分泌大量细胞因子和化学介质,共同作用于HSC,使HSC发生活化,合成大量ECM,沉积于肝内,导致HF的发生发展[8]。伴随细胞因子与相应受体结合的HSC活化与增殖,是HF的关键环节。
细胞周期可分为四个阶段:G0/G1期即DNA合成前期,为DNA合成做准备;S期即DNA合成期;G2期即DNA合成后期;M期又称D期即有丝分裂期。HSC-LX2细经TGF-β1活化后,可见细胞胞体增大,胞突伸展、延长,且数量明显增加,呈增殖状态。流式细胞术检测显示,TFL作用于增殖的HSC-LX2,使HSC-LX2阻滞于G0/G1期,不能为DNA合成准备原料,DNA无法合成,致使细胞增殖分裂无法进行,细胞周期被阻滞。细胞凋亡是主动进行的,是由基因调控的程序性死亡,在生物体的生长发育、各种疾病的发生发展过程中都发挥重要作用。结果显示,TFL作用于增殖的HSC-LX2后,可见细胞核固缩、裂解、凋亡小体形成等,呈现凋亡形态学变化,且随着药物组浓度的增大,细胞数量减少,凋亡比例增加。同时TFL对HSC-LX2凋亡具有促进作用,且更倾向于促进细胞晚期凋亡,达到抗HF的效果。然而,其分子机制仍不明确,仍需进一步明确其可能存在的关系。
TLR是先天免疫识别受体,在人体内具有重要作用,其与炎症反应及纤维化形成过程中的信号传递关系紧密。TLR4在多种细胞上表达,其中包括HSC;不管是静止的HSC还是活化的HSC,均表达TLR4。TLR4的完整信号转导通路存在于活化的HSC中。TLR4激活后通过信号转导使下游的核心因子NF-κB激活,活化的NF-κB进人细胞核进行转录调控,诱导细胞凋亡[9]。NF-κB具有多向性调节作用,参与调控多种因子的表达,在免疫调控、炎症、应激反应及细胞凋亡中发挥重要作用[10]。活化的NF-κB调控炎性因子的表达,大量炎性介质被释放,引起肝脏损害[11]。本研究结果显示,TGF-β1激活后的HSC-LX2,经TFL干预后,细胞内TLR4、NF-κB蛋白表达降低。韦铮武等[12]研究表明,TFL可通过降低TLR4、NF-κB在活化的HSC-T6中的表达,抑制细胞增殖,促进细胞凋亡,减轻HF。因此,推测TFL诱导活化的HSC-LX2凋亡的分子机制可能与降低TLR4、NF-κB的表达相关,从而达到抗纤维化的效果。
IL-1为重要的免疫和炎性反应调节因子,有研究显示,IL-1在炎性致病机制中起决定作用;而IL-1存在于大多数体内细胞,当发生炎症反应时,IL-1可迅速发生作用[13]。IL-1可促进HSC活化、增生及抑制ECM的降解[14]。当肝细胞损伤时,IL-1可以加重肝脏损伤[15]。研究发现,IL-1是NF-κB信号通路最重要的炎症细胞因子,通过与跨膜受体IL-1受体(IL-1R)结合后激活下游信号通路,在HF发生发展中起重要作用[16]。当致炎因子作用于机体时,IL-1与相应受体结合,传导生物学信号,发挥生物学效应。IL-1受体家族包括IL-1RⅠ和IL-1RⅡ。目前认为IL-1RⅠ是IL-1的主要受体。TLR细胞内区域的其中约200个氨基酸与IL-1RⅠ及其他数种植物疾病抵抗蛋白具有高度的同源性,称TIR[17]。TLR和IL-1R构成的系统TLR-IL-1R是炎性反应时机体产生免疫应答和炎症反应的关键信号系统。有研究表明,大黄和丹参通过弱化TLR-IL-1R信号通路的作用,控制急性胰腺炎炎症的放大过程[18]。本研究结果表明,各浓度TFL组TLR4、IL-1RⅠ蛋白表达降低,且呈浓度依赖性,随TFL浓度升高,TLR4、IL-1RⅠ蛋白表达逐渐减低。因此,推测TLR-IL-1R炎症通路可能参与了HF的过程,但其具体分子机制尚待进一步研究。因此,通过抑制TLR-IL-1R炎症通路,有望成为抗HF的一条新途径。
总之,导致HF发生发展的信号传导通路众多,且通路之间相互交叉,细胞及动物实验目前尚不能明确其具体机制,仍需进一步研究证实。
[1] Li J, Dong N, Cheng S, et al. Tetramethylpyrazine inhibits CTGF and Smad2/3 expression and proliferation of hepatic stellate cells[J]. Biotechnol Biotechnol Equip, 2015,29(1):124-131.
[2] Seki E, Brenner DA. Recent advancement of molecular mechanisms of liver fibrosis[J]. J Hepatobiliary Pancreat Sci, 2015,22(7):512-518.
[3] 夏海珊,陈少茹,钟月春,等.肝纤维化的发病机制和药物治疗现况[J].中国医药导报,2014,11(18):162-165,168.
[4] 成秋宸,赵永忠,肖绪华,等.荔枝核总黄酮改善胆总管结扎大鼠胆汁淤积症状的研究[J].天津医药,2014,42(3):224-227.
[5] 李彩,林丽馨,肖绪华,等.荔枝核总黄酮抑制人肝星状细胞增殖作用机制的研究[J].安徽医科大学学报,2016,51(2):171-175.
[6] 刘瑞,陈桂泓,徐伶俐,等.荔枝核总黄酮及罗格列酮对大鼠肝星状细胞HSC-T6 PPAR-γ和CTGF表达的影响[J].实用医学杂志,2016,32(3):344-347.
[7] Eng FJ, Friedman SL, Fibrogenesis I. New insights into hepatic stel-late cell activation: the simple becomes complex[J]. Am J Physiol Gastrointest Liver Physiol, 2000,279(1):G7-G11.
[8] Freeman TF, Kharbanda KK. Inhibition of hepatic stellate cell collagen synthesis by N-(methl amino) is obutyric acid[J]. Biochem Pharmacol, 2002,63(4):697-706.
[9] Bovijn C, Desmet AS, Uyttendaele I, et al. Identification of binding sites for myeloid differentiation primary response gene 88(MyD88)and Toll-like receptor 4 in MyD88 adaptter-like(Mal)[J]. J Biol Chem, 2013,288(17):12054-12066.
[10] Karin M. Nuclear factor-kappa B in cancer development and progression [J]. Nature, 2006,441(7092):431-436.
[11] Gu YJ, Sun WY, Zhang S, et al. Advances in the study of β-ar-restins and fibrosis [J]. Chin Pharmacol Bull, 2015,31(2):171-175.
[12] 韦铮武,李彩,林丽馨,等.荔枝核总黄酮对体外活化肝星状细胞-T6增殖、凋亡及TLR4/NF-κB途径的影响[J].中华中医药杂志,2016,31(12):5214-5218.
[13] Subramaniam S, Stansberg C, Cunningham C. Theinterleukin1 receptor family[J]. Dev Comp Immunol, 2004,28(5):415-428.
[14] Kida Y, Xia Z, Zheng S, et al. Interleukin-1 as an injury signal mobilizes retinyl esters in hepatic stellate cells through down regulation of lecithin retinol acyltransferase [J]. PLoS One, 2011,6(11):e26644.
[15] Gieling RG, Wallace K, Han YP. Interleukin-1 participates in the progression from liver injury to fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2009,296:G1324-G1331.
[16] Olavarria VH, Sepulcre MP, Figueroa JE, et al. Prolactin-induced production of reactive oxygen species and IL-1beta in leukocytes from the bony fish gilthead seabream involves Jak/Stat and NF-kappaB signaling pathways[J]. J Immunol, 2010,185(7):p3873-p3883.
[17] 司宇红,焦炳华.Toll样受体及其信号转导[J].生物化学与生物物理进展,2001,28(3):304-308.
[18] 李钢,赵金锋,王凯诚,等.大黄丹参上调β-arrestin基因表达阻止大鼠实验性急性胰腺炎重症化进程[J].中华中医药学刊,2013,31(9):1895-1897.

