苎麻BnNRT1.1基因的克隆及表达特性研究
侯美,高钢,朱爱国,陈平,陈继康,陈坤梅,熊和平,喻春明
(中国农业科学院麻类研究所,长沙410205)
苎麻(Boehmeria nivea L.Gauld)是荨麻科苎麻属多年生草本植物[1],其蛋白质含量高,营养丰富,生物产量大,再生能力强,是很好的饲用植物蛋白质来源[2],其营养价值与苜蓿(Medicago sativa)相近[3-4]。在正常条件下,硝酸盐是苎麻从外界吸收的主要氮源,提高苎麻的氮素利用率,便可有效提高苎麻的经济效益。在拟南芥中第一个发现的硝酸盐转运蛋白是硝酸盐转运蛋白1.1(nitrate transporter1.1,NRT1.1)[5],其通过氨基酸序列中第101位苏氨酸发生磷酸化修饰而表现出双亲和转运功能[6]。有研究表明,硝酸盐在拟南芥中的主要传感器是NRT1.1[7]。在小麦中发现经氮饥饿处理后TaNRT1.1表达受到显著抑制[8];在水稻中发现NRT1.1B是一个高氮利用率基因,在育种中有着重要的应用价值[9]。另外,在白菜、茶树、菊花等作物中成功克隆出NRT1.1基因,并对其进行功能鉴定[10-12]。目前关于苎麻对硝酸盐吸收利用的分子机制研究较少,尚不清楚苎麻硝酸盐转运蛋白1.1(BnNRT1.1)在苎麻对氮素吸收利用过程中发挥的作用。本研究拟通过克隆获得苎麻BnNRT1.1基因的cDNA全长序列,并对其进行生物信息学分析与表达特性研究,以期为苎麻BnNRT1.1基因的功能研究提供参考,并为提高苎麻氮素利用率奠定分子生物学基础。
1 材料与方法
1.1 试验材料
以中国农业科学院麻类研究所苎麻资源圃中龙潭大麻与青皮杆麻两个苎麻品种为试验材料(前期试验发现龙潭大麻的氮同化效率显著高于青皮杆麻)。
1.2 试验设计
在中国农业科学院麻类研究所苎麻资源圃中取苎麻品种龙潭大麻与青皮杆麻植株,削苗后进行扦插,扦插苗长度约12~15 cm,顶端保留3~4片嫩叶,将削好的扦插苗浸入稀释500倍的多菌灵中消毒30 s,扦插到Karen牌无土栽培水培仪内,置于环境温度为25℃、光/暗周期为16/8 h的温室内培养[13],设计3次生物学重复。先在水培仪中加入10 L自来水,15 d后,将水培仪中的自来水换成10 L氮浓度为9 mmol/L的营养液,其中大量元素基本组成为:Ca(NO3)2·4H2O(472.3 mg/L)、KNO3(505.55 mg/L)、KH2PO4(136.07 mg/L)、MgSO4·7H2O(492.96 mg/L)、CaCl2·2H2O(441.06 mg/L),微量元素配方参考汤涤洛[14]的方法,在处理 0 h、12 h、1 d、3 d、5 d后分别取样,并将其根、茎、叶分开,液氮速冻后,于-80℃冰箱保存,作为提取总RNA的试验材料。
1.3 RNA的提取、cDNA第一链的合成
取0.1 g苎麻新鲜叶片,利用RNA提取试剂盒(EASYspin Plus Plant RNA Kit,Aidlab biotech)提取苎麻总RNA,具体操作步骤参照北京艾德莱公司的EASYspin Plus Plant RNA Kit说明书,提取后用1%琼脂糖凝胶电泳和Nanodrop进行质量检测,合格后进行cDNA第一链的合成,具体步骤参考cDNA合成试剂盒(RevertAid First Strand cDNA Synthesis Kit,Thermo)说明书。
1.4 获取苎麻BnNRT1.1基因全长cDNA序列
利用拟南芥AtNRT1.1基因序列和ncbi-blast-2.5.0+-win64软件,与苎麻转组数据库[15]unigenes序列进行比对,检索目的序列,通过NCBI对目的序列进行进一步确认,利用oligo7软件在目的基因ORF区域两头设计引物,BnNRT1.1-F:ATGGCAAGTGGTCTCCCCC,BnNRT1.1-R:GTGACACACAACATCATGAA,扩增苎麻BnNRT1.1全长cDNA序列。以cDNA第一链为模板进行扩增,PCR反应条件为:94℃ 3min,94℃30 s,58℃ 30 s,72℃2 min,30个循环,72℃5 min。反应产物经1%琼脂糖凝胶电泳检测回收后,连接到pClone007 Simple载体并转化大肠杆菌DH5α,在Xgal/IPTG琼脂糖平板上挑选白色菌落,PCR验证为阳性菌落后进行测序,由北京擎科生物长沙测序部完成。
1.5 生物信息学数据库与软件分析
DNA序列的翻译及分析用DNAMAN进行;基因开放阅读框用NCBI提供的在线ORFfinder寻找,预测和分析BnNRT1.1基因编码的产物借助ExPASy在线数据库,理化性质采用ProtParam分析软件预测;亲水性/疏水性采用ProtScale预测;苎麻BnNRT1.1蛋白跨膜结构采用TMHMM预测;苎麻BnNRT1.1亚细胞定位及功能分类分别采用PSORT和ProtFun预测;采用NetPhoS 2.0分析苎麻BnNRT1.1蛋白潜在的磷酸化修饰位点;系统发育树构建采用MEGA6软件。
1.6 苎麻BnNRT1.1基因的表达特性研究
利用实时荧光定量聚合酶链式反应(qRT-PCR)进行苎麻BnNRT1.1基因的表达特性研究,以苎麻管家基因18S rRNA作为内参基因[16],通过Primer5设计目的基因引物,F(5’-3’)-:AGTTCGACGAGTCGGACAAG,R(5’-3’) -AGATTCCGTAGCCCCAGTCT,反应体系为 5.0μL 2×PowerUpTMSYBRTMGreen Master Mix,0.2μL 10μmol/L Forward primer,0.2μL 10μmol/L Reverse primer,1μL cDNA,3.6μL dd H2O。反应程序:95℃ 2 min,95℃ 15 s,60℃ 15 s,72℃ 30 s,40个循环,根据CT值,用公式2-ΔΔCT分别计算出目标基因的相对表达量。
2 结果与分析
2.1 样品RNA质量检测
提取的总RNA经1%琼脂糖凝胶电泳检测,结果如图1A所示。可见28S rRNA,18S rRNA和5S rRNA条带非常清晰,且28S rRNA是18S rRNA的2倍左右。为进一步确定RNA质量,使用Naonodrop2000进行浓度检测,结果显示所提取 RNA浓度为436.9 ng/μL,A260/A280为2.07,A260/A230为2.06,说明此RNA完整性较好,纯度较高,不存在蛋白质、多糖和酚类物质的明显污染,符合试验要求,可用于后续试验。
2.2 目的片段的PCR扩增与克隆鉴定
以提取的苎麻总RNA为模板,反转录成cDNA,用合成的引物进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,如图1B所示。将目的片段回收纯化后连接到pClone007 Simple载体并转化大肠杆菌,对白斑进行PCR菌液鉴定,确定为阳性菌落,如图1C所示。进行测序后得到BnNRT1.1全长序列1869 bp,其中含开放阅读框(ORF)1776 bp,其编码的核苷酸序列与氨基酸序列如图2所示。

图1 1%琼脂糖凝胶电泳Fig.11%agarose gel electrophoresis



图2 苎麻BnNRT1.1的核苷酸序列及氨基酸序列Fig.2 Nucleotide sequence and amino acid sequence of BnNRT1.1
2.3 苎麻BnNRT1.1基因的生物信息学分析
2.3.1 苎麻BnNRT1.1蛋白的氨基酸序列分析
ProtParam预测显示,苎麻BnNRT1.1基因编码591个氨基酸残基,蛋白质相对分子质量为65.25 kD,等电点是8.85,理论推导半衰期大于10 h,不稳定参数(Instability index)为31.49,属稳定蛋白,脂溶指数(Aliphatic index)为98.17,属脂溶蛋白,总平均亲水性为0.325,为疏水性蛋白。ExPASy网站的SPOMA信息库对该蛋白质序列进行二级结构预测,结果显示苎麻BnNRT1.1蛋白的二级结构以 α-螺旋(alpha helix)、无规则卷曲(random coil)、延伸链(extended strand)、β-转角(beta turn)为结构元件,分别占41.12%、32.99%、17.26%、8.63%。
2.3.2 苎麻BnNRT1.1蛋白跨膜结构分析
通过软件TMHMM Server v.2.0对苎麻BnNRT1.1蛋白跨膜结构预测,结果如图3所示。苎麻BnNRT1.1蛋白具有12个跨膜结构,在第6和第7个跨膜结构域之间存在一个大的亲水环,符合PTR家族跨膜结构特征。
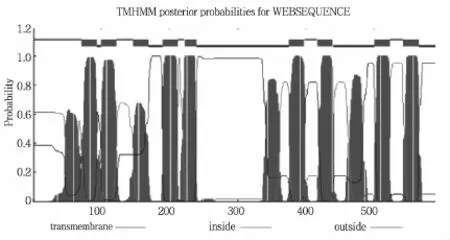
图3 苎麻BnNRT1.1蛋白的跨膜结构域预测结果Fig.3 Prediction of transmembrane domain of BnNRT1.1 protein in Ramie
2.3.3 苎麻BnNRT1.1蛋白亚细胞定位及功能预测
采用软件WoLF PSORT II对苎麻BnNRT1.1蛋白进行亚细胞定位预测,结果见表1。苎麻Bn-NRT1.1蛋白主要定位在细胞质膜与囊泡中,为膜蛋白。通过Protfun分析软件预测基因BnNRT1.1编码产物功能,结果见表2。由表2可知,该蛋白主要具有信号转导与转运功能。采用NetPhoS2.0分析苎麻BnNRT1.1蛋白潜在的磷酸化修饰位点,预测显示苎麻BnNRT1.1蛋白具有9个丝氨酸激酶磷酸化位点、5个苏氨酸激酶磷酸化位点、1个酪氨酸激酶磷酸化位点。

表1 苎麻BnNRT1.1蛋白亚细胞定位预测结果Tab.1 Subcellular prediction results of BnNRT1.1 of camellia sinensis

表2 BnNRT1.1蛋白的功能预测结果Tab.2 Functional prediction results of BnNRT1.1 protein
2.3.4 系统进化树的构建
在NCBI中,将苎麻BnNRT1.1进行blast比对,发现苎麻BnNRT1.1基因序列与樱桃、白梨、桑树、梅、草莓、巨桉、桃树、核桃、木豆的NRT1序列具有较高相似度,其序列相似度均大于70%。通过MEGA6构建系统进化树,如图4所示,苎麻与樱桃、白梨、桑树在一个分支上,具有同源关系。

图4 苎麻BnNRT1.1基因系统进化树分析Fig.4 Phylogenetic tree analysis of BnNRT1.1 gene in ramie
2.4 苎麻BnNRT1.1基因的表达特性研究
硝酸盐处理不同时间后,苎麻BnNRT1.1基因在不同品种及不同部位的表达情况如图5所示。苎麻BnNRT1.1基因在不同部位表达量不同,根中大量表达,叶片中少量表达,茎中极少表达,在处理3 d后,其表达量达到最大值。苎麻BnNRT1.1基因在不同品种中表达量不同,在前期苎麻氮高效品种筛选试验中发现龙潭大麻的氮同化效率显著高于青皮杆麻,本试验研究表明,BnNRT1.1在氮高效品种龙潭大麻中的表达量高于氮低效品种青皮杆麻,且在龙潭大麻中的最大相对表达量约为2.63,青皮杆麻中的最大相对表达量约为1.19。

图5 苎麻BnNRT1.1基因的表达特性Fig.5 Expression characteristics of BnNRT1.1 gene in ramie
3 讨论
苎麻为南方重要的经济作物之一,目前作为饲料作物大范围推广应用,如何提高其氮素利用率一直是苎麻育种工作的研究重点[17]。硝酸盐与铵盐是植物生长所需氮素的主要来源,在自然条件下,硝酸盐是非固氮植物生长所需的主要氮源,无论外界硝酸盐浓度高低,NRT1.1均发挥重要作用,目前在国内对苎麻硝酸盐转运蛋白的研究未见相关报道。苎麻BnNRT1.1基因的功能与作用机制是否与其它作物中的相同尚不清楚。本研究从苎麻植株中成功克隆出苎麻BnNRT1.1基因,功能预测表明,苎麻BnNRT1.1基因不仅可以转运硝酸盐,还可以作为一种信号分子,其对苎麻生长发育过程的调控作用,有待于进一步研究与鉴定。
本研究虽然获得了苎麻BnNRT1.1的cDNA全长序列,但无法获得其非编码区的相关信息,目前苎麻没有可利用的基因组数据。Blast比对结果表明,苎麻BnNRT1.1基因序列与其它植物的NRT1具有较高相似性,系统进化树表明,其与樱桃、白梨、桑树NRT1具有同源关系,因此可借鉴其同源序列的相关信息进行研究,有助于加快提高苎麻氮素利用率的研究进程。
本试验表达特性研究表明,苎麻BnNRT1.1基因主要在根中表达,而苎麻具有较复杂的根系结构,其由营养根(俗称萝卜根)、支根和细根组成[18],前人研究[19]表明NRT1.1具有调控植物根系结构的功能,而苎麻BnNRT1.1是否能够调控萝卜根、支根和细根的形成,有待于进一步研究;苎麻氮代谢过程比较复杂,其与多种代谢途径相关的基因相关联,要完全明确其机制,难度较大。本研究发现苎麻BnNRT1.1在不同品种中的表达量不同,在氮高效品种龙潭大麻中表达量高,氮低效品种青皮杆麻中表达量低,因此BnNRT1.1在苎麻氮代谢过程中发挥重要作用。在后期研究中可尝试通过分子生物学手段提高BnNRT1.1基因的表达量来提高苎麻的氮素利用率,本研究为其提供了一定的分子生物学基础。
[1]熊和平.苎麻多功能深度开发利用系列报道之一 苎麻多功能开发潜力及利用途径[J].中国麻业科学,2001(1):23-26.
[2]喻春明,陈建荣,王延周,等.苎麻分子育种与饲料用苎麻研究进展[J].中国麻业科学,2007(S2):389-392.
[3]揭雨成,康万利,邢虎成,等.苎麻饲用资源筛选[J].草业科学,2009(9):30-33.
[4]李宗道,黎觐臣.苎麻综合利用的研究[J].作物研究,1995(2):28-31.
[5]Doddema H,Hofstra JJ,FeenstraW J.Uptake of Nitrate by Mutants of Arabidopsis Thaliana,Disturbed in Uptake or Reduction of Nitrate[J].Physiologia Plantarum,1978,43(4):343-350.
[6]Liu K H,Huang CY,Tsay Y F.Chl1 is a Dual-Affinity Nitrate Transporter of Arabidopsis Involved in Multiple Phases of Nitrate Uptake[J].Plant Cell,1999,11(5):865-874.
[7]Gojon A,Krouk G,Perrine-Walker F,et al.Nitrate Transceptor(s)in Plants[J].Journal of Experimental Botany,2011,62(7):2299-2308.
[8]轩红梅,王永华,魏利婷,等.小麦幼苗叶片中硝酸盐转运蛋白NRT1和NRT2家族基因对氮饥饿响应的表达分析[J].麦类作物学报,2014(8):1019-1028.
[9]田孟祥,余本勋,张时龙,等.一种水稻高氮利用率NRT1.1B基因功能标记的开发与应用[J].分子植物育种,2016,13(2):410-416.
[10]杨学东.不结球白菜硝酸盐转运蛋白基因的克隆和功能研究[D].南京:南京农业大学,2012.
[11]杨亦扬,胡雲飞,万青,等.茶树硝态氮转运蛋白 NRT1.1基因的克隆及表达分析[J].茶叶科学,2016,36(5):505-512.
[12]顾春笋.菊花CmNRTs基因的克隆及功能鉴定[D].南京:南京农业大学,2012.
[13]谭龙涛.苎麻氮代谢高效基因型筛选及表达分析[D].北京:中国农业科学院,2015.
[14]汤涤洛.苎麻不同品种生根特性及氮素营养初步研究[D].武汉:华中农业大学,2012.
[15]Liu T,Zhu S,Tang Q,et al.De Novo Assembly and Characterization of Transcriptome Using Illumina Paired-End Sequencing and Identification of Cesa Gene in Ramie(Boehmeria Nivea L.Gaud)[J].Bmc Genomics,2013,14:125.
[16]郑建树.苎麻谷氨酰胺合成酶基因的克隆和超量表达研究[D].北京:中国农业科学院,2014.
[17]侯美,喻春明.植物NRT1.1的研究进展及其在苎麻研究中的展望[J].中国麻业科学,2017,39(4):207-214.
[18]肖红松,崔国贤,曾维爱,等.麻类作物根系研究概述[J].作物研究,2005(S1):359-363.
[19]Guo FQ,Wang R,Chen M,et al.The Arabidopsis Dual-Affinity Nitrate Transporter Gene Atnrt1.1(Chl1)is Activated and Functions in Nascent Organ Development During Vegetative and Reproductive Growth[J].Plant Cell,2001,13(8):1761-1777.

