普鲁兰酶酶解处理红薯淀粉及其性质研究
刘程玲 胡煜莹 王力翾 王鲁峰,2
(华中农业大学食品科技学院1,武汉 430070) (环境食品学教育部重点实验室;华中农业大学2,武汉 430070)
我国红薯种植面积和产量分别占世界60%和80%左右。红薯中淀粉含量高,一般块根中淀粉质量分数占鲜重的15%~26%,高的可达30%。粉丝品质与淀粉中直链淀粉的含量密切相关,粉丝成型是淀粉分子在热作用下直链淀粉分子发生重排形成热不可逆凝胶的过程。由于天然存在的红薯淀粉中直链淀粉含量偏低,制成的粉丝具有易断条易糊汤等缺点,故从提高红薯淀粉中直链淀粉含量的角度入手是改善红薯粉丝品质的重要思路。普鲁兰酶是专一性的淀粉脱支酶,能够专一性切开支链淀粉分支中的α-1,6糖苷键,与异淀粉酶不同,其能切下整个支链淀粉分支包括最小单位的分支,形成直链淀粉,最大限度地利用淀粉原料[1-2],从而提高淀粉中直链淀粉含量。普鲁兰酶是一种在低pH条件下热稳定的脱支酶,在pH值4.0~7.5范围内稳定性较高,最适反应pH值为5.0~6.0;在温度55~65 ℃范围内活性较强,最适反应温度为60 ℃[3]。目前我国对普鲁兰酶的研究还鲜见报道,但普鲁兰酶已被世界卫生组织推荐为食品级酶制剂,在食品中可以放心使用,所以普鲁兰酶的开发利用对食品加工领域具有重要的意义。重点研究了普鲁兰酶酶解处理对淀粉性质的影响,为改善红薯粉丝品质的后续研究及应用提供参考。
1 材料与方法
1.1 材料与试剂
红薯淀粉:安徽舒城大海淀粉有限公司;普鲁兰酶:1 000 ASPU/g:上海陆安生物科技有限公司。
直链淀粉、支链淀粉标准品:美国Sigma Alarich公司;柠檬酸、柠檬酸钠、乙酸、95%乙醇、氢氧化钠、碘、碘化钾:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器与设备
PB-10型精密数显pH计:德国Sartorius公司;MM40冷冻混合球磨机:德国莱驰公司5804R型高速冷冻离心机:德国Eppendorf股份公司;UV-180紫外分光光度计:艾本德中国有限公司;RVA-TecMASTER型快速黏度测定仪:瑞典Perten公司;DSC200F3差示扫描量热仪:德国耐驰仪器制造有限公司;ADVNCE X衍射仪:D8英国马尔文仪器有限公司;JSM-6390LV扫描电镜:日本NTC公司。
1.3 实验方法
1.3.1 酶解淀粉的制备 称取原红薯淀粉各50 g于锥形瓶中,加入150 mL 0.1 mol/L柠檬酸—柠檬酸钠缓冲液并搅拌均匀,将淀粉—水混合液pH调节至4.5左右,加入3 g(60ASPU/g)普鲁兰酶,摇匀,密封于55 ℃恒温水浴振荡器中反应15 h。
1.3.2 淀粉性质的测定
1.3.2.1 直链淀粉含量的测定 按GB/T 15683—2008 《大米直链淀粉含量的测定》方法测定。
1.3.2.2 淀粉扫描电镜分析 将淀粉样品研磨成粉末,于40 ℃下烘干48 h,均匀的涂抹于样品台上,并进行喷金处理,然后置于扫描电子显微镜下观测,分别在2 000×,5 000×的放大倍数下观察拍照。
1.3.2.3 淀粉X-射线衍射分析 采用X-射线衍射仪测定淀粉结晶性能,步进扫描法测量。X-衍射条件:Cukα辐射,管压40 kV,管流50 mA,扫描范围4°~60°,扫描速度8(°)/min。
1.3.2.4 淀粉溶解度和澎润力的测定 称取一定质量(m)的淀粉样品加100 mL蒸馏水配制成1%(m/V)的淀粉—水悬液,分别在40、50、60、70、80、90 ℃不同温度下中进行水浴,搅拌30 min,将淀粉糊倒入离心管,3 000 r/min转速下离心20 min,将上层清液小心倾倒入平皿中,置于105 ℃烘箱中烘至恒重,称得被溶解的淀粉的质量为A(g),离心管中淀粉沉淀物质量为B(g),溶解度为上清干燥物与总淀粉干重的比值,膨胀度为离心后淀粉糊重与糊中所含淀粉干重的比值。
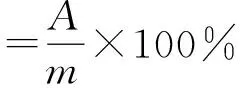

式中:m为称取淀粉样品的质量;s为淀粉的溶解度。
1.3.2.5 淀粉透光率和凝沉性的测定
准确称取一定量的淀粉,倒入烧杯,加入一定量蒸馏水,配制成1%(m/V)淀粉—水悬液,将烧杯置于沸水浴中搅拌30 min,使淀粉糊化,冷却至室温。以蒸馏水为空白对照,使用紫外分光光度计在620 nm波长下测定淀粉糊的透光率T。
准确称取一定量的淀粉,倒入烧杯,加入一定量蒸馏水,配制成1%(m/V)的淀粉水悬液,将烧杯置于95 ℃水浴中保持搅拌30 min,使淀粉糊化,冷却至室温,把淀粉糊转移至量筒中,每隔5 h观测一次淀粉糊与上层清液的分层情况及界面的下降情况,以上层清液占淀粉糊总体积的百分比表示凝沉性。
1.3.2.6 淀粉冻融稳定性的测定 冻融稳定性的评判指标为析水率。称取一定量的淀粉样品,配制3.0%(m/V,以干基重计)的淀粉乳,在沸水浴中加热30 min,并不时加入沸腾的蒸馏水保持原有体积,冷却至室温,转入带刻度的50 mL离心管中,放入-18 ℃的冰箱中冷冻,24 h后取出自然解冻,然后在3 000 r/min转速下离心20 min,记录析水的体积,每24 h循环一次。

1.3.2.7 淀粉糊化特性的测定 使用RVA快速黏度仪测定,根据GB 50093—2010,用105 ℃恒重法校正淀粉样品的水分基。准确称取3.0 g淀粉样品放入RVA专用铝盒内,用移液管加入25 mL蒸馏水,用旋转搅拌器将淀粉和水搅拌均匀,放入RVA仪器进行测定,测定程序设置为升温—降温循环:先在50 ℃保持1 min,然后以12.16 ℃/min的速度在4 min内加热至95 ℃,并保持5.5 min,再在4 min内冷却至50 ℃,并保持4 min,旋转浆的旋转速度设定为在起始10 s内960 r/min,之后保持160 r/min至结束。
1.3.2.8 凝胶特性的测定
分别调配8%(m/V)的原红薯淀粉和酶解红薯淀粉乳,在沸水浴中糊化20 min后装进50 mL的注射器中冷却,在4 ℃下放置24 h后形成直径4 cm的圆柱形凝胶。测试前将凝胶倒出切成直径为4 cm高2 cm的小圆柱形体进行凝胶特性测定。具体测定参数如下:探头:P36R型;感应力:0.196 2 N(20 g);压缩形变:50%;测试前速度:1.00 mm/s;测试速度:1.00 mm/s;测试后速度:1.00 mm/s。每次试样重复6次,结果取平均值。
1.3.2.10 淀粉老化度的测定 将糊化后的淀粉样品存放于4 ℃冰箱中,分别储存1、28 d后再次进行DSC扫描,老化度为淀粉的老化焓与淀粉的糊化焓的比值。

1.4 数据处理
实验数据采用Excel、Origin和SPSS 19.0软件对数据进行相关性分析和逐步回归分析,P<0.05为变化显著,所有数据都是3次测试的平均值,数据的表示统一采用平均值±标准偏差(X±S)。表中同一列(行)中字母相同表示无显著差异,字母不同表示差异显著(P<0.05)。
2 结果与讨论
2.1 直链淀粉含量分析
参照GB/T 15683—2008进行直链淀粉标准曲线的绘制,制得直链淀粉标准曲线:y=0.987 1x+0.037 3,R2=0.995 9。y为不同浓度直链淀粉标准品在720 nm处的吸光值,x为不同浓度标准品中直链淀粉的含量。
由表1可知,原红薯淀粉和酶解红薯淀粉直链淀粉质量分数分别为24.06%和32.63%,淀粉经普鲁兰酶酶解处理后直链淀粉含量增加了8.57%。由于普鲁兰酶是专一性的淀粉脱支酶,在一定反应条件下能专一性切开支链淀粉分支中的α-1,6糖苷键,切下整个分支结构,形成直链淀粉,增加了红薯淀粉中直链淀粉含量。淀粉的直链支链分子比例对酶解效率有很大影响,支链淀粉酶解脱支会产生短直链分子容易形成有序化重排,产生双螺旋结构[4],淀粉颗粒中的双螺旋结构也对淀粉酶有一定的抵抗作用[5],从而降低淀粉的酶解性,所以继续酶解过程中由于产物短直链分子增多,会减缓酶解的速率,这是酶解过程较长一个重要原因,总体表现为原淀粉抗酶解。

表1 淀粉直链淀粉质量分数/%
注:同一列中均值数据后面的不同字母表示数据有显著差异(P<0.05),数据表示为样本均值±标准差,下同。
2.2 扫描电镜分析比较
由图1可知,红薯淀粉颗粒扫描电子显微镜下呈近似圆形或卵圆形,大小为直径20 μm左右,大小和形状均有一定的差别。原红薯淀粉在电子显微镜下表面光滑,无破损痕迹;而酶解红薯淀粉表面及内部结构出现了不同程度的损伤和侵蚀,表面变得不光滑,有裂痕,大部分呈现出不规则的多边形,表明产生了酶解效果。

图1 酶解红薯淀粉与原淀粉电镜图
2.3 X-射线衍射分析比较
红薯淀粉特有的晶体类型为C-型结构,由图2可以看到原红薯淀粉和酶解红薯淀粉在15°和23°位置反射强烈,而且在17°和18°位置出现相连的双峰,这是典型的Ca型晶体类型[6-7-8]。由酶解前后X-射线衍射曲线对比来看,可以明显看出酶解红薯淀粉比原红薯淀粉峰强要强,在12°位置处,酶解红薯淀粉比原红薯淀粉峰减弱,表明普鲁兰酶在酶解过程中对红薯淀粉的结构产生了作用。
通过对教学知识点及技能点的分析梳理,结合电商职业技能鉴定要求,拟建实践教学基地建筑面积约200平方米,按照企业实际电商工作场景,引入企业真实工作没项目,设置4个电商(商务秘书)职业场景实验室,细分为19个具体项目,配置76个标准工作位,并依据企业真实项目灵活调整,以培养学生电商(商务秘书)实践应用和创新创业能力为目标,将企业真实工作项目融入电商实践课程。使教学内容具体化、任务化、场景化。每个项目任务都是电商(商务秘书)一项场景实验室系列学习任务,教学内容安排围绕电商场景实验室任务来完成。

图2 酶解淀粉与原淀粉X-射线衍射图谱
2.4 淀粉溶解度和膨润力的比较
淀粉溶解度和膨润力在一定程度上反映了淀粉的持水能力和淀粉颗粒内部的键结合能力。由图3可知,随着温度的升高,原红薯淀粉和酶解红薯淀粉的溶解度和膨润力变化趋势基本一致,两者都随着温度的升高而增加。在热作用下,淀粉颗粒间的相互作用被破坏,淀粉颗粒与水分子的相互作用增强,其溶解度和膨润力增加。温度低于70 ℃时,2种淀粉的溶解度和膨润力区别不大;当温度上升至70 ℃时,原红薯淀粉的溶解度和膨润力明显高于酶解红薯
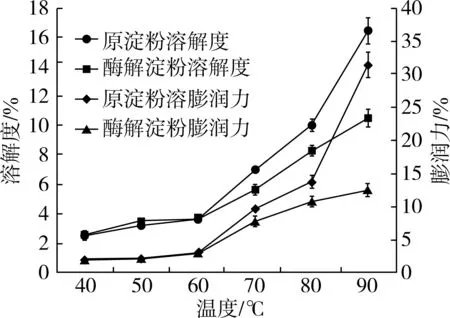
图3 淀粉在不同温度下溶解度和膨润力的对比
淀粉,说明酶解红薯淀粉与原红薯淀粉相比其淀粉颗粒内部的键结合力强。
2.5 淀粉透明度和凝沉性的比较
由表2可知经过普鲁兰酶酶解过的红薯淀粉与原红薯淀粉的透光率存在显著差异,酶解红薯淀粉透光率显著增加,即透明度好。淀粉糊透明度的影响因素很多,主要与淀粉来源有关。一般来说,直链淀粉含量越高,淀粉的凝胶性越强,对光的透射能力越弱,透明度降低。此处酶解之后红薯淀粉的透明度增加可能是由很多因素综合作用的结果,不同来源的淀粉分子颗粒大小和结构不同,直支比也不同。此外,淀粉糊的介质及储存时间对其透明度也有影响[9-10]。

表2 淀粉透明度/%
由图4可知,随着时间的推移酶解红薯淀粉与原红薯淀粉凝沉性均增加,且于30 h后趋于稳定。但酶解红薯淀粉的凝沉性比原红薯淀粉的凝沉性强,原因可能是原红薯淀粉支链淀粉含量高,其分支结构多与水分子相互作用形成三维网状结构,阻止了微晶束的形成,导致原淀粉的凝沉性较低。淀粉凝沉性的影响因素很多,淀粉的来源、直支比、颗粒结构、介质等都会有影响[11-12]。

图4 淀粉凝沉性
2.6 淀粉冻融稳定性的比较
由表3可知,酶解红薯淀粉与原红薯淀粉吸水率之间存在显著差异,淀粉随着冻融次数的增加吸水率也增加,变化趋势一致但酶解红薯淀粉比原红薯淀粉析水率要高,即冻融稳定性要差。目前大部分研究认为是因为淀粉中直链淀粉的含量会影响冻融稳定性,淀粉的冻融稳定性与直链淀粉含量呈负相关[13],也有研究表明支链淀粉含量越高大米淀粉的总体冻融稳定性越高,高含量支链淀粉在冻融过程中会形成更多的空间位阻,减少了淀粉的老化重结晶并阻止水分子的析出从而降低吸水率[14-15]。淀粉冻融稳定性与淀粉的种类、淀粉凝胶的冻结速率以及淀粉凝胶体系中的其他组分有关[16]。综合而言红薯淀粉的冻融稳定性较差,不适合做冷冻食品。

表3 淀粉冻融稳定性
2.7 淀粉糊化特性的比较
由表4可知,原红薯淀粉的峰值黏度显著高于酶解红薯淀粉,峰值黏度反映的是淀粉在糊化过程中淀粉颗粒的膨胀程度,由此说明原红薯淀粉膨润力较大,这与淀粉膨润力的测定结果一致;酶解红薯淀粉谷值黏度显著高于原红薯淀粉,表明酶解红薯淀粉在高温下的耐剪切能力比原红薯淀粉强;酶解红薯淀粉的衰减值与原红薯之间存在显著差异,显著低于原红薯淀粉,说明酶解红薯淀粉的稳定性较好;酶解红薯淀粉的最终黏度显著高于原红薯,表明酶解之后的红薯淀粉糊硬度最大;回生值结果显示酶解前后红薯淀粉的回生值差异显著,回生值的大小直接影响粉丝品质;酶解红薯淀粉的糊化温度升高,这是由于淀粉糊化温度与直链淀粉含量呈正相关,而酶解后红薯淀粉中直链淀粉含量增加。
2.8 淀粉凝胶特性的比较
由表5可知,酶解前后红薯淀粉的凝胶特性的各参数均发生显著变化,其中酶解红薯淀粉与原红薯淀粉相比硬度、咀嚼性和回复性均显著增大,原因可能是淀粉酶解后直链淀粉含量增高,糊化后的淀粉凝胶在储藏过程中更易重结晶,发生老化[17]。
2.9 淀粉热力学性质的比较
由表6可知,酶解前后红薯淀粉起始糊化温度、峰值温度、终止糊化温度、糊化焓与原红薯淀粉相比都发生了显著变化,起始糊化温度由63.70 ℃增加到71.75 ℃,峰值糊化温度由72.35 ℃增加到76.20 ℃,终止糊化温度由79.65 ℃增加到82.00 ℃,糊化焓(峰面积)由12.91 J/g增加到13.47 J/g。原红薯淀粉中支链淀粉含量高,在较低温度区间即可糊化,淀粉酶解后直链淀粉含量增加,在较高温度区间糊化;直链淀粉含量的增加,会使淀粉分子间氢键作用增强,直链淀粉分子双螺旋结构和微晶束的形成,使淀粉糊化所需能量增加,即糊化焓增加[18],这表明酶解前后红薯淀粉发生了一系列变化。淀粉糊化温度的高低和糊化焓的大小与淀粉的来源、组成、颗粒结构、直支比等因素均有关。

表4 淀粉RVA谱特征值
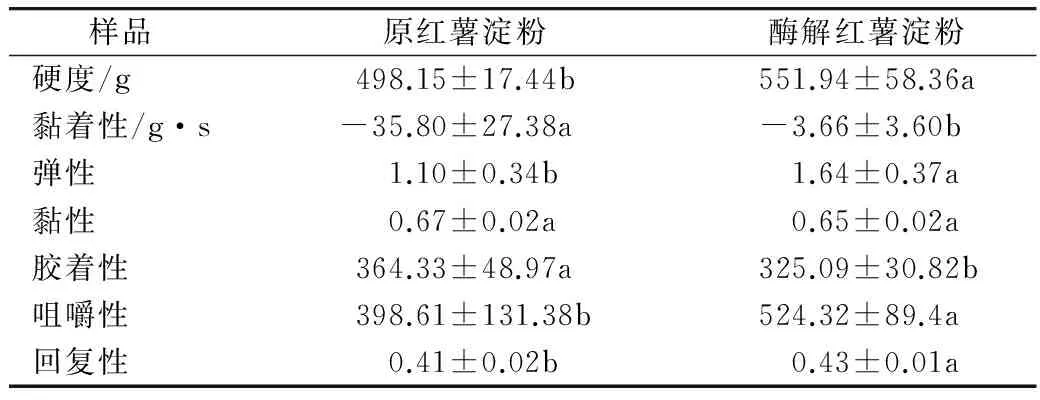
表5 酶解淀粉与原淀粉凝胶特性

表6 红薯淀粉酶解前后糊化热力学参数
2.10 淀粉老化度的比较
由表7可知,淀粉在4 ℃条件下回生度与存放时间有很大的关系,存放1 d后并未出现吸热峰,存放28 d之后酶解红薯淀粉与原红薯淀粉均发生老化且存在显著差异,酶解红薯淀粉比原淀粉的老化度显著提高。这是因为是酶解之后红薯淀粉中直链淀粉含量增加,糊化后更易发生老化。淀粉的老化特性与淀粉质食品的加工食用品质有密切关系[19]。

表7 淀粉老化热力学参数
3 结论
红薯淀粉经过普鲁兰酶酶解脱支处理后,直链淀粉含量增加,淀粉颗粒的微观结构发生变化,表面出现空穴,比表面积增大,增加了潜在的反应位点,能加快化学反应速率;溶解度、膨润力和冻融稳定性均发生不同程度降低,说明酶解后淀粉颗粒内部的键结合力增强,分子稳定性增加;透明度和凝沉性增强。淀粉的糊化特性和凝胶特性也发生一系列变化,峰值黏度和衰减值降低,说明酶解红薯淀粉的稳定性较好;谷值黏度和最终黏度升高,表明酶解红薯淀粉在高温下的耐剪切能力比原红薯淀粉强及酶解之后的红薯淀粉糊硬度增大;凝胶参数显示酶解红薯淀粉的硬度、咀嚼性和回复性均增大。淀粉热力学性质变化如下:糊化温度、峰值温度、终止糊化温度和糊化焓都升高,4 ℃下存放28 d后淀粉老化度测试结果表明普鲁兰酶酶解后红薯淀粉老化度的有所增加。经普鲁兰酶处理后的红薯淀粉直链分子含量增加,其在红薯粉丝品质提高方面具有应用前景。
[1]乔宇,丁宏标,王海燕,等.普鲁兰酶的研究进展[J].生物技术进展,2011,1(3):189-194 QIAO Y,DING H B,WANG H Y,et al.Research Advances in Pullulanase[J].Current Biotechnology,2011,1(3):189-194[2]NAIR S U,SINGHAL R S,KAMAT M Y.Induction of pullulanaseproduction in Bacillus cereus FDTA 213[J].Biores.Technol,2007,98(4):856-859
[3]周念波,孙杰,王晶,等.普鲁兰酶在食品工业中的应用[J].食品工程,2008(2):18-20 ZHOU N B,SUN J,WANG J,et al.Application of pullulanase in food industry[J].Food Engineering,2008(2):18-20
[4]杨士杰.主食类谷物淀粉酶解速率的研究及应用[D].郑州:河南工业大学,2011 YANG S J.Study and application of amylase hydrolysis rate in main Cereals[D].Zhengzhou:Henan University of Technology,2011
[5]任瑞珍.酶解法研究三种薯类淀粉的壳层和小体结构[D].西安:陕西科技大学,2015 REN R Z.Study on the shell and body structure of three potato starches by enzymolysis[D].Xi’an:Shaanxi University of Science and Technology,2015
[6]TIAN S J,RICKARD J E,BLANSHARD J M V.Physicochemical properties of sweet potato starch[J].Journal of the Science of Food & Agriculture,1991,57(4):459-491
[7]NODA T,TAKAHATA Y,SATO T,et al.Combined effects of planting and harvesting dates on starch properties of sweet potato roots.[J].Carbohydrate Polymers,1997,33(2,3):169-176
[8]HOOVER R.Composition,molecular structure,and physicochemical properties of tuber and root starches:a review[J].Carbohydrate Polymers,2001,45(3):253-267
[9]杜先锋,许时婴.淀粉糊的透明度及其影响因素的研究[J].农业工程学报,2002,18:129-131 DU X F,XU S Y.Study on the transparency of starch paste and its influencing factors[J].Transactions of the CSAE,2002,18:129-131
[10]侯蕾,韩小贤,郑学玲,等.不同种类淀粉理化性质的比较[J].粮食加工,2015,40(2):32-37 HOU L,HAN H L,ZHENG X L,et al.Comparison of physical and chemical properties of different starches[J].Grain Processing,2015,40(2):32-37
[11]李鑫,赵燕,廖斌,等.甘薯淀粉糊透明度及凝沉性初探[J].食品研究与开发,2011,32(3):34-37 LI X,ZHAO Y,LIAO B,et al.Preliminary study on transparency and retrogradation of sweet potato starch paste[J].Food Research and Development.2011,32(3):34-37
[12]JACOBSON M R,BEMILLER J N.Method for determining the rate andextent of accelerated starch retrogradation[J].Cereal chemistry,1998,75(1):22-29
[13]TAKEITI C,FAKHOURI F,ORMENESE R,et al.Freeze-thaw Stability of Gels Prepared from Starches of Non-conventional Sources[J].Starch-Stärke,2010,59(3-4):156-160[14]VARAVINIT S,SHOBSNGOB S,VARANYANOND W,et al.Freezing and Thawing Conditions Affect the Gel Stability of Different Varieties of Rice Flour[J].Starch-Starke,2002,54(1):31-36
[15]SRICHUWONG S,ISONO N,JIANG,H X,et al.Freeze-thawstability of starches fromdifferent botanical sources:Correlation with structural features[J].Carbohydrate Polymers,2012,87(2):1275-1279
[16]王冠青.淀粉种类及氯化钠对淀粉冻融稳定性的影响[D].无锡:江南大学,2015 WANG G Q.Effect of botanical source and sodium chloride on freeze-thaw stability of starch[D].Wuxi:Jiangnan University,2015
[17]王充,张国权,罗勤贵,等.淀粉凝胶储藏过程中消化和质构特性的变化[J].中国粮油学报,,2012,27:32-37 WANG C,ZHANG G Q,LUO Q G,et al.Changes in digestive and textural properties during storage of starch gels[J].Journal of the Chinese Cereals and Oils Association,2012,27:32-37
[18]史晓云.酶解玉米淀粉的性质及对粉丝品质影响的研究[D].济南:齐鲁工业大学,2015 SHI X Y.Study on properties of enzymatic hydrolysis of corn starch and its influence on vermicelli quality[D].Jinan:Qilu University of Technology,2015
[19]吴伟都,朱慧,王雅琼,等.基于差示扫描量热仪的大米糊化特性及回生性能的研究[J].食品科技,2015,40(7):165-168 WU W D,ZHU H,WANG Y Q,et al.Study on Gelatinization Characteristics and retrogradation of rice based on differential scanning calorimeter[J].Food Science and Technology,2015,40(7):165-168.

