精胺对盐胁迫下小麦幼苗生理生化指标的影响
马原松, 辛 倩, 朱晓琴, 徐园园, 裴冬丽
(商丘师范学院植物与微生物互作重点实验室,河南商丘 476000)
土壤盐渍化是很多干旱或半干旱地区农作物生长发育、产量和品质下降的主要原因。土壤中过量的盐分会导致土壤物理和化学性质的改变,进而使大部分农作物生长环境退化。在盐胁迫下,由于细胞内Na+大量积累,影响活性氧(reactive oxygen species,ROS)保护酶的活性,破坏了超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等对ROS产生与清除的动态平衡关系。植物体内ROS的大量积累,造成植物体膜蛋白和膜脂的损伤,破坏膜结构,使植物生长缓慢,代谢受到抑制,严重时会出现萎蔫甚至死亡[1-2]。因此,增强植物的耐盐能力对于缓解盐胁迫下农作物的生长和提高作物产量具有非常重要的意义。
多胺是一类广泛存在于原核生物和真核生物中的具有较高生物活性的物质,是一类低分子脂肪族含氮碱。在高等植物中不同部位存在的多胺有精胺(Spm)、腐胺(Put)、亚精胺(Spd)等。在生理pH值下,多胺为阳离子,它能束缚生物大分子DNA、蛋白质、果胶多糖等,参与蛋白质磷酸化、转录后修饰,从而影响植物体内DNA、RNA和蛋白质生物合成,调节酶活性,保持离子平衡。许多研究认为,多胺具有促进植物生长发育、果蔬成熟、延缓植物衰老、提高植物抗逆性能力等生理功能,与植物的生存环境密切相关[3-5]。且已有研究表明,精胺处理可有效缓解NaCl对番茄种子萌发和生长的抑制作用[6],缓解NaCl胁迫下黄瓜幼苗的生长[7],缓解水分胁迫下小麦幼苗的生长[8]。
本试验以郑麦7698为材料,先用1/2 Hoagland营养液培养小麦至1叶期之后,再分别用0.1 mmol/L Spm和不同浓度NaCl处理,研究外源精胺处理对盐胁迫小麦幼苗中SOD、POD、CAT活性和MDA含量的影响,探讨精胺在盐胁迫条件下对小麦幼苗生长的缓解效应及其可能存在的机制。
1 材料与方法
1.1 材料
供试小麦品种郑麦7698,由河南省农业科学院提供。
1.2 方法
1.2.1 小麦种子培养 选取完整、大小均一且无病虫害、饱满的小麦种子,先用75%乙醇浸泡30 s,然后用1%次氯酸钠表面消毒15 min,最后用无菌水反复冲洗3次,置于室温 25 ℃ 下无菌水浸泡12 h。将吸胀后的小麦种子腹沟向下,分别整齐摆放在已灭菌的盛放双层滤纸的中号培养皿中,每个培养皿中放30粒种子,用1/2 Hoagland营养液,昼夜温度分别是(25±1)℃和(17±1)℃的恒温培养箱培养,白天 14 h,晚上10 h。
1.2.2 小麦幼苗处理 小麦在1/2 Hoagland营养液培养至第1张叶充分展开时,将培养皿中培养液完全倒出,随机分组处理,共设定8个处理:蒸馏水(Ⅰ);蒸馏水+0.15 mol/L NaCl(Ⅱ);蒸馏水+0.3 mol/L NaCl(Ⅲ);蒸馏水+0.45 mol/L NaCl(Ⅳ);0.1 mmol/L Spm(Ⅴ);0.1 mmol/L Spm+0.15 mol/L NaCl(Ⅵ);0.1 mmol/L Spm+0.30 mol/L NaCl(Ⅶ);0.1 mmol/L Spm+0.45 mol/L NaCl(Ⅷ),每个处理均设3个重复。对于处理Ⅰ每天加入适量蒸馏水,处理Ⅴ每天加入适量0.1 mmol/L Spm,处理Ⅱ、Ⅲ、Ⅳ分别隔天加入等量蒸馏水和NaCl溶液,处理Ⅵ、Ⅶ、Ⅷ分别隔天加入等量精胺和NaCl溶液,培养至试验结束。
1.2.3 各项生理指标测定 在精胺和NaCl开始处理后的0、2、4、6 d分别从每个处理的3个重复中随机称取1 g小麦叶片。采用NBT光化学还原法测定SOD活性,以抑制NBT光化还原的50%为1个酶活力单位(U),酶活性以U/(min·g)表示[9]。用愈创木酚法测定POD活性,以1 min内D470 nm变化0.01为1个过氧化物酶活性单位(U),酶活性以 U/(min·g) 表示[9]。CAT活性以1 min内D240 nm减少0.1的酶量为1个酶活力单位(U),酶活性以U/(min·g)表示[10]。
在精胺和NaCl开始处理后的0、2、4、6 d分别称取0.5 g小麦叶片。用硫代巴比妥酸法测定MDA含量,单位以 μmol/g 表示[11]。
1.3 统计方法
用Excel 2007对试验数据进行统计分析绘图和SPSS 20.0进行显著性分析,用Duncan’s多重比较法(α=0.05)进行统计分析。
2 结果与分析
2.1 Spm对盐胁迫下小麦幼苗SOD活性的影响
小麦幼苗叶片SOD活性变化如图1所示。小麦幼苗叶片中SOD活性在处理0 d大致相同,无显著性差异;小麦幼苗2、4、6 d时SOD活性随着盐胁迫处理时间的增加,整体呈现出先升后降的趋势,SOD活性在4 d时达到了最大值,6 d时活性均下降。盐胁迫下Spm处理组比未处理组SOD活性均升高,根据显著性分析(P<0.05),2 d时,0.3 mol/L NaCl胁迫下Spm处理组比未处理组SOD活性显著增强;4 d时,0.15、0.3 mol/L NaCl胁迫下Spm处理组比未处理组SOD活性显著增强;6 d时,0.15、0.45 mol/L NaCl胁迫下Spm处理组比未处理组SOD活性显著增强。精胺在一定程度上增加了小麦叶片在盐胁迫下SOD活性。

2.2 Spm对盐胁迫下小麦幼苗POD活性的影响
由图2可知,小麦幼苗叶片中POD活性在处理0 d大致相同,无显著性差异;2、4、6 d时随着盐胁迫处理时间的增加,小麦幼苗叶片中POD活性整体呈现明显的先上升后下降趋势。POD活性在处理4 d时达到了最大值,6 d时活性下降。盐胁迫下Spm处理组比未处理组POD活性均升高,但随着处理时间的不同,在不同浓度NaCl胁迫下,Spm处理组相比未处理组而言,小麦叶片POD活性未发生显著性变化。

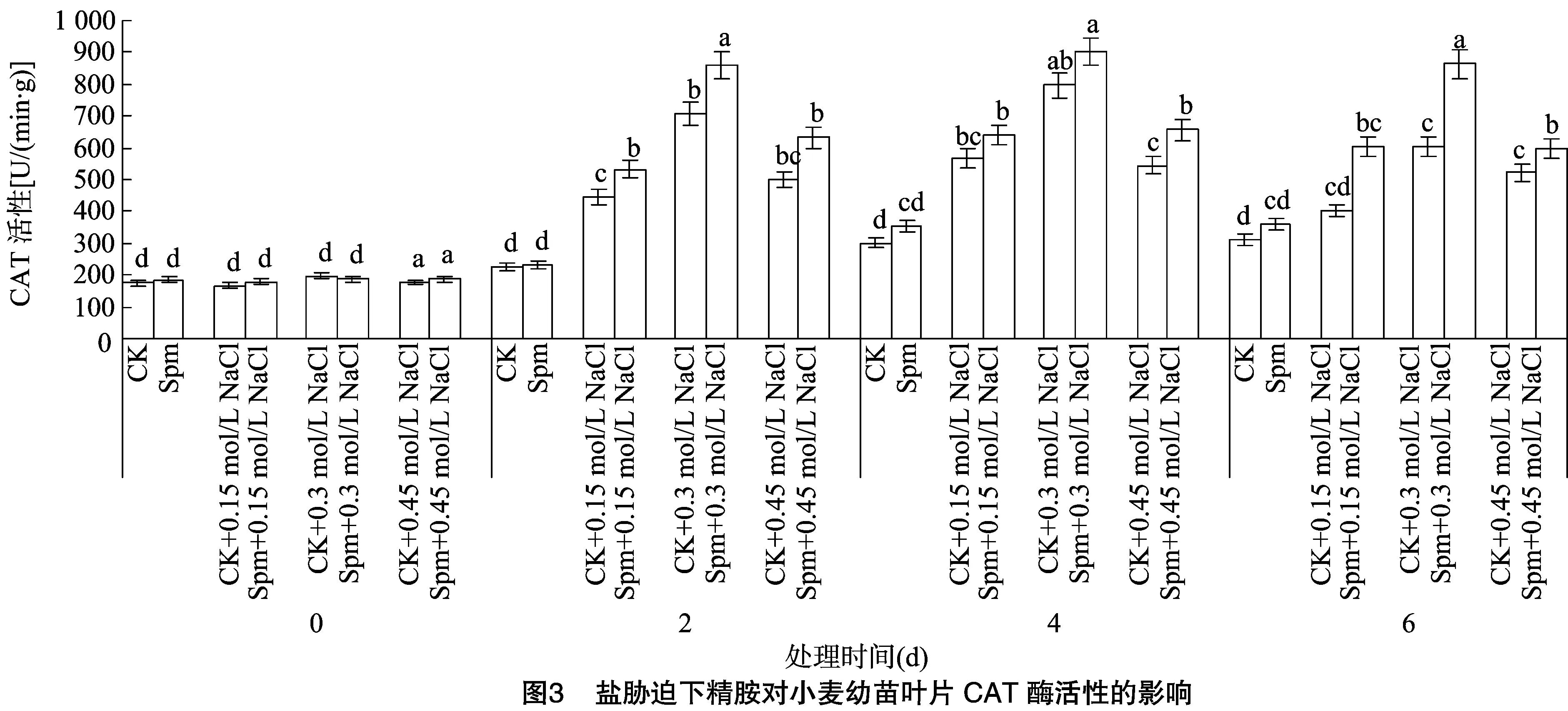
2.3 Spm对盐胁迫下小麦幼苗CAT活性的影响
由图3可知,小麦幼苗叶片中CAT活性在处理0 d大致相同,无显著性差异;CAT活性随着盐胁迫处理时间的增加,呈现明显的先升后降趋势,在处理4 d时CAT活性达到最大值。盐胁迫下Spm处理组比未处理组CAT活性均升高,2 d时,0.15、0.3 mol/L NaCl胁迫下Spm处理组比未处理组CAT活性显著增强;4 d时,0.45 mol/L NaCl胁迫下Spm处理组比未处理组CAT活性显著增强;6 d时,0.3、0.45 mol/L NaCl胁迫下Spm处理组比未处理组CAT活性显著增强。精胺在一定程度上增加了小麦叶片在盐胁迫下CAT活性。
2.4 Spm对盐胁迫下小麦幼苗MDA含量的影响
小麦幼苗叶片MDA含量变化如图4所示,在试验处理过程中,由于盐浓度的增加小麦幼苗叶片中MDA含量明显上升,小麦幼苗叶片中MDA含量在处理0 d大致相同,无显著性差异,MDA含量随着盐胁迫处理时间的增加(2、4、6 d),小麦幼苗叶片中MDA含量整体呈现先升后降的趋势,在处理 4 d 时达到最大值。盐胁迫下Spm处理组比未处理组MDA含量均降低,2 d时,0.45 mol/L NaCl胁迫下Spm处理组比未处理组MDA含量显著降低;4 d时,0.3 mol/L NaCl胁迫下Spm处理组比未处理组MDA含量显著降低。施加Spm降低了MDA的积累,从而缓解了盐胁迫对小麦幼苗的破坏。

3 讨论
在正常生理条件下,植物细胞内活性氧的产生与清除处于动态平衡之中,当植物受到冷害、干旱、盐碱等胁迫时,这种动态平衡将遭到破坏,使ROS大量积累,代谢发生紊乱。ROS的增加启动了植物防御系统,活性氧清除系统SOD、POD、CAT等保护酶系,在植物体内协同作用消除积累的ROS。研究表明,多胺能影响植物DNA、RNA以及蛋白质的合成,参与植物的各种生理生化反应,最终清除体内积累的ROS,提高植物在逆境环境下的抵抗能力[12-14]。该试验研究表明,随着盐胁迫时间的延长,小麦幼苗叶片中SOD、POD、CAT酶活性呈先升后降的趋势。施加0.1 nmol/L Spm的不同浓度盐胁迫处理,小麦叶片中SOD、POD、CAT的活性明显高于不加Spm的盐胁迫处理中小麦叶片的SOD、POD、CAT的活性,说明施加精胺使得植物清除活性氧的能力更强,以减轻不良生长环境的伤害,这与前人研究的结果[14]相似。
植物的细胞膜是植物内外物质能量交换的屏障,具有选择通透性,外界环境对植物的伤害导致膜透性增大,使植物代谢紊乱。因此,在盐胁迫下,植物的细胞膜受到环境的伤害,使膜的通透性增大,膜内的物质向膜外渗漏,最终使植物细胞死亡。MDA是植物膜系统稳定与否的重要指标,而膜系统稳定性的大小与植物的抗逆能力密切相关,其含量与植物的抗逆性呈负相关[15]。试验结果表明,施加0.1 mmol/L Spm的不同浓度NaCl胁迫时小麦幼苗中MDA含量比不加精胺的NaCl胁迫处理中小麦叶片MDA含量明显降低,MDA积累减少,缓解盐胁迫环境给小麦幼苗造成的伤害,从而提高了小麦
幼苗的抗盐性。
综上所述,施加外源精胺处理,可以增加小麦幼苗叶片POD、SOD、CAT保护酶活性,降低MDA含量,从而可缓解小麦幼苗的盐胁迫效应。
参考文献:
[1]殷奎德,马连菊,刘世强. 逆境条件下植物活性氧(ROS)的研究进展[J]. 沈阳农业大学学报,2003,34(2):147-149.
[2]徐鲜钧,沈宝川,祁建民,等. 植物耐盐性及其生理指标的研究进展[J]. 亚热带农业研究,2007,3(4):275-280.
[3]Martin-Tangguy J. Metabolism and function of polyamines in plants:recent development(new appreaches)[J]. Plant Growth Regulation,2001,34(1):135-148.
[4]段辉国,袁 澍,刘文娟,等. 多胺与植物逆境胁迫的关系[J]. 植物生理学通讯,2005,41(4):531-536.
[5]Akihiro I,Takashi M,Yoshie H,et al. Spemidine synthase genes are essential for survival ofArabidopsis[J]. Plant Physiology,2004,135(9):1565-1573.
[6]胡晓辉,邹志荣,杨振超. Spd诱导NaCl胁迫下番茄种子萌发和幼苗耐盐性效应研究[J]. 北方园艺,2009(10):5-8.
[7]李 斌,郭世荣,孙 锦,等. 外源Spd对盐胁迫下黄瓜幼苗生长和活性氧代谢的影响[J]. 江苏农业学报,2012,28(1):152-157.
[8]Duan H G,Yuan S,Liu W J,et al. Effects of exogenous spermidine on photosystem Ⅱ of wheat seedlings under water stress[J]. Journal of Integrative Plant Biology,2006,48(8):920-927.
[9]李合生,孙 群,赵世杰. 植物生理实验原理与技术[M]. 北京:高等教育出版社,2000.
[10]邹 琦,赵世杰. 植物生理学实验指导[M]. 北京:中国农业出版社,2000.
[11]赫再彬,苍 晶,徐 仲. 植物生理学实验[M]. 哈尔滨:哈尔滨工业大学出版社,2004.
[12]段九菊,郭世荣,康云艳,等. 外源亚精胺对盐胁迫下黄瓜幼苗活性氧水平和抗氧化酶活性的影响[J]. 园艺学报,2006,33(3):634-639.
[13]李 俊,李建明,胡晓辉,等. 亚精胺浸种对番茄幼苗抗盐碱的生理特性研究[J]. 西北植物学报,2012,32(9):1788-1795.
[14]Hu X Y,Wang S P,Qu B. Effect of spermidine on seed germination and seeding antioxidant system of tomato under NaCl stress[J]. Chinese Journal of Applied Ecology,2009,20(2):446-450.
[15]张国珍,周 睿,马俊莹,等. 精胺对离体小麦叶片膜脂过氧化的影响[J]. 山东农业大学学报,1992,23(2):176-179.

