分子印迹聚合物固相萃取-超高效液相色谱-串联质谱法检测水产品中11种氨基糖苷类药物残留
黄原飞 娄晓祎 周 哲 汪 洋 孔 聪 黄冬梅 蔡友琼 于慧娟*
1(中国水产科学研究院东海水产研究所 农业部水产品风险评估实验室(上海) , 上海 200090) 2(上海海洋大学 食品学院, 上海 201306) 3(赛默飞世尔科技(中国)有限公司, 上海 201206)
1 引 言
氨基糖苷类化合物(Aminoglycosides,AGs)是由氨基糖与氨基环醇通过氧桥连接而成的苷类碱性抗生素,广泛用于防治各种动物性疾病; 也常作为饲料添加剂,用于促进动物生长发育[1,2]。研究表明,AGs存在一定程度的耳毒性、肾毒性和神经肌肉阻滞作用[3,4]。因此,世界各国均建立了AGs在动物源性食品中的相关限量标准。如欧盟[5]规定链霉素在猪肝脏、肌肉中的最高残留限量(MRL)为500 μg/kg, 在乳品中的MRL为200 μg/kg; 我国农业部235号公告[6]规定牛、猪的肌肉中链霉素、双氢链霉素和新霉素的MRL分别为600、600 和500 μg/kg。
AGs的测定方法主要有微生物法[7]、免疫分析法[8]、液相色谱法(LC)[9,10]和液相色谱-串联质谱法(LC-MS/MS)[11~14]等。其中LC-MS/MS法由于抗背景干扰能力强、灵敏度高,应用最为广泛。目前对AGs测定方法的研究主要集中在蜂蜜[11]、牛奶[12]、动物内脏和肌肉[13]等方面,针对水产品基质的研究较少,且存在同时测定的药物种类少、灵敏度不高、通用性不强等不足。高玲等[15]建立了水产品中5种AGs的检测方法,方法定量限为10 μg/kg。Kaufmann等[16]建立了猪肉、牛肉和鱼肉中13种AGs的测定方法,但未对虾、蟹基质进行相关研究。因此开发灵敏度高、适用于多种水产品基质的AGs测定方法具有十分重要的意义。
分子印迹聚合物(MIP)固相萃取技术是利用分子印迹聚合物和模板分子在空间结构的互补匹配对目标物质进行识别、富集的分离富集技术[17,18]。该技术对目标化合物选择性高,特异性结合能力强,能够很好地消除基质干扰,提高分析的准确度和灵敏度[18,20]。
本研究以巴龙霉素、壮观霉素、妥布霉素、庆大霉素、卡那霉素、潮霉素B、安普霉素、链霉素、双氢链霉素、丁胺卡那霉素和新霉素等11种AGs为研究对象,采用MIP固相萃取柱净化,使用Obelisc R色谱柱,以甲酸-乙酸铵溶液和乙腈为流动相,实现了11种AGs的同时检测。本方法灵敏度高且适用于鱼、虾、蟹等多种水产品基质,为水产品中AGs的残留监管提供了技术支撑。
2 实验部分
2.1 仪器与试剂
Ultimate 3000超高效液相色谱仪,配自动进样器和柱温箱(美国Thermo Fisher公司); TSQ Quantiva三重四极杆质谱仪,配有电喷雾离子源(美国Thermo Fisher公司); 16RXII 高速冷冻离心机(日本 HITACHI CF公司); Milli-Q超纯水机(美国Millipore 公司); 固相萃取装置(美国Supelco公司); PHS-3G pH计(上海仪电科学仪器公司)。Supel MIP Aminolycosides固相萃取柱(50 mg/3 mL,美国Supelco公司); Obelisc R色谱柱(100 mm×2.1 mm,5 μm,美国SIELC公司)。
庆大霉素(94.4%)、壮观霉素(95.5%)、链霉素(99.0%)、卡那霉素(95.4%)、巴龙霉素(87.0%)、潮霉素B(79.3%)、安普霉素(81.5%)、妥布霉素(92.0%)、新霉素(90.0%)、丁胺卡那霉素(99.0%)、双氢链霉素(99.0%)均购自德国Dr. Ehenstorfer公司。七氟丁酸(≥99.5%,美国Sigma公司); 乙腈、甲醇(色谱纯,J.T.Baker公司); 甲酸(色谱纯,FLUKA公司); 三氯乙酸(TCA)、乙二胺四乙酸二钠(Na2EDTA)、磷酸二氢钾、乙酸铵、氨水、三氯甲烷均为分析纯; 实验用水由超纯水仪(美国Millipore 公司)制备。
2.2 溶液的配制
称取11种AGs标准品各10 mg(精确至0.1 mg),分别用水溶解并定容至10 mL,获得1 g/L的单标储备液。混合标准溶液以单标储备液稀释配制而成,各组分浓度为: 巴龙霉素、卡那霉素、双氢链霉素为0.4 μg/mL,安普霉素、丁胺卡那、壮观霉素、妥布霉素、潮霉素B、庆大霉素、链霉素为1 μg/mL,新霉素为4 μg/mL。4℃避光储存。氨基糖苷类化合物容易与玻璃发生吸附,实验过程中应尽量使用塑料容器[21]。
基质标准工作曲线的配制: 取6份((2.00±0.01) g)空白样品于50 mL塑料离心管中,分别加入适量混合标准溶液,按2.3节操作,基质标准溶液浓度为: 巴龙霉素、卡那霉素、双氢链霉素为1.0~100 μg/kg,安普霉素、丁胺卡那、壮观霉素、妥布霉素、潮霉素B、庆大霉素、链霉素为2.5~250 μg/kg,新霉素为10.0~1000 μg/kg。
2.3 样品前处理
2.3.1样品制备在上海市农贸市场随机购买草鱼(Ctenopharyngodonidellus)、南美白对虾(PenaeusvannameiBoone)、河蟹(Eriocheirsinensis),取可食部分,按照GB/T 30891-2014[22]的要求制样, -18℃保存,实验前解冻称样。
2.3.2提取称取样品2.0 g(精确到0.01 g)于50 mL塑料离心管中,加入10 mL 10 mmol/L磷酸盐提取液(含0.4 mmol/L EDTA和2% TCA),涡旋混匀后超声提取10 min,10000 r/min离心10 min,移取上清液至另一塑料离心管中,残渣按上述方法重复提取一次,合并两次上清液,用氨水调节至pH 7.0~7.5。取10 mL上清液,加入10 mL三氯甲烷,涡旋混匀后3000 r/min离心8 min,取上清液待净化。
2.3.3净化MIP固相萃取柱依次用1 mL甲醇、1 mL 50 mmol/L KH2PO4溶液活化,取5 mL待净化液上样后,依次用3 mL水、3 mL乙腈淋洗并抽干。加入3 mL 80%乙腈(含1%甲酸和5 mmol/L七氟丁酸)洗脱,收集洗脱液于45℃下氮气吹干,残渣用1 mL 75%乙腈(含1%甲酸和10 mmol/L乙酸铵)复溶,涡旋混匀后过0.22 μm有机滤膜,装入带有塑料内衬管的进样瓶中,待测。
2.4 仪器分析条件
2.4.1液相色谱分析条件色谱柱: Obelisc R柱(100 mm×2.1 mm,5 μm); 流动相: A为1%甲酸(V/V, 含2 mmol/L乙酸铵),B为1%甲酸-乙腈(V/V,含2 mmol/L乙酸铵); 梯度洗脱程序: 0~3 min,90% B; 3~6 min,90%~5% B; 6~17 min,5% B; 17~17.1 min,5%~90% B; 17.1~26 min,90% B。流速0.3 mL/min; 柱温30℃,进样量20 μL。
2.4.2质谱分析条件电喷雾离子源(ESI); 选择反应监测(SRM); 正离子扫描; 喷雾电压: 3500 V; 雾化温度: 350℃; 离子传输管温度: 325℃; 鞘气: 40 arb; 辅气: 5 arb。 11种AGs的质谱分析参数见表1。
表1 11种AGs质谱分析参数
Table 1 Mass spectrometry parameters for analysis of 11 kinds of aminoglycosides (AGs)
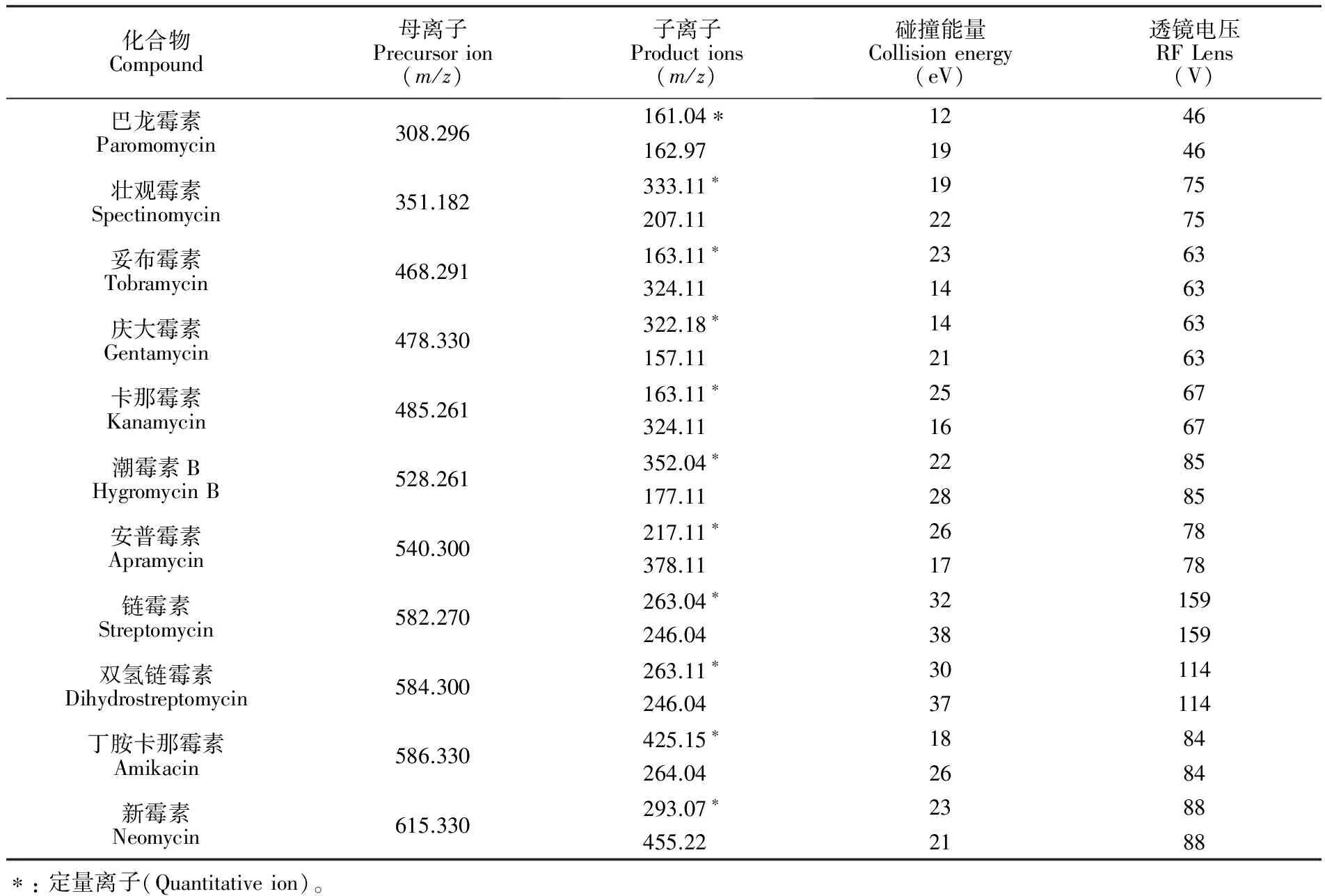
化合物Compound母离子Precursorion(m/z)子离子Productions(m/z)碰撞能量Collisionenergy(eV)透镜电压RFLens(V)巴龙霉素Paromomycin308.296壮观霉素Spectinomycin351.182妥布霉素Tobramycin468.291庆大霉素Gentamycin478.330卡那霉素Kanamycin485.261潮霉素BHygromycinB528.261安普霉素Apramycin540.300链霉素Streptomycin582.270双氢链霉素Dihydrostreptomycin584.300丁胺卡那霉素Amikacin586.330新霉素Neomycin615.330161.04∗162.97333.11∗207.11163.11∗324.11322.18∗157.11163.11∗324.11352.04∗177.11217.11∗378.11263.04∗246.04263.11∗246.04425.15∗264.04293.07∗455.2212461946197522752363146314632163256716672285288526781778321593815930114371141884268423882188∗:定量离子(Quantitativeion)。
3 结果与讨论
3.1 液相色谱-质谱分析条件的研究
3.1.1色谱柱的选择AGs药物极性强,分子中含有多个氨基和羟基,在C18柱上保留很弱。在流动相中添加离子对试剂(如七氟丁酸、五氟丙酸等),利用其与AGs结合形成疏水型离子对,可延长AGs在C18柱上的保留时间。但离子对试剂极易残留在液相色谱-质谱仪内,造成离子源污染和信号抑制[23]。
为避免使用离子对试剂,本研究根据AGs的性质选择了氨基柱(Luna-NH2和Thermo Amino)、亲水柱(Waters Hilic)和混合型离子柱(Obelisc R)4种色谱柱,对11种AGs进行分离。实验结果表明,Luna-NH2柱对壮观霉素、链霉素、双氢链霉素不保留; Thermo Amino柱对壮观霉素不保留, 且链霉素、双氢链霉素仅部分保留; 在Waters Hilic 柱上壮观霉素不保留, 且新霉素峰形不好; Obelisc R 柱上各组分均能保留,峰形较好,且灵敏度高于其它色谱柱。因此,本研究选取Obelisc R 柱作为AGs检测的色谱柱。
3.1.2流动相的优化分别采用甲酸含量为0.1%、0.5%、1.0%和1.5%的水溶液和乙腈为流动相,考察甲酸浓度对色谱峰形和灵敏度的影响。结果表明,甲酸浓度为1%时,除壮观霉素外, 其余各组分响应值最高, 且色谱峰形最佳。在流动相中分别添加2、5、10和20 mmol/L乙酸铵增强壮观霉素的保留性能。结果表明,2 mmol/L乙酸铵在增强壮观霉素保留的同时,巴龙霉素、卡那霉素等组分灵敏度有所增高; 而随着乙酸铵浓度升高,巴龙霉素、妥布霉素、安普霉素存在拖尾情况,且灵敏度下降。故最终采用1%甲酸(含2 mmol/L乙酸铵)-乙腈作为流动相。图1为在最佳分析条件下11种AGs的标准溶液提取离子流图。
3.2 样品前处理方法的研究
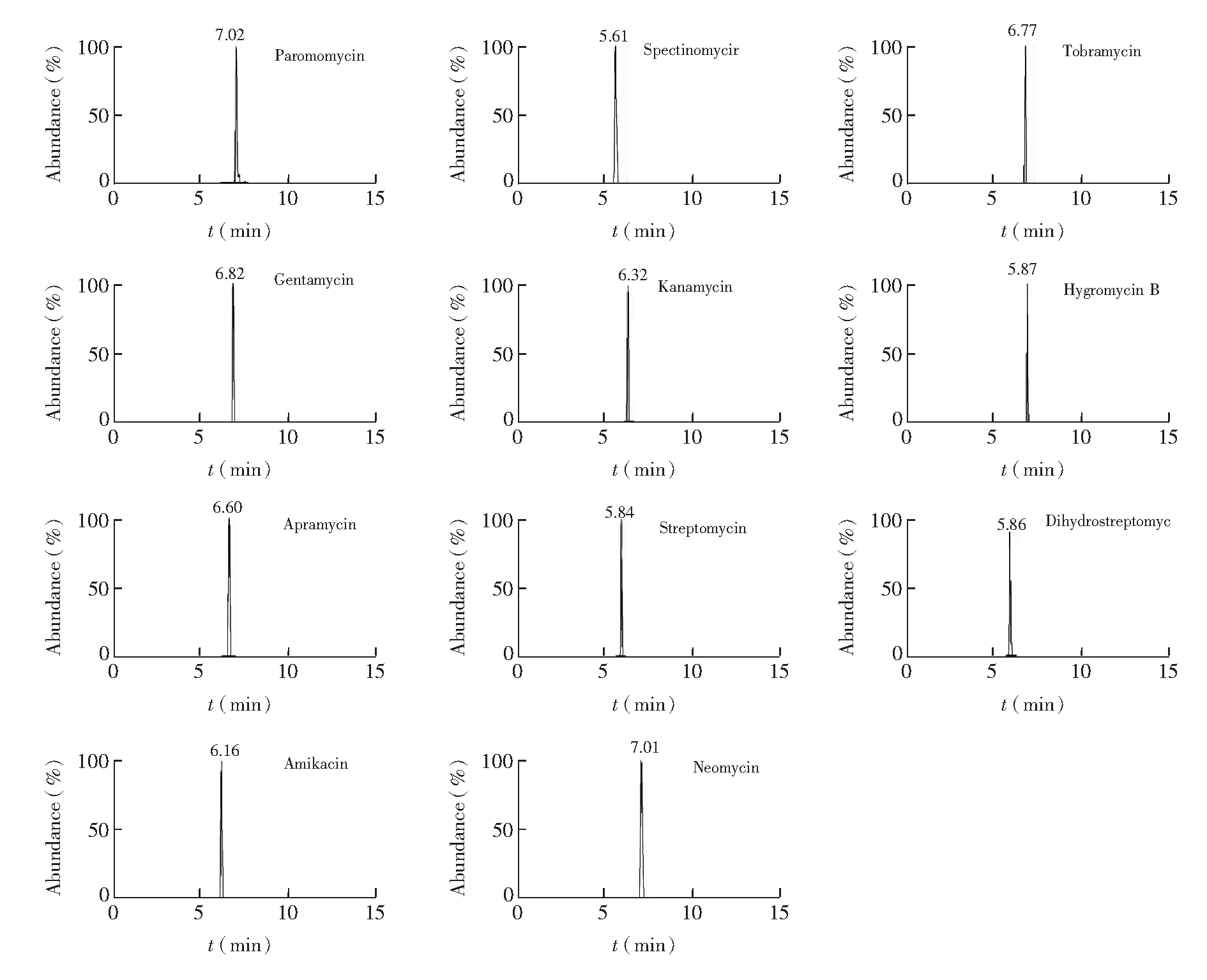
图1 11 种AGs标准溶液的提取离子流图Fig.1 Extracted ion chromatograms of 11 AGs
3.2.1固相萃取柱的选择本研究采用磷酸盐缓冲液(含0.4 mmol/L EDTA和2% TCA)提取水产品中残留的AGs[21,24,25],提取后溶液中含有大量水溶性杂质,常用固相萃取方法对目标物进行富集净化处理。本研究采用空白基质液过柱前加标的方法对4种固相萃取柱(Oasis PRiME HLB、WCX、C18和MIP)的吸附效率和净化效果进行评价。实验结果表明,MIP柱对11种AGs回收率在75%~95%之间且净化效果好; 而Oasis Prime HLB、WCX、C18柱对壮观霉素的回收率均低于50%,对潮霉素、新霉素回收率低于60%。因此选择MIP柱对提取液进行净化。
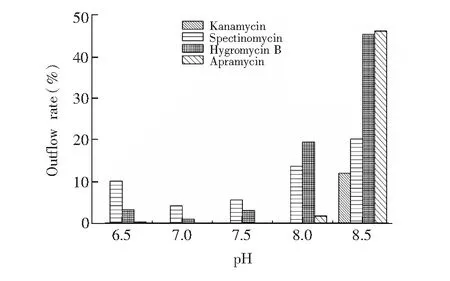
图2 不同pH值条件下AGs的上样流出率Fig.2 Outflow rate of AGs at different pH value
3.2.2上样溶液pH值的优化AGs分子中含有多个羟基和氨基,在不同pH值条件下,AGs以不同的离子态形式存在于溶液中,进而影响目标物在MIP柱上的保留性能。本研究考察了MIP柱对不同pH值的上样溶液的吸附性能,其中上样溶液为100 μg/L AGs混合标准溶液。将上样溶液pH值分别调整为6.5、7.0、7.5、8.0、8.5,过柱后收集其流出液,将流出液与同等浓度标准溶液对比,评价MIP柱对11种AGs的吸附效率(目标物流出率=流出液中目标物峰面积/同等浓度目标物标准溶液峰面积×100%)。结果表明,除壮观霉素、安普霉素、卡那霉素和潮霉素B受pH值影响较大外,其它组分所受影响很小,可以忽略不计。不同pH值下壮观霉素、安普霉素、卡那霉素和潮霉素B流出率见图2。由图2可见,pH从6.5升至7.0时,AGs的流出率逐渐降低; pH从7.5升至8.5时,流出率显著增加; 而在中性条件下,流出率最低。这可能是由于在酸性或碱性条件下,AGs分子更易得质子或失质子,不利于其与MIP吸附剂形成相互作用力,从而使AGs在MIP柱上的保留能力变弱[26]。因此应将上样溶液的pH值严格控制在7.0~7.5,以避免上样损失。
3.3 基质效应的研究
由于样品基质复杂,含有大量的内源性化合物,易与待测物一同进入色谱柱,干扰目标化合物的检测,因此需要对基质效应进行评价[27]。基质效应计算公式[28,29]为: 基质效应=(1-基质匹配标准曲线的斜率/标准曲线的斜率)×100%。结果表明,样品基质对壮观霉素、链霉素、双氢链霉素的抑制率>60%,对其余AGs的抑制率为5%~40%。由于基质效应明显,本研究中采用空白基质液配制标准曲线所需溶液,或者采用标准添加法制备标准曲线所需溶液,以消除基质效应的影响,提高定量分析结果的准确性。
3.4 方法分析性能以及评价
3.4.1线性范围及检出限以南美白对虾为基质,各AGs添加水平分别为0.5、1.0、2.0、2.5、5.0、10.0和20.0 μg/kg,经提取净化后上机分析,以标准溶液质量浓度为横坐标(x),各化合物定量离子的色谱峰面积为纵坐标(y),绘制标准曲线。以S/N≥3,回收率>50%,精密度<30%为评价依据,确定方法检出限为1.0~10.0 μg/kg。以S/N≥10,回收率>70%,精密度<20%为评价依据,确定方法定量限为2.0~20.0 μg/kg。11种AGs的回归方程、线性范围、方法检出限及定量限见表2。
表2 11种AGs回归方程、线性范围、方法检出限及定量限
Table 2 Calibration equation, linear range, limit of detection (LOD) and limit of quantification (LOQ) of 11 kinds of AGs
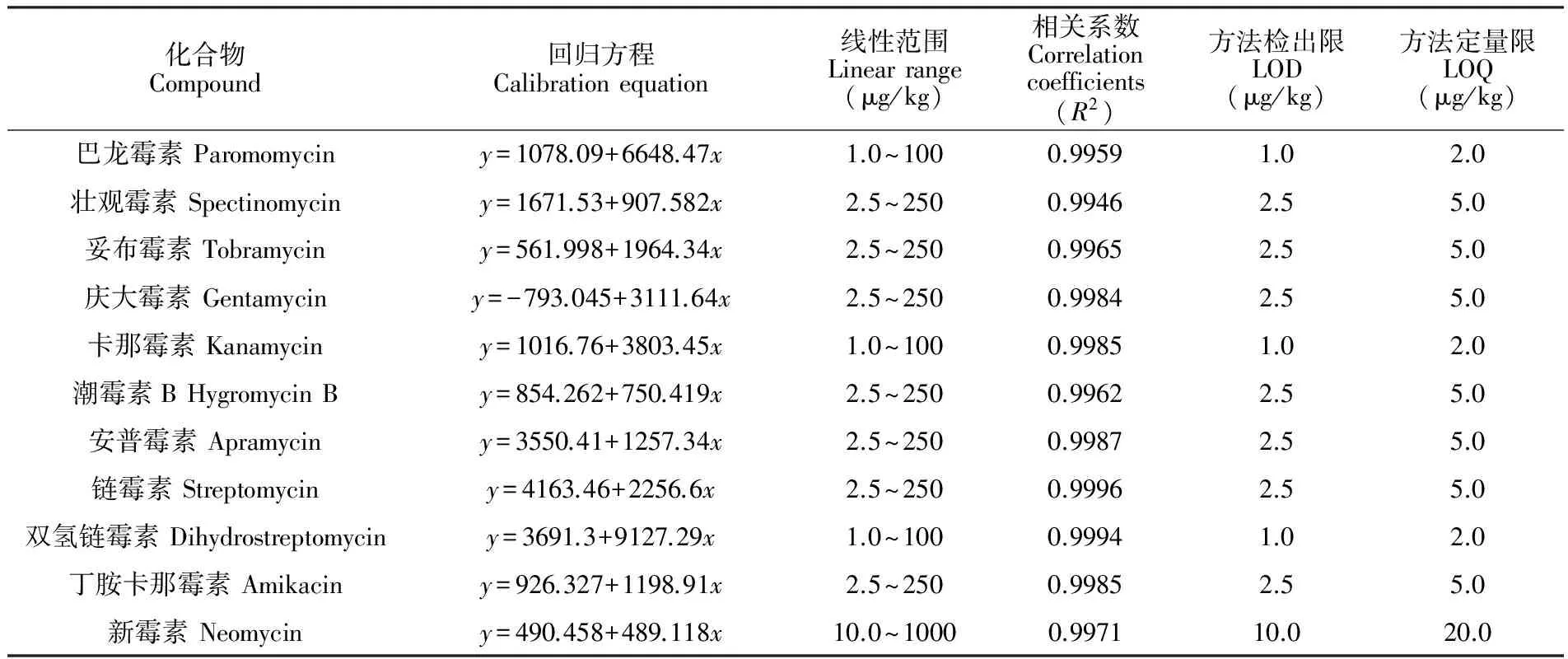
化合物Compound回归方程Calibrationequation线性范围Linearrange(μg/kg)相关系数Correlationcoefficients(R2)方法检出限LOD(μg/kg)方法定量限LOQ(μg/kg)巴龙霉素Paromomyciny=1078.09+6648.47x1.0~1000.99591.02.0壮观霉素Spectinomyciny=1671.53+907.582x2.5~2500.99462.55.0妥布霉素Tobramyciny=561.998+1964.34x2.5~2500.99652.55.0庆大霉素Gentamyciny=-793.045+3111.64x2.5~2500.99842.55.0卡那霉素Kanamyciny=1016.76+3803.45x1.0~1000.99851.02.0潮霉素BHygromycinBy=854.262+750.419x2.5~2500.99622.55.0安普霉素Apramyciny=3550.41+1257.34x2.5~2500.99872.55.0链霉素Streptomyciny=4163.46+2256.6x2.5~2500.99962.55.0双氢链霉素Dihydrostreptomyciny=3691.3+9127.29x1.0~1000.99941.02.0丁胺卡那霉素Amikaciny=926.327+1198.91x2.5~2500.99852.55.0新霉素Neomyciny=490.458+489.118x10.0~10000.997110.020.0
3.4.2方法准确度和精密度以阴性南美白对虾、草鱼和河蟹为检测对象,通过标准添加实验,考察方法的加标回收率和精密度。添加水平: 巴龙霉素、卡那霉素、双氢链霉素分别为2.0、4.0和50.0 μg/kg; 安普霉素、丁胺卡那、壮观霉素、妥布霉素、潮霉素B、庆大霉素、链霉素分别为5.0、10.0和125.0 μg/kg; 新霉素分别为20.0、40.0和500.0 μg/kg,每个加标浓度做6个平行实验, 11种AGs的平均加标回收率和精密度见表3。由表3可知,在不同的样品中11种化合物加标回收率在78.4%~109.6%之间,RSD(n=6)在2.3%~14.9%之间,方法准确度和精密度满足微量分析的要求。
3.5 实际样品分析
随机在上海农贸市场选取草鱼样品7个、南美白对虾样品7个、河蟹样品6个,采用本方法对样品中11种AGs进行检测,20个样品中均未检出AGs。
4 结 论
建立了水产品中11种氨基糖苷类药物残留的液相色谱-串联质谱检测方法。采用磷酸盐缓冲溶液作为提取剂,MIP固相萃取柱富集净化,Obelisc R柱进行分离,不使用离子对试剂的条件下实现了11种氨基糖苷化合物的同时检测。本方法具有灵敏度高、通用性强等优点。
表3 空白南美白对虾、草鱼和河蟹样品中11种AGs的加标回收率及相对标准偏差(n=6)
Table 3 Recoveries and relative standard deviations (RSD) of 11 AGs in shrimp, grass carp and carb blank samples (n=6)
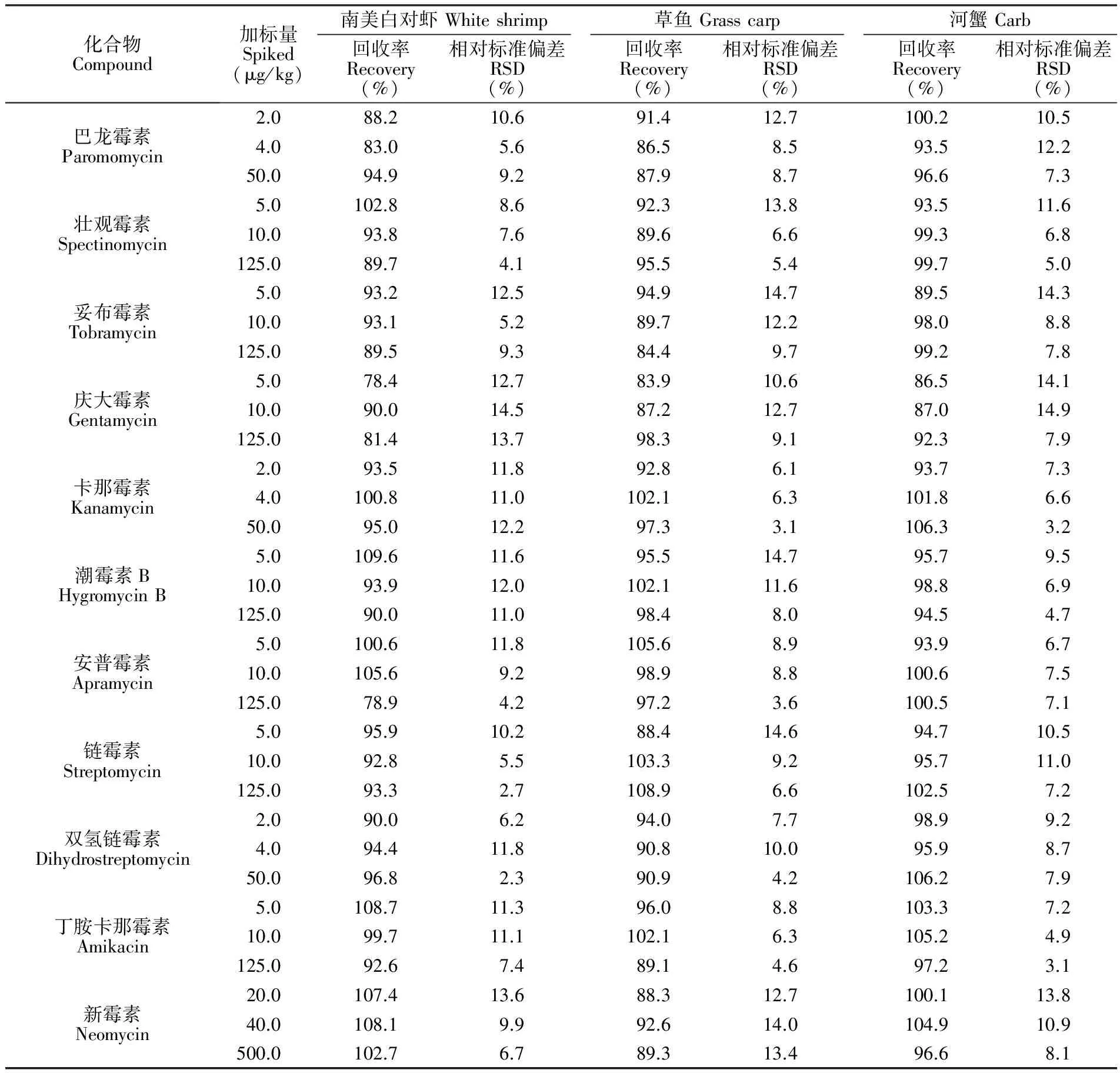
化合物Compound加标量Spiked(μg/kg)南美白对虾Whiteshrimp回收率Recovery(%)相对标准偏差RSD(%)草鱼Grasscarp回收率Recovery(%)相对标准偏差RSD(%)河蟹Carb回收率Recovery(%)相对标准偏差RSD(%)巴龙霉素Paromomycin壮观霉素Spectinomycin妥布霉素Tobramycin庆大霉素Gentamycin卡那霉素Kanamycin潮霉素BHygromycinB安普霉素Apramycin链霉素Streptomycin双氢链霉素Dihydrostreptomycin丁胺卡那霉素Amikacin新霉素Neomycin2.088.210.691.412.7100.210.54.083.05.686.58.593.512.250.094.99.287.98.796.67.35.0102.88.692.313.893.511.610.093.87.689.66.699.36.8125.089.74.195.55.499.75.05.093.212.594.914.789.514.310.093.15.289.712.298.08.8125.089.59.384.49.799.27.85.078.412.783.910.686.514.110.090.014.587.212.787.014.9125.081.413.798.39.192.37.92.093.511.892.86.193.77.34.0100.811.0102.16.3101.86.650.095.012.297.33.1106.33.25.0109.611.695.514.795.79.510.093.912.0102.111.698.86.9125.090.011.098.48.094.54.75.0100.611.8105.68.993.96.710.0105.69.298.98.8100.67.5125.078.94.297.23.6100.57.15.095.910.288.414.694.710.510.092.85.5103.39.295.711.0125.093.32.7108.96.6102.57.22.090.06.294.07.798.99.24.094.411.890.810.095.98.750.096.82.390.94.2106.27.95.0108.711.396.08.8103.37.210.099.711.1102.16.3105.24.9125.092.67.489.14.697.23.120.0107.413.688.312.7100.113.840.0108.19.992.614.0104.910.9500.0102.76.789.313.496.68.1
1 LONG Zhao-Yang, XU Xiu-Min.ChineseJournalofFoodHygiene,2006, 18(2): 148-152
龙朝阳, 许秀敏. 中国食品卫生杂志,2006, 18(2): 148-152
2 Farouk F, Azzazy H M, Niessen W M.Anal.Chim.Acta,2015, 890: 21-43
3 XU Li-Jia, LIU Xiao, ZHANG Xiu-Qin, LIU Jing-Xian, MIAO Cui.ChineseJournalofPharmaceuticalAnalysis,2016, 36(2): 301-305
徐丽佳, 刘 笑, 张秀芹, 刘敬先, 苗 翠. 药物分析杂志,2016, 36(2): 301-305
4 Foster J, Tekin M.J.Med.HumanGenetics,2016, 17(3): 287-293
5 (EC) No 470/2009LayingDownCommunityProceduresfortheEstablishmentofResidueLimitsofPharmacologicallyActiveSubstancesinFoodstuffsofAnimalOrigin. Regulation of European Community
6 Ministry of Agriculture of the People's Republic of China No. 235 . Ministry of Agriculture of the People's Republic of China
中华人民共和国农业部公告第235号. 中华人民共和国农业部
7 Wang S, Xu B, Zhang Y, He J X.MeatSci.,2009, 82(1): 53-58
8 Losoya A, Estevez M C, Martinez S O, Lechuga L M.Talanta,2015, 141: 253-258
9 Clarot I, Regazzeti A, Auzeil N, Laadani F, Citton M, Netter P, Nicolas A.J.Chromatogr.A,2005, 1087: 236-244
10 Zhang L, Peng J D, Tang J X, Yuan B F, Yuan Y.Anal.Chim.Acta,2011, 706(2): 199-204
11 Moreno G D, Lara F J, Jurgovska N, Gamiz G L, Garcia A M.Anal.Chim.Acta,2015, 891: 321-328
12 Moreno G D, Hamed A M, Garcia A M, Gamiz G L.Talanta,2017, 171: 74-80
13 Arsand J B, Jank L, Martins M T, Hoff R B, Barreto, Pizzolato T M, Sirtori C.Talanta,2016, 154: 38-45
14 YE Lei-Hai, ZHONG SHi-Huan, YE Jia-Ming, YANG Lin, XU Rong-Nian.ChemicalEngineeringDesignCommunications,2016, 12(42): 107-109,111
叶磊海, 钟世欢, 叶佳明, 杨 琳, 许荣年. 化工设计通讯,2016, 12(42): 107-109,111
15 GAO Ling, ZHANG Dan, GAO Feng, GUO Dong, YANG Rui-Zhang, YU Bo-Hua.ChineseJournalofVeterinaryDrug,2012, 46(11): 27-30
高 玲, 张 丹, 高 峰, 郭 栋, 杨瑞章, 于伯华. 中国兽药杂志,2012, 46(11): 27-30
16 Kaufmann A, Butcher P, Maden K.Anal.Chim.Acta,2012, 711(20): 46-53
17 CAI Ya-Qi, MO Shi-Fen.JournalofInstrumentalAnalysis,2005, 24(5): 116-121
蔡亚岐, 牟世芬. 分析测试学报,2005, 24(5): 116-121
18 HU Yan-Yun, XU Hui-Qun, YAO Jian, LV Ya-Ning, SONG Wei, LI Wen-Jing, HAN Fang, ZHENG Ping.ChineseJ.Anal.Chem,2014, 42(2): 227-232
胡艳云, 徐慧群, 姚 剑, 吕亚宁, 宋 伟, 李文静, 韩 芳, 郑 平. 分析化学,2014, 42(2): 227-232
19 LIAO Su-Lan, CHEN Shao-Yun, LIU Qi-Lin, CHEN Liang-Bi, LI Xiao-Min.ChineseJ.Anal.Chem.,2018, 46(1): 100-106
廖素兰, 陈少云, 刘奇琳, 陈良壁, 李晓敏. 分析化学,2018, 46(1): 100-106
20 WANG Yan-Hong, HUO Jia-Ping, ZHANG Hong, WANG Shi-Cheng, SI Shi-Hui, LIN Gui-Feng, LI Guo-Chen, LIU Wei.ChineseJ.Anal.Chem,2010, 38(5): 678-682
王颜红, 霍佳平, 张 红, 王世成, 司士辉, 林桂凤, 李国琛, 刘 伟. 分析化学,2010, 38(5): 678-682
21 SUN Lei, ZHANG Li, HUANG Yao-Ling, WANG Xia, WANG Shu-Huai.JournalofChineseMassSpectrometrySociety,2009, 30(1): 60-64
孙 雷, 张 骊, 黄耀凌, 汪 霞, 王树槐. 质谱学报,2009, 30(1): 60-64
22 GB/T 30891-2014,PracticeofSamplingPlansforAquaticProducts. National Standards of the People's Republic of China
水产品抽样规范. 中华人民共和国国家标准. GB/T 30891-2014
23 GONG Qiang, DING Li, ZHU Shao-Hua, JIAO Yan-Na, CHENG Jing, FU Shan-Liang, WANG Li-Bing.ChineseJournalofChromatography,2012, 30(11): 1143-1147
龚 强, 丁 利, 朱绍华, 焦艳娜, 成 婧, 付善良, 王利兵. 色谱,2012, 30(11): 1143-1147
24 GB/T 21323-2007,DeterminationofAminoglycosidesResiduesinAnimalTissuesHPLC-MS/MSMethod. National Standards of the People's Republic of China
动物组织中氨基糖苷类药物残留量的测定 高效液相色谱-质谱/质谱法. 中华人民共和国国家标准. GB/T 21323-2007
25 Ishii R, Horie M, Chan W, MacNeil J.FoodAddit.Contam.,2008, 25(12): 1509-1519
26 WANG Li-Jun, CAO Xu-Min, SUN Xiao-Liang, WANG Shu-Ting, LIU Jing, HAO Zhi-Hui, QU Bao-Han, ZHAO Si-Jun.ChineseJournalofChromatography,2016, 34(3): 240-248
王丽君, 曹旭敏, 孙晓亮, 王淑婷, 刘 静, 郝智慧, 曲宝涵, 赵思俊. 色谱,2016, 34(3): 240-248
27 YAO Meng-Kan, MA Bing-Liang, MA Yue-Ming.ChineseJournalofPharmaceuticalAnalysis,2010, 30(12): 2436-2440
姚梦侃, 马秉亮, 马越鸣. 药物分析杂志,2010, 30(12): 2436-2440
28 ZHU Li, WANG Chen, CHEN Hong-Ping, ZHANG Ying-Bin, ZHOU Su-Juan, WANG Guo-Qing, LIU Xin.ChineseJ.Anal.Chem,2017, 45(4): 529-536
诸 力, 王 晨, 陈红平, 张颖彬, 周苏娟, 王国庆, 刘 新. 分析化学,2017, 45(4): 529-536
29 YANG Bi-Xia, WANG Lian, LUO Chun-Ying, WANG Xi-Xi, SUN Cheng-Jun.ModernPreventiveMedicine,2017, 44(7): 1285-1289, 1298
杨碧霞, 王 炼, 骆春迎, 王希希, 孙成均. 现代预防医学,2017, 44(7): 1285-1289, 1298

