基于空气动力辅助离子化-超高分辨质谱成像技术的大鼠肾脏组织中多种类代谢物的分布研究
王中华 何秉淑 孙成龙 宋肖炜 贺玖明 张瑞萍 再帕尔·阿不力孜*,
1(中央民族大学生命与环境科学学院,生物成像与系统生物学研究中心, 北京 100081) 2(中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室, 北京 100050)
1 引 言
质谱成像(Mass spectrometry imaging,MSI) 是将成像处理软件与质谱的离子扫描技术相结合的一种新型成像方法,可在分子水平上对生物组织内的分子“直接”分析,获取其含量和空间分布信息[1,2]。肾脏是重要的代谢和排泄器官,小分子代谢物代谢异常在糖尿病肾病等多种肾病的发生过程中具有重要作用,全面了解其在肾脏组织中的含量及分布特征,有助于揭示肾脏疾病的发病机制、发现具有组织特异性的生物标志物[3~5]。目前,MSI技术主要包括以下三大类型: 需要在真空条件下进行离子化的二次离子质谱(SIMS), 基质辅助激光解吸电离(MALDI)质谱,以及近几年发展起来的以解吸电喷雾电离(DESI)为代表的敞开式离子化质谱成像技术等[6~10]。其中,SIMS成像技术主要应用于样品表面的元素分析。MALDI-MSI是最成熟、应用最为广泛的质谱成像技术,尤其适用于蛋白质、多肽等生物大分子的成像分析[6,7],近年来,随着新型基质的开发,其也被应用在小分子成像分析领域。如Liu等[11]采用基于新型耐盐基质的MALDI-MSI质谱成像技术研究了肾纤维化的发病机制,发现肾纤维化动物模型中与糖酵解、三羧酸循环、脂肪酸代谢、抗氧化剂等代谢网络相关的21种小分子代谢物的含量及分布特征发生了显著变化。与MALDI-MSI相比,DESI-MSI技术具有可在开放环境下操作、使用便捷,且样品前处理简单、无需添加基质等优点,在小分子代谢物成像分析方面具有广阔的应用前景[9,10]。如Dill等[12]采用DESI-MSI技术比较了乳头状肾细胞癌的癌组织与癌旁组织脂类代谢物的整体轮廓差异,结果表明,DESI-MSI技术结合多元统计分析可准确区分癌组织与正常组织,可应用于疾病分子病理诊断。本课题组前期自主研发出新型敞开式空气动力辅助离子化(Air flow assisted ionization, AFAI;或称之为Air flow assisted desorption electrospray ionization, AFADESI;以下统称为AFAI)及其免标记、便捷、高灵敏的质谱分子成像新技术(AFAI-MSI),并成功应用于候选新药作用机制和肿瘤生物标志物的原位筛查及免标记分子病理诊断的研究[13,14]。本研究建立了基于AFAI-MSI技术检测大鼠肾脏组织中小分子代谢物的分布特征的质谱成像分析方法,为AFAI-MSI技术在肾脏疾病研究中的应用提供了重要依据。
2 实验部分
2.1 仪器与试剂
AFAI-MSI成像系统平台,采用Q Exactive型四极杆-静电场轨道离子阱质谱仪(美国Thermo Scientific公司),拆卸原有商业离子源,通过自制离子源接口安装AFAI 离子源,并配有Xcalibur 2.2数据采集与处理系统;UltiMate 3000系列超高效液相色谱仪(美国Thermo Scientific公司),包括二元梯度泵、在线脱气机、自动进样器(配有恒温箱)、柱温箱、二极管阵列检测器;CM 1860冷冻切片机(德国Leica Microsystem公司)。乙腈、异丙醇(色谱纯,Merck公司),实验用水为某品牌纯净水。8周龄SD大鼠由北京维通利华实验动物技术有限公司提供。
2.2 肾脏组织样本的制备
将2只雌性SD大鼠于高浓度CO2条件下处死,立即摘取肾脏组织,用超纯水冲洗掉外周血迹后迅速置于液氮中冷冻,于-80℃保存。
2.3 组织切片的制备
将组织从-80℃冰箱转移至CM 1860冷冻切片机(操作温度为-20℃),连续获取相邻两个厚度为8 μm的肾脏组织切片,分别置于两个载玻片上,然后真空干燥30 min。
2.4 质谱条件
采用正离子全扫描模式,扫描范围为70~1000 Da,质量分辨率设为70000,自动增益控制目标值为3×106,最大注入时间为200 ms。喷雾电压为7 kV,传输管电压为3 kV,喷雾气(氮气)压力为0.6 MPa,喷雾溶剂(异丙醇-乙腈-水,4∶4∶2,V/V)流速为5 μL/min,空气辅助气流速为45 L/min。数据采集采用Xcalibur 2.2软件(美国Thermo Scientific公司)。
2.5 数据处理方法
利用Xcalibur 2.2软件将原始数据文件转换为cdf格式,随后采用本课题组与科迈恩(北京)科技有限公司合作研制的质谱成像软件MassImager(质谱成像系统工作站v1.0版)进行文件读取,以检测离子的种类、相对强度和空间位置,进行成像分析[15]。
3 结果与讨论
3.1 溶剂的选择
溶剂的极性、粘度、表面张力、介电常数等理化性质是影响喷雾溶剂将目标分子从组织内萃取、解吸、电离的因素。采用甲醇、乙腈、异丙醇和水作为喷雾溶剂,以质谱峰个数和强度为监测指标,分别对溶剂组成和比例进行了优化。结果表明,采用乙腈-异丙醇-水(4∶4∶2,V/V)作为喷雾溶剂,对小分子代谢物的检测效果最佳。
3.2 方法稳定性考察
制备宽度和间隔均为3 mm的罗丹明B红色条带,对其进行AFAI-MS分析,以m/z443.2离子强度为监测指标,连续测定3天,考察了分析系统的稳定性[16]。结果表明,m/z443.2离子峰面积的相对标准偏差(Relative standard deviation,RSD)<20%,表明AFAI-MS分析方法的重复性良好。
3.3 AFAI-高分辨质谱检测分析
应用空气动力辅助离子化-超高分辨质谱对肾脏组织冰冻切片进行了原位分析,结果表明,在正离子模式下能够检测到信号强度103~107的离子共498个(去除同位素),检测到的离子类型包括[M+H]+、[M+Na]+、[M+K]+、[2M+Na]+和[2M+K]+等。利用其精确质荷比信息,在Metlin、HMDB、LIPID MAPS等数据库中检索可能的分子式及代谢物,结合同位素丰度比、不同类型加合离子之间的精确质荷比差值以及文献报道等信息,分析推测代谢物的可能结构,共发现38种不同种类的内源性代谢物(表1)。从表1可见,这些代谢物的分子量在100~900 Da之间均有分布,其质量偏差均在5 ppm以内,分别属于有机胺、糖、神经递质、维生素、多肽、有机酸、甘油磷脂、鞘脂、甘油脂、固醇酯等不同的代谢物类型,表明建立的基于超高分辨质谱的AFAI-MS分析方法可适用于肾脏组织中含量差异较大的不同分子量和结构类型的多种小分子代谢物的原位分析,并能获得准确的分子信息。
表1 从肾脏组织中发现的38种内源性代谢物
Table 1 38 kinds of metabolites identified in rat kidney tissues

名称aName实测质荷比Measured(m/z)理论质荷比Theoretical(m/z)质量偏差bDeviationofmass(δ)分子离子Molecularions胆碱Choline104.1074104.10703.84[M+H]+甜菜碱Betaine118.0864118.08630.85[M+H]+牛磺酸Taurine126.0221126.02200.79[M+H]+肌酐Creatinine136.0482136.04810.74[M+Na]+N⁃甲基尼克酰胺N⁃methylnicotinamide137.0710137.07090.73[M+H]+乙酰胆碱Acetylcholine146.1175146.1176-0.68[M+H]+肉碱Carnitine162.1124162.1125-0.62[M+H]+乙酰精氨Acetylspermidine188.1757188.17570.00[M+H]+甘油磷酸Glycerolphosphate195.0029195.00290.00[M+Na]+葡萄糖Glucose203.0526203.05260.00[M+Na]+山梨醇Sorbitol205.0683205.06830.00[M+Na]+磷酸胆碱Phosphocholine206.0552206.05520.00[M+Na]+泛酸PantothenicAcid242.0996242.0999-1.24[M+Na]+甘油磷脂酰乙醇胺Glycerylphosphorylethanolamine254.0189254.0190-0.39[M+K]+硫胺素Thiamine265.1115265.1118-1.13[M+H]+甘油磷脂酰胆碱Glycerophosphocholine280.0918280.0920-0.71[M+Na]+柠檬酸钠Sodiumcitrate332.9559332.9571-3.60[M+K]+精氨酸⁃羟基天冬氨酸酸或羟基精氨酸⁃天冬氨酸酸Lys⁃Asp⁃OHorAsp⁃Lys⁃OH392.1052392.1064-3.06[M+Na]+1⁃(3⁃甲基丁酰基)⁃6⁃芹菜糖基葡萄糖1⁃(3⁃Methylbutanoyl)⁃6⁃apiosylglucose397.1707397.17050.50[M+H]+硬脂酰基肉碱Stearoylcarnitine428.3732428.3735-0.70[M+H]+MG(18∶0)381.2973381.2975-0.52[M+Na]+LysoPC(16∶0)518.3214518.3217-0.58[M+Na]+PC(18∶2)558.2952558.2956-0.72[M+K]+PC(18∶1)560.3102560.3112-1.78[M+K]+PC(20∶4)582.2960582.29560.69[M+K]+PG(22∶4)583.2990583.3006-2.74[M+Na]+PA(30∶0)607.4694607.4697-0.49[M+H]+CE(20∶4)695.5730695.5737-1.01[M+Na]+Cer(44∶1)700.6570700.6578-1.14[M+Na]+SM(34∶2)723.5405723.5411-0.83[M+Na]+SM(34∶1)739.5137739.5150-1.76[M+K]+PG(34∶1)771.5121771.5146-3.24[M+Na]+PE(38∶5)788.4958788.4990-4.06[M+K]+PG(36∶2)797.5277797.5302-3.13[M+Na]+PC(38∶5)804.4969804.49403.60[M+K]+SM(42∶3)833.6485833.6507-2.64[M+Na]+PC(40∶8)852.5501852.5514-1.52[M+Na]+LacCer(d32∶1)872.5490872.5495-0.57[M+K]+a,脂类化合物的简称:化合物名(碳原子数:双键数),MG:甘油单酯,LysoPC:溶血磷脂酰胆碱,PC:磷脂酰胆碱,PG:磷脂酰甘油,PA:磷脂酸,CE:胆固醇酯,Cer:神经酰胺,SM:鞘磷脂,PE:磷脂酰乙醇胺,LacCer:乳糖神经酰胺。b,质量偏差:质量偏差=(实测质量数-理论质量数)/理论质量数×106。a,Abbreviationoflipidcompounds:Compoundname(NumberofCarbons:Numberofdoublebonds),MG:Monoglycerides,LysoPC:Lyso⁃phosphatidylcholine,PC:Phosphatidylcholine,PG:Phosphatidylglycerol,PA:Phosphatidicacid,CE,Cholesterylester,Cer,Ceramide,SM:Sphingomyelin,PE:Phosphatidylethanolamine,LacCer:Lactosylceramide.b.Deviationofmass:Deviationofmass=(Measuredmass-the⁃oreticalmass)/Theoreticalmass×106.
3.4 代谢物的质谱成像分析
胆碱及其代谢物在肾组织中的分布情况如图1所示,胆碱是细胞膜、线粒体膜和神经递质乙酰胆碱的组成成分,参与脂代谢、信号传导、生物分子的翻译后修饰、核受体的激活、细胞膜的流动性调控等多种生命过程[17]。从图1可见,胆碱在肾脏组织中分布广泛,在肾皮质和肾乳头区域含量最高。
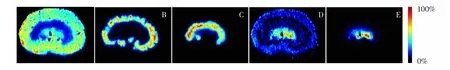
图1 胆碱及其代谢物在大鼠肾组织中的分布: (A) 胆碱, (B) 乙酰胆碱, (C) 甜菜碱, (D) 磷酸胆碱, (E) 甘油磷酸胆碱Fig.1 Distribution of choline and its metabolites in rat kidney tissues: (A) Choline, (B) Acetylcholine, (C) Betaine, (D) Phosphocholine, and (E) Glycerophosphocholine
乙酰胆碱是胆碱在胆碱乙酰基转移酶的作用下合成的,可促进水和离子的排出。本研究发现乙酰胆碱主要分布于近髓皮质区域,可能与胆碱乙酰基转移酶在肾皮质集合管中的特异性分布有关[18]。
甜菜碱和甘油磷脂酰胆碱分别是胆碱的氧化和磷酸化代谢产物,分别在肾脏外髓质和肾乳头区域有特异性分布。据报道,甜菜碱和甘油磷脂酰胆碱是肾脏中重要的渗透保护剂,参与肾脏皮质-髓质轴向渗透压梯度的形成,并且能够对抗高尿素环境对肾髓质细胞的损害作用,维持细胞内生物大分子的正常结构和功能[19]。甜菜碱在外髓质区域含量很高,不仅可以检测到[M+H]+、[M+Na]+、[M+K]+等准分子离子,还能检测到较强的 [2M+Na]+、[2M+K]+等准分子离子峰,这些离子在肾脏组织中分布特征基本一致(图2)。

图2 甜菜碱的5种分子离子在大鼠肾组织中的分布: (A) [M+H]+,(B) [M+Na]+,(C) [M+K]+,(D) [2M+Na]+,(E) [2M+K]+Fig.2 Distributions of five molecular ions of betaine in rat kidney tissue: (A) [M+H]+, (B) [M+Na]+, (C) [M+K]+, (D) [2M+Na]+, (E) [2M+K]+
磷酸胆碱在皮质和外髓质部分具有少量分布,且主要分布在肾乳头区域,推测其可能参与肾脏皮质-髓质轴向渗透压梯度的形成。文献[19]中曾将皮质和髓质分离,分别进行提取后, 再测定磷酸胆碱的含量,但未检测到磷酸胆碱,推测可能与所采用的方法的灵敏度较低有关。
此外,本研究还发现了多种有机胺、糖、维生素、肉碱和有机酸类小分子代谢物在肾脏的不同组织区域呈特征性分布(图3),推测它们在肾脏细胞保护、渗透压的调节、神经递质代谢调控等方面具有重要作用[19~22]。例如,本研究发现硫胺素(维生素B1)主要分布在肾脏近髓皮质部分,与乙酰胆碱具有相似的分布特征。有研究表明,维生素B1是乙酰胆碱代谢的重要调控因子,可抑制胆碱酯酶的活性,维生素B1的缺乏可导致此酶活性升高和乙酰胆碱的分解代谢增加,而补充维生素则可以提高乙酰胆碱的水平[22]。此外,维生素B1在体内可转变成硫胺素焦磷酸,参与糖在体内的代谢。因此,维生素B1缺乏时,可导致糖代谢紊乱;而增加维生素B1的摄入可改善糖尿病导致的肾脏损伤,具有逆转早期糖尿病、肾病的作用[23]。

图3 有机胺、糖、维生素、肉碱和有机酸类代谢物在大鼠肾组织中的分布: (A) 肌酐,(B) N-甲基尼克酰胺,(C) 乙酰胆碱,(D) 精氨酸-羟基天冬氨酸酸或羟基精氨酸-天冬氨酸酸,(E) 甘油磷脂酰乙醇胺,(F) 葡萄糖,(G) 山梨醇,(H) 1-(3-甲基丁酰基)-6-芹菜糖基葡萄糖,(I) 甘油磷酸,(J) 柠檬酸钠,(K) 硫胺素,(L) 牛磺酸,(M) 泛酸,(N) 肉碱,(O) 硬脂酰基肉碱。Fig.3 Distribution of metabolites of organic amine, sugar, vitamins, peptides and organic acids in rat kidney tissues: (A) Creatinine, (B) N-methylnicotinamide, (C) Acetylspermidine, (D) Lys-Asp-OH or Asp-Lys-OH, (E) Glycerylphosphorylethanolamine, (F) Glucose, (G) Sorbitol, (H) 1-(3-Methylbutanoyl)-6-apiosylglucose, (I) Glycerol phosphate, (J) Sodium citrate, (K) Thiamine, (L) Taurine, (M) Pantothenic Acid, (N) Carnitine, (O) Stearoylcarnitine.
图4是脂类代谢物在肾脏组织中的分布特征图。脂类代谢物具有许多重要的生物学功能,参与调节多种生命活动过程,包括能量转换、物质运输、信息识别与传递、细胞发育和分化、细胞凋亡等[24,25]。本研究建立的AFAI-MSI质谱成像方法可检测到溶血磷脂酰胆碱、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、甘油磷脂酸、鞘磷脂、神经酰胺、甘油单酯、固醇酯等脂类代谢物。这些脂类代谢物在肾脏组织中呈不均匀分布,可能与肾脏组织不同区域具有不同的结构和功能有关。
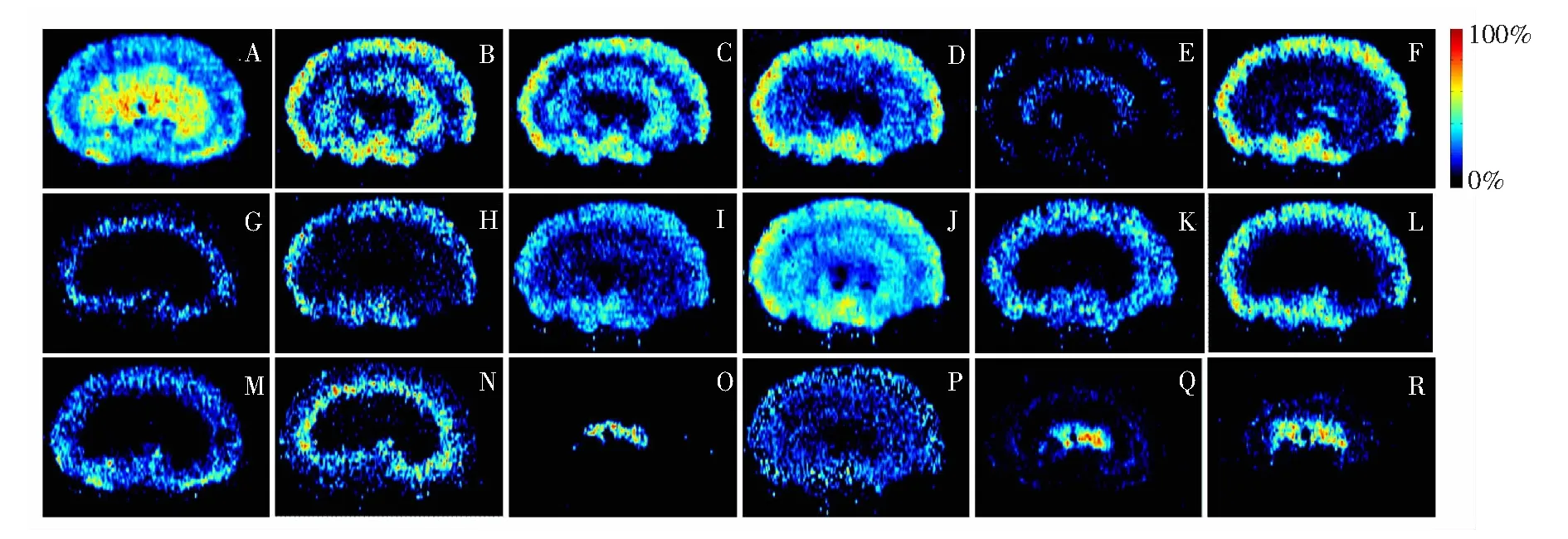
图4 脂类代谢物在大鼠肾组织中的分布: (A) LysoPC (16∶0),(B) PC(18∶1),C∶ PC(18∶2),(D) PC(20∶4),(E) PC(38∶5),(F) PC(40∶8),(G) PE(38∶5),H∶ PG(22∶4),(I) PG(34∶1),(J) PG(36∶2),(K) PA(30∶0),(L) SM(34∶1),M∶ SM(34∶2),(N) SM(42∶3),(O) Cer(44∶1), (P): LacCer(d18∶1/14∶0), (Q) MG(18∶0),(R) CE(20∶4)Fig.4 Distribution of lipids in rat kidney tissues: (A) LysoPC (16∶0), (B) PC(18∶1), (C) PC(18∶2), (D) PC(20∶4), (E) PC(38∶5), (F) PC(40∶8), (G) PE(38∶5), (H) PG(22∶4), (I) PG(34∶1), (J) PG(36∶2), (K) PA(30∶0), (L) SM(34∶1), (M) SM(34∶2), (N) SM(42∶3), (O) Cer(44∶1), (P) LacCer(d18∶1/14∶0), (Q) MG(18∶0), (R) CE(20∶4)
4 结 论
建立了基于空气动力辅助离子化-高分辨质谱技术检测大鼠肾脏组织中小分子代谢物分布的质谱成像分析方法。本方法无需样品预处理, 灵敏度高,代谢物覆盖范围宽,可直接获取多种类型、含量差异达4个数量级的内源性代谢物的结构、含量及空间分布信息。因此,本方法有望应用于肾脏中内源性代谢物的原位表征和代谢调控机制研究,为探究代谢物在糖尿病、肾病、慢性肾炎、急性肾衰等多种急慢性肾病中的作用等提供一种新的分析方法。
1 Caprioli R M, Farmer T B, Gile J.Anal.Chem.,1997, 69( 23): 4751-4760
2 LIU Hui, CHEN Guo-Qiang, WANG Yan-Ying, LI Zhi-Li.ChineseJ.Anal.Chem.,2011, 39(1): 87-90
刘 辉, 陈国强, 王艳英, 李智立. 分析化学,2011, 39(1): 87-90
3 Weiss R H, Kim K.Nat.Rev.Nephrol.,2012, 8(1): 22-33
4 Zhao Y Y.Clin.Chim.Acta,2013, 422: 59-69
5 Lalowski M, Magni F, Mainini V, Gotsopoulos A, Soliymani R, Chinello C, Baumann M.Nephrol.Dial.Transplant.,2013, 28(7): 1648-1656
6 LUO Zhi-Gang, HE Jiu-Ming, LIU Yue-Ying, LI Tie-Gang, HE Jing-Jing, ZHANG Si-Chun, ZHANG Xin-Rong, ABLIZ Zeper.Sci.Chin.Chem.B,2014, 44(5): 795-800
罗志刚, 贺玖明, 刘月英, 李铁刚, 何菁菁, 张四纯, 张新荣, 再帕尔·阿不力孜. 中国科学: 化学,2014, 44(5): 795-800
7 Cornett D S, Reyzer M L, Chaurand P, Caprioli R M.Nat.Methods,2007, 4(10): 828-833
8 PEI Xing-Li, HUANG Yu-Yu, GONG Can, XU Xu.ChineseJ.Anal.Chem.,2017, 45(8): 1155-1164
裴兴丽, 黄煜宇, 龚 灿, 许 旭. 分析化学,2017, 45(8): 1155-1164
9 Takáts Z, Wiseman J M, Gologan B, Cooks R G.Science,2004, 306: 471-473
10 Wu C, Dill A L, Eberlin L S, Cooks R G, Ifa D R.MassSpectrum.Rev.,2013, 32(3): 218-243
11 Liu H, Li W, He Q,Xue J, Wang J, Xiong C, Pu X, Nie Z.Sci.Rep.,2017, 7: 41954
12 Dill A L, Eberlin L S, Zheng C, Costa A B, Ifa D R, Cheng L, Masterson T A, Koch M O, Vitek O, Cooks R G.Anal.Bioanal.Chem.,2010, 398(7-8): 2969-2978
13 Luo Z, He J, Chen Y, He J, Gong T, Tang F, Wang X, Zhang R, Huang L, Zhang L, Lv H, Ma S, Fu Z, Chen X, Yu S, Abliz Z.Anal.Chem.,2013, 85(5): 2977-2982
14 He J, Luo Z, Huang L, He J, Chen Y, Rong X, Jia S, Tang F, Wang X, Zhang R, Zhang J, Shi J, Abliz Z,Anal.Chem.,2015, 87(10): 5372-5379
15 Song X, Luo Z, Li X, Li T, Wang Z, Sun C, Huang L, Xie P, Liu X, He J, Abliz Z.Anal.Chem.,2017, 89(12): 6318-6323
16 Li T, He J, Mao X, Bi Y, Luo Z, Guo C, Tang F, Xu X, Wang X, Wang M, Chen J, Abliz Z.Sci.Rep.,2015, 5: 14089
17 Corbin K D, Zeisel H S.Curr.Opin.Gastroenterol.,2012, 28(2): 159-165
18 Guder W G, Ross B D.KidneyInt.,1984, 26(2): 101-111
19 Bagnasco S, Balaban R, Fales H M, Yang Y M, Burg M.J.Biol.Chem.,1986, 261(13): 5872-5877
20 Sizeland P C, Chambers S T, Lever M, Bason L M, Robson R A.KidneyInt.,1993, 43(2): 448-453
21 Liu Y, Yan S, Ji C, Dai W, Hu W, Zhang W, Mei C.KidneyBloodPressRes.,2012, 35(5): 373-381
22 Eder L, Hirt L, Dunant Y.Nature,1976, 264(5582): 186-188
23 Karachalias N, Babaei-Jadidi R, Rabbani N, Thornalley P J.Diabetologia,2010, 53(7): 1506-1516
24 di Paolo G, de Camilli P,Nature,2006, 443(7112): 651-657
25 WANG Zhong-Hua, CHEN Yan-Hua, XU Jing, CHEN Huili, ZHOU Xia, XIAO Xin-Hua, PING Fan, HE Jiu-Ming, ABLIZ Zeper, ZHANG Rui-Ping.ChineseJ.Anal.Chem.,2017, 45(5): 674-680
王中华, 陈艳华, 徐 婧, 陈蕙莉, 周 霞, 肖新华, 平 凡, 贺玖明, 再帕尔·阿不力孜, 张瑞萍. 分析化学,2017, 45(5): 674-680

