基于响应面优化的褶牡蛎中金属硫蛋白提取工艺研究
姚冬儿,杨慧琳,斯兴开,张宾,孙继鹏
(1.浙江海洋大学食品与医药学院,浙江省海产品健康危害因素关键技术研究重点实验室,浙江舟山 316022)(2.国家海洋局第三海洋研究所,福建厦门 361005)
金属硫蛋白(Metallothionein,MT)化学名为金属硫组氨酸三甲基内盐,其是一类低分子质量、高巯基含量、能结合金属离子,且具有独特功能的蛋白质。MT富含半胱氨酸(20~30%)且不含组氨酸和芳香族氨基酸等,其广泛存在于多种动物、植物、微生物体内,其在个体生长发育及环境适应等方面发挥着重要作用[1]。机体内MT可被重金属离子、细胞毒性药物、有机化学药物、细胞因子、荷尔蒙激素及应激刺激等多因素诱导而合成。研究表明,MT可表现出显著的重金属的解毒和调节[2]、参与细胞调节与免疫代谢[3]、防辐射[4]、清除生物体内自由基[5]等多种生物活性,已广泛应用于农业、医药、保健、生物工程和环境保护等各个领域。
近年来,MT的生物功能已被越来越多的学者们所认识和开发,对其结构、特性、基因调控及生物学功能的研究也日趋深入,但对其应用与产品开发仍有诸多限制和不足[6]。纯度较高的MT在市场上的价格仍旧居高不下,其主要原因在于未能找到一种合理高效的提纯技术,且动植物提纯量少的缺点仍旧严重制约着MT的工业化发展[7]。目前,关于MT的提取及分离纯化已有较多介绍,诸如加热除杂蛋白、缓冲液匀浆离心法、凝胶过滤、离子交换及多种层析结合法等,然而其分离纯化方法仍有待进一步提高,仍存在如杂蛋白干扰严重、MT提取率不高等问题[8,9]。本研究以褶牡蛎中金属硫蛋白(MT)为对象,通过 Cd2+诱导褶牡蛎体内产生MT,优化牡蛎体内MT提取条件,以期获得MT制备的最佳工艺,为天然高效的海洋源MT产品开发与应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
褶牡蛎(Crassostrea plicatul)购自浙江省舟山市东河水产批发市场,壳长8.4~8.8 cm,壳高3.0~3.7 cm,体重 22~28 g。氯化镉、三羟甲基氨基甲烷、磷酸二氢钾、磷酸氢二钾、氢氧化钠、硼酸及EDTA等试剂,均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
XHF-D型内切式匀浆机,宁波新芝生物科技股份有限公司;Milli-Q型超纯水仪,美国Millipore公司;DLSB-20/20型低温冷却液循环泵,郑州长城科工贸有限公司;RC6 Plus型高速冷冻离心机,Thermo Scientific公司;DSHZ-300型恒温振荡器,江苏太仓市实验设备厂等。
1.3 实验方法
1.3.1 牡蛎体内MT的诱导
选取生长活力良好的褶牡蛎个体,进行海水暂养驯化2 d,暂养期间不投喂饵料。将暂养牡蛎放入塑料养殖箱中,60只/箱,每只养殖箱注入含0.5 mg/L Cd2+的净化海水 40 L(盐度 27±1,pH 8.0±0.2,水温18±1 ℃);保持连续充氧,但不投喂饵料;每隔24 h更换含相同Cd2+浓度海水1次。采用Cd2+诱导10 d后,取出牡蛎个体,在0~4 ℃条件下,将牡蛎进行解剖,获得牡蛎肉置于-80 ℃条件下进行贮存备用。
1.3.2 牡蛎MT提取优化
1.3.2.1 单因素实验
(1)物料比对 MT提取效果影响:取牡蛎组织约 5 g,置于 50 mL锥形瓶中,按牡蛎组织:缓冲液(g/mL)比例分别为1:2、1:3、1:4、1:6、1:8和1:10,加入0.25 mol/L、pH 8.5 Tris-HCl缓冲液,45 ℃恒温水浴振荡提取2 h后,将混合体系以10000 r/min离心20 min(4 ℃),收集上清液测定MT含量。
(2)提取温度对 MT提取效果影响:取牡蛎组织约5 g,置于50 mL锥形瓶中,按牡蛎组织:缓冲液(g/mL)比例为1:4,加入0.25 mol/L、pH 8.5 Tris-HCl缓冲液,分别于20、30、40、50、60和70 ℃条件下,45 ℃恒温水浴振荡提取2 h后,将混合体系以10000 r/min离心20 min(4 ℃),收集上清液测定MT含量。
(3)提取pH对MT提取效果影响:取牡蛎组织约 5 g,置于 50 mL锥形瓶中,按牡蛎组织:缓冲液(g/mL)比例为1:4,分别加入pH为3、4、5、6、7、8、9和10、0.25 mol/L Tris-HCl缓冲液,45 ℃恒温水浴振荡提取2 h后,将混合体系以10000 r/min离心20 min(4 ℃),收集上清液测定MT含量。
(4)提取液浓度对 MT提取效果影响:取牡蛎组织约5 g,置于50 mL锥形瓶中,按牡蛎组织:缓冲液(g/mL)比例为1:4,加入pH 8.5、浓度分别为0.01、0.05、0.10、0.20、0.30和0.50 mol/L Tris-HCl缓冲液,45 ℃恒温水浴振荡提取2 h后,将混合体系以10000 r/min离心20 min(4 ℃),收集上清液测定MT含量。
(5)提取时间对 MT提取效果影响:取牡蛎组织约5 g,置于50 mL锥形瓶中,按牡蛎组织:缓冲液(g/mL)比例为1:4,加入0.25 mol/L、pH 8.5 Tris-HCl缓冲液,45 ℃恒温水浴振荡提取,提取时间分别为0.5、1.0、1.5、2.0、3.0、4.0、5.0和6.0 h后,将混合体系以10000 r/min离心20 min(4 ℃),收集上清液测定MT含量。
1.3.2.2 响应面优化设计
在以上单因素实验基础上,采用Design-Expert 7.0软件中Box-Behnken中心组合设计原理进行响应面实验设计,具体选取物料比、提取温度、缓冲液pH及浓度四个因素,进行提取工艺优化研究。
1.3.3 牡蛎MT含量测定
取 20 μL MT 上清液,加入 3 μL 20 %(m/V)TCEP溶液、10 μL 1 mg/mL SBD-F 溶液和 75 μL、pH 10.5反应缓冲液(含1 mol/L硼酸、30 mmol/L EDTA和0.8 mol/L KOH),混匀后50 ℃水浴反应30 min,加入10 μL、4 mol/L HCl溶液终止反应。将混合体系采用20 mmol/L、pH 7.5定容缓冲液定容至1 mL,混合均匀溶液经0.22 μm水系膜后进行HPLC分析。色谱流动相:乙腈:磷酸缓冲液(25 mmol/L,pH 7.5):甲醇体系=18:80:2;色谱柱:ODS-BP(Sinochrom,4.6 mm×250 mm,5 μm)C18柱;进样量:40 μL;洗脱时间:20 min;流速:0.5 mL/min;柱温:25 ℃;激发波长380 nm,发射波长510 nm;标准品:兔肝MT;MT保留时间:7.3~7.7 min。
1.3.4 数据统计与分析
采用origin 8.0、SPSS及Design Expert 8.0进行处理,实验数据均为3次平行实验的平均值,结果表示为平均值±标准差。
2 结果与讨论
2.1 单因素结果及分析
2.1.1 物料比对牡蛎MT提取效果的影响

图1 物料比对牡蛎MT提取效果的影响Fig.1 Effects of material ratio on the extraction of MT from oyster
提取液采用缓冲液的主要作用是为促进可溶蛋白溶出及为其提供相对稳定的环境,防止其变性发生。研究表明,水产动物体内MT分子量较小,采用与生理体液相容性较好、性质温度的Tris-HCl缓冲液进行浸提,可有效将MT从牡蛎组织提取出来[10]。由图1结果可知,牡蛎组织与提取缓冲液的物料比在1:2~1:6范围内,提取MT含量随缓冲液加入体积的增加而逐渐上升;当物料比为1:6时,MT提取含量达到最大值为0.184 mg/g;继续增加提取液的加入量,MT提取量趋于平缓,未出现显著提高(p>0.05)。随着缓冲液用量增大,其与已破碎的组织接触更加充分,从而使得更多的MT释放到液相中。但是,过多缓冲液的稀释作用必然会降低提取液中的浓度,不便于测定和使用,同时还会造成提取成本的增加。因此,初步确定牡蛎组织与提取缓冲液的物料比为1:4~1:6。
2.1.2 提取温度对牡蛎MT提取效果的影响

图2 提取温度对牡蛎MT提取效果的影响Fig.2 Effects of temperature on the extraction of MT from oyster
提取温度是影响蛋白质稳定的最重要因素,一般温度越高,蛋白质的稳定性越低。MT由于其特殊的坚固构象,而具有较强的热稳定性,因此短时间的热提取处理不会影响牡蛎MT的生物活性[11]。由图2可知,提取温度在20~70 ℃范围内,MT提取量呈先上升后下降的趋势。当提取温度较低时(20~30 ℃),MT提取效果较佳,30 ℃时MT提取量达最大值0.185 mg/g;当超过30 ℃后,MT提取量有所降低,可能是因为较高温使部分组织蛋白变性而影响MT提取量所致。励建荣等[12]也认为,采用较高温度(75 ℃)除杂蛋白的方法制得MT粗制品,也存在一定弊端,其加热时间不太明确,对提取MT纯度及后续纯化带来不便。因此,初步确定提取温度为30 ℃。
2.1.3 提取液pH对牡蛎MT提取效果的影响
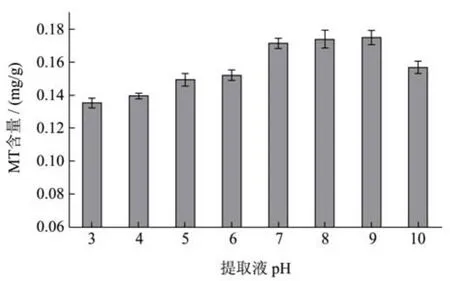
图3 提取液pH对牡蛎MT提取效果的影响Fig.3 Effects of pH on the extraction of MT from oyster
由图3结果发现,随着提取液pH值的变化,MT提取量呈先增加后平缓再降低的趋势;当pH在3~9之间,MT提取量随pH提高而逐渐增加;当pH=9时,MT含量达到最高为0.174 mg/g;而当pH>9时,MT提取量逐渐下降,故初步确定最佳提取液pH值为9。MT等电点在3.5~6.0范围内[13],因此当提取缓冲液pH在3~6时,MT溶解减少而发生聚集,因此所获得的MT提取量较低;提取缓冲液pH在8~9时,偏离MT的等电点,致使获得MT提取量显著提高。
2.1.4 提取缓冲液浓度对牡蛎MT提取效果的影响
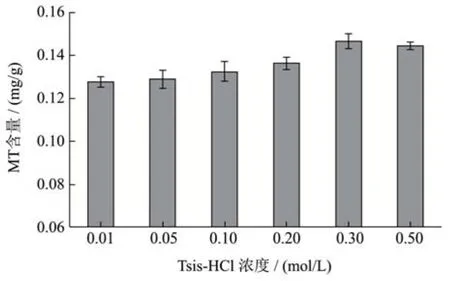
图4 提取缓冲液浓度对牡蛎MT提取效果的影响Fig.4 Effects of buffer concentrations on the extraction of MT from oyster
提取缓冲液的离子强度,对MT提取量也具有重要影响。随着提取液浓度的增高,溶液的离子强度随之增大,而较高的离子强度可能会造成提取蛋白质的沉淀发生[14]。由图4结果可知,在提取缓冲液浓度为0.01~0.30 mol/L范围内,MT提取量逐渐上升,在0.30 mol/L时达最大值0.146 mg/g;在0.30~0.50 mol/L范围内,MT提取率呈平缓稍下降趋势,因此初步确定最佳缓冲液浓度为0.30 mol/L。
2.1.5 提取时间对MT提取效果的影响

图5 提取时间对牡蛎MT提取效果的影响Fig.5 Effects of time on the extraction of MT from oyster
如图5所示,提取时间对MT提取含量的影响相对较小,在0.5~6.0 h提取时间范围内,MT提取量变化呈平缓趋势;在提取2.0 h时MT含量达到稳定值0.214 mg/g,确定最佳提取时间为2 h。
2.2 响应面实验结果及分析
2.2.1 响应面实验结果
根据单因素实验结果,选取对MT提取量具有显著影响的4因素,即提取缓冲液pH、提取时间、物料比和提取缓冲液浓度,进行4因素3水平Box-Behnken中心组合实验设计,以MT提取量为相应值,进行29组实验,包括24组析因实验及5组中心实验用以估计误差,结果如表1所示。

表1 中心组合实验设计与结果Table 1 Experimental design and results of center combination

?
2.2.2 MT提取量响应面分析
利用Design Expert 7.0软件,将表1中实验数据进行多元方程回归拟合,建立MT提取量与各因素变量的二次多元回归模型:
Y=0.23-0.012A-4.667E-003B-4.667-003C-0.014D-0.01AB+4.75E-003AC+4.25-003AD+2.5E-004BC-7.5E-003BD+8E-003CD-0.035A2-0.021B2-0.022C2-0.011D2
由表2方差分析可知,模型F=10.54,p<0.0001,说明响应面回归模型极其显著,具有统计学意义。对残差项各数据进行分析,失拟项 F=5.39,Pr=0.0594>0.05,说明方程实际拟合中非正常误差所占比例小,拟合度较高。决定系数R2=0.9133,说明该模型能解释91.33%响应值变化,因而模型拟合程度良好,实验误差小,适合于牡蛎MT提取量的分析和预测。
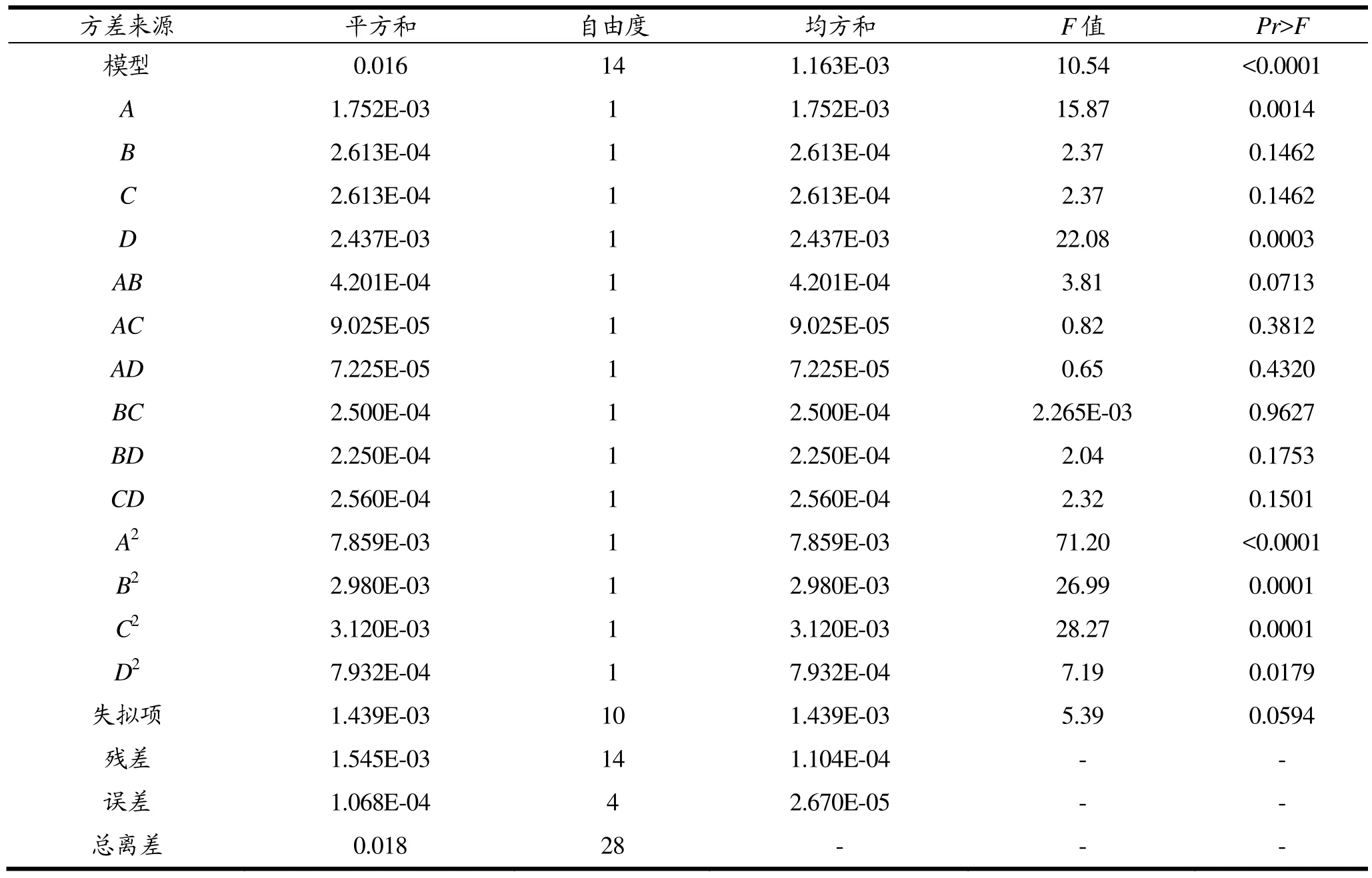
表2 提取含量二次多项模型方差分析表Table 2 The variance analysis table of quadratic polynomial model of extraction content
由回归方程的系数显著性检验可知,因素A和因素D的P值均小于0.05,说明缓冲液pH值和物料比对牡蛎MT提取量影响极其显著。平方项A2、B2、C2、D2也均小于0.05,说明A2、B2、C2和D2对MT提取量均有显著影响。由表3结果可知,信噪比Adeq Precision值较高(11.0160),说明该模型可预测。通过比较回归方程中一次项系数可知,影响MT提取量的影响因素主次为D>A>B=C,即物料比>提取pH值>提取温度=缓冲液浓度。
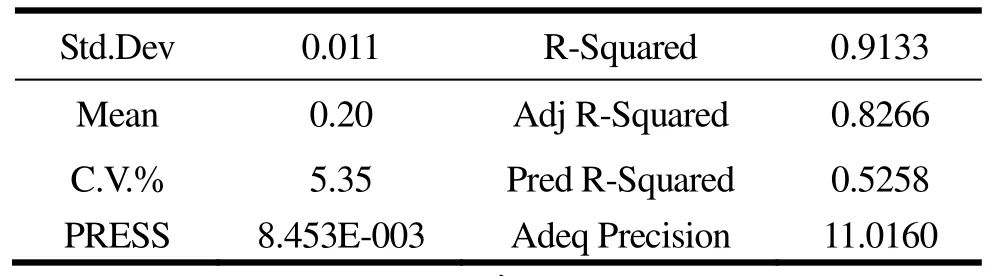
表3 变异系数Table 3 Coefficient of variation
2.2.3 交互因子效应分析
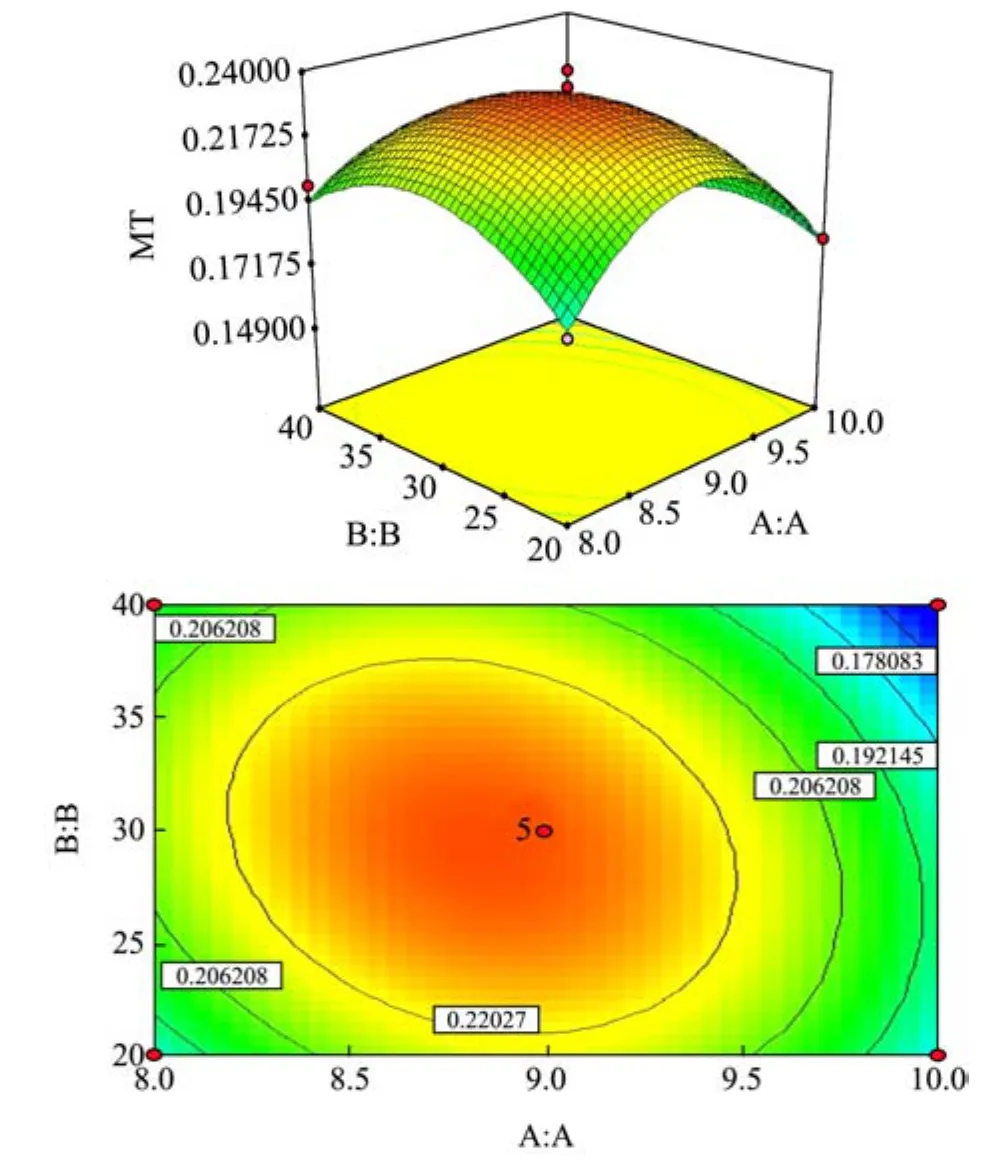
图6 提取液pH和温度对MT提取量的影响Fig.6 Effects of pH and temperature on the extraction of MT from oyster
按照所得二元二次回归方程对两两因素进行运算,获得交互因子响应面及等高线图,结果如图6~11所示。处理条件的改变对响应值的影响,可通过响应曲面的坡度陡峭或者平缓体现出来。等高线形状可反映出交互作用强弱,椭圆形表示两因素交互作用较强,圆形则表示两因素交互作用较弱;等高线排列越密集,说明因素变化对MT提取量影响越大。在同一椭圆形区域内,牡蛎MT提取量相同,在椭圆形中心点即为MT提取量的最高点,由中心向边缘逐渐减少。由结果可知,所有曲面图都呈良好的抛物线形状,说明各因素的交互作用明显,而各曲面图均开口朝下,说明实验结果Y(MT提取量)在实验区域内有最大值。
(1)提取液pH和温度对MT提取量的影响
由图6结果可知,随着提取液pH值增加和提取温度升高,MT提取量呈先上升后下降趋势,表明适当增大提取pH值及温度,可一定程度的提高MT提取量。在提取液pH值(A)与提取温度(B)交互作用的等高线中,由于pH值等高线疏密程度比提取温度等高线密度大,故提取液pH值对响应值峰值的影响比提取温度大。因此,当提取液pH为8.5~9.0、提取温度为28~32 ℃时,可获最佳MT提取效果。
(2)提取液pH和缓冲液浓度对MT提取量的影响

图7 提取液pH和缓冲液浓度对MT提取量的影响Fig.7 Effects of pH and buffer concentration on the extraction of MT
由图7可知,随着提取液pH值和缓冲液浓度增加,MT提取量也均呈先上升后下降趋势。从构成等高线可看出,沿A轴移动过程中,其等高线比沿C轴的等高线密度更大,说明在pH值(A)和缓冲液浓度(C)的交互作用中,提取液pH值对MT提取效果影响较缓冲液浓度影响更大。因此,当pH为8.5~9.0、缓冲液浓度为0.25~0.30 mol/L时,可获最佳MT提取效果。
(3)提取液pH和物料比对MT提取量的影响

图8 提取液pH和物料比对MT提取量的影响Fig.8 Effects of pH and material ratio on the extraction of MT

图9 提取液温度和缓冲液浓度对MT提取量的影响Fig.9 Effects of temperature and buffer concentration on the extraction of MT
由图8可知,随着提取液pH值和物料比的增加,MT提取量呈现先上升后下降的趋势;而随物料比的增加或减小,MT提取量变化程度相对平缓。在 pH值(A)与物料比(D)交互作用的等高线中,由于pH值对等高线疏密程度影响比物料比的影响更大些,因此提取液pH值的影响作用较物料比大。当pH为8.5~9.0、料物比为3.5~4.0时,能使MT提取效果最佳。
(4)提取温度和缓冲液浓度对 MT提取量的影响
由图9可知,随着提取温度和缓冲液浓度增加,MT提取量呈先增加后减小趋势。在提取温度(B)与缓冲液浓度(C)交互作用等高线中,沿B轴等高线与沿C轴等高线密度差别不大,可知提取温度与缓冲液浓度对响应值峰值的影响相当。当提取温度为28~32 ℃、缓冲液浓度为0.25~0.30 mol/L时,可获最佳MT提取效果。
(5)提取温度和物料比对MT提取量的影响

图10 提取温度和物料比对MT提取量的影响Fig.10 Effects of temperature and material ratio on the extraction of MT
由图10可知,随提取温度和物料比的升高,MT提取量呈现先增加后减小趋势;与图8结果类似,随物料比增加或减小,MT提取量变化程度相对平缓。在提取温度(B)和物料比(D)交互作用中,温度对等高线疏密程度影响明显大于物料比,说明提取温度影响作用较物料比大。当提取温度为28~32 ℃、料物比为3.5~4.0时,可获最佳MT提取效果。
(6)缓冲液浓度和物料比对MT提取量的影响
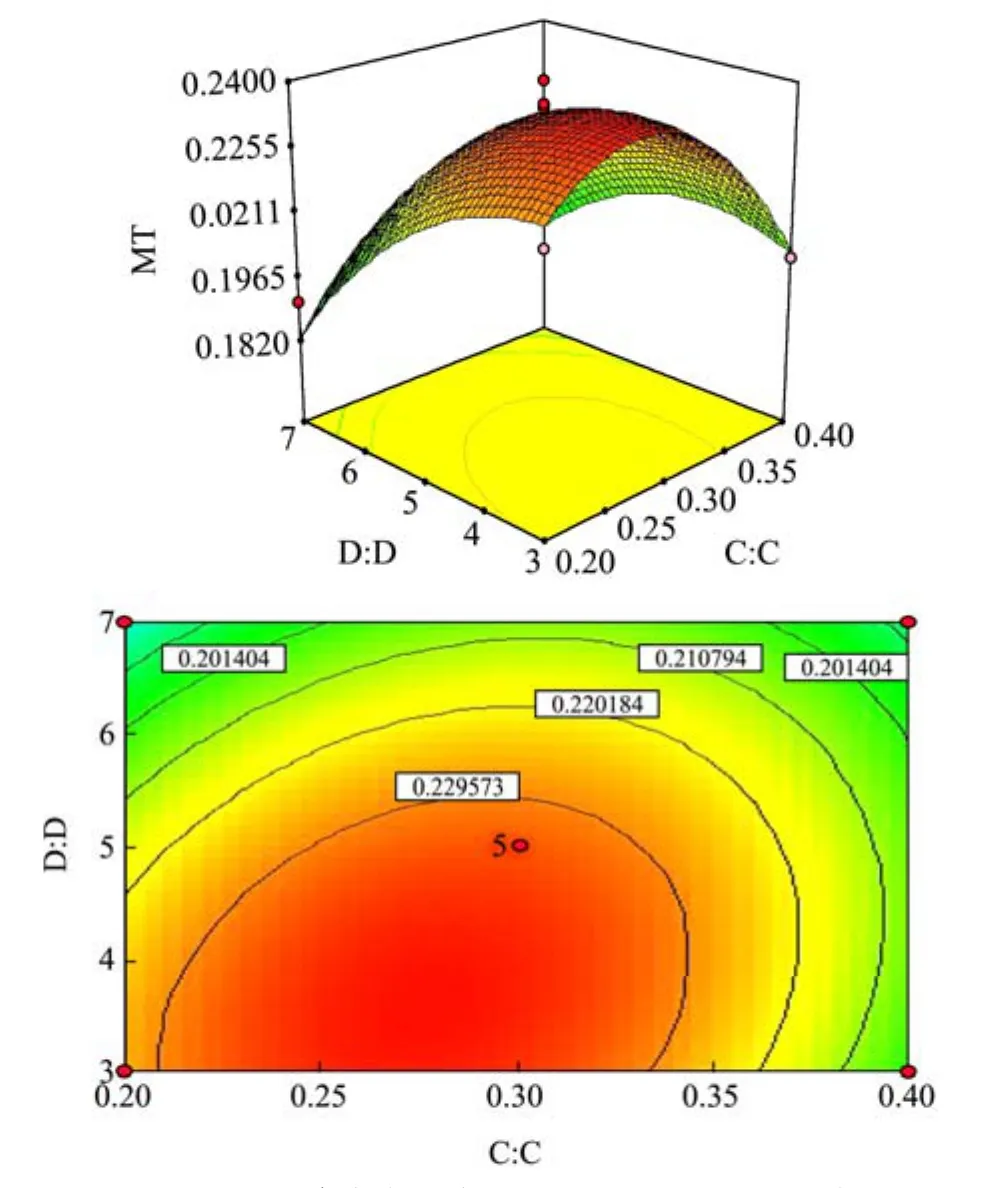
图11 缓冲液浓度和物料比对MT提取量的影响Fig.11 Effects of buffer concentration and material ratio on the extraction of MT
图11曲面图与等高线分布图,和图8结果大体相同,即提取缓冲液浓度的变化对响应值的影响幅度明显,即在提取缓冲液浓度(C)和物料比(D)交互作用中,缓冲液浓度的影响作用较物料比更大。当缓冲液浓度为0.25~0.30 mol/L、料物比为3.5~4时,可获最佳MT提取效果。
2.2.4 最佳提取工艺验证
利用Design-Expert 7.0软件分析实验数据,确定最优提取条件为:提取液pH 9.0,提取温度30 ℃,提取缓冲液浓度0.25 mol/L,物料比为1:4;考虑到实际操作便利,确定提取时间为2 h。在此条件下,进行3次平行实验,MT提取量平均值为0.221 mg/g,模型对MT提取量的理论最优值为0.239 mg/g,两者之间差值为0.018 mg/g,误差较小,两者吻合性较好,说明模型可行。
3 结论
以牡蛎组织为原料,利用单因素实验、中心组合Box-Behnken实验设计及响应面分析法,对牡蛎中MT的提取制备工艺进行了优化,获得了最佳制备参数为:牡蛎组织与提取液间的比例为1:4,提取液pH 9.0,提取温度30 ℃,缓冲液浓度0.25 mol/L,提取时间2 h。在此参数条件下,MT提取量为0.221 mg/g,该结果与建立模型的预测值基本相符。后续将对牡蛎MT进一步的纯化及应用开展深入研究。
[1]吕新芳,毛伟腾,滑朝阳,等.海洋无脊椎动物金属硫蛋白研究进展[J].海洋通报,2015,3:241-246 LV Xin-fang, MAO Wei-teng, HUA Chao-yang, et al. A review on the research of metallothionein in marine invertebrates [J]. Marine Science Buletin, 2015, 3: 241-246
[2]Zhang B, Shi Z R, Wang X L, et al. Depuration of cadmium from blue mussel (Mytilus edulis) by hydrolysis peptides and chelating metal elements [J]. Food Research International,2015, 73(11): 162-168
[3]Thirumoorthy N, Sunder A S, Kumar K M, et al. A review of metallothionein isoforms and their role in pathophysiology[J]. World Journal of Surgical Oncology, 2011, 9: 54
[4]Lu C, Satoh M, Tohyama C, et al. Metallothionein in radiation exposure: its induction and protective role [J].Toxicology, 1999, 132(2-3): 85-98
[5]王颖,王欣卉,徐炳政,等.金属硫蛋白体内抗氧化功能研究进展[J].食品工业科技,2016,37(10):377-380 WANG Ying, WANG Xin-hui, XU Bing-zheng, et al.Research progress of metallothionein function in vivo antioxidant [J]. Science and Technology of Food Industry,2016, 37(10): 377-380
[6]Shinichiro T. Molecular functions of metallothionein and its role in hematological malignancies [J]. Journal of Hematology & Oncology, 2012, 5: 41
[7]孟范平,肖静,赵顺顺,等.海洋动物金属硫蛋白的提取与分析技术研究进展[J].中国海洋大学学报,2010,40(6):41-46 MENG Fan-ping, XIAO Jing, ZHAO Shun-shun, et al.Research progress on the extraction and analysis of metallothioneins in marine animals [J]. Periodical of Ocean University of China, 2010, 40(6): 41-46
[8]Costa P M, Repolho T, Caeiro S, et al. Modelling metallothionein induction in the liver of Sparus aurata,exposed to metal-contaminated sediments [J]. Ecotoxicology& Environmental Safety, 2008, 71(1): 117-124
[9]陈洁,韩亮,李国跃,等.金属硫蛋白的分离纯化技术及功能研究进展[J].广东药学院学报,2013,29(5):565-569 CHEN Jie, HAN Liang, LI Guo-yue, et al. Progress on the separation and purification technology and function of metallothionein [J]. Journal of Guangdong Pharmaceutical University, 2013, 29(5): 565-569
[10]Bebianno M J, Langston W J. Metallothionein induction in Mytilus edulis, exposed to cadmium [J]. Marine Biology,1991, 108(1): 91-96
[11]Khati W, Ouali K, Mouneyrac C, et al. Metallothioneins in aquatic invertebrates: their role in metal detoxification and their use in biomonitoring [J]. Energy Procedia, 2012, 18(1):784-794
[12]励建荣,宣伟,李学鹏,等.金属硫蛋白的研究进展[J].食品科学,2010,31(17):392-395 LI Jian-rong, XUAN Wei, LI Xue-peng, et al. Research progress in metallothionein [J]. Food Science, 2010, 31(17):392-395
[13]Romero-Isart N, Vasák M. Advances in the structure and chemistry of metallothioneins [J]. Journal of Inorganic Biochemistry, 2002, 88(3-4): 388-396
[14]肖静.海洋双壳类动物金属硫蛋白的提取与分析技术研究[D].青岛:中国海洋大学,2010 XIAO Jing. Research on the extraction and ana1ysis of metallothioneins in marine bivalve [D]. Qingdao: Ocean University of China, 2010

