琼脂-牛乳蛋白酸凝胶微流变特征研究
孙 健 牛天娇 常圆圆 罗 洁 张 昊 李 媛
(1.中国农业大学食品科学与营养工程学院, 北京 100083; 2.蒙牛高科乳制品(北京)有限责任公司, 北京 101107;3.哈尔滨工业大学化工与化学学院, 哈尔滨 150001)
0 引言
酸奶在运输过程中的脱冷和颠簸会引起其在销售过程出现乳清析出、凝块不结实等问题,由于多糖的保水性和增稠性,添加适量多糖可以增强酸诱导蛋白凝胶的凝胶强度,有效改善酸奶的乳清析出和凝块不结实问题[1-2]。琼脂是一种亲水性多糖,在高温溶液中为单螺旋结构,随着温度降低,分子转变成双螺旋结构并通过氢键相互连结,形成三维网状结构[3-4]。目前关于琼脂在酸奶中的应用研究多从力学流变和质构仪方面分析琼脂或者含有琼脂的复配稳定剂对牛乳发酵形成凝胶过程的影响[5-6],尚未有琼脂对酸奶整个发酵和冷却过程的研究。
微流变学是通过追踪体系中粒子运动来表征样品的黏弹性变化,可在不破坏样品的前提下研究样品流变特性,其灵敏度高于机械流变学,现其已成功用于研究凝乳酶诱导的酪蛋白凝胶流变特性[7-8]。流变动力学可以反映酸奶流变学特性随时间的变化规律,酸奶发酵过程中的流变特性影响酸奶质构,进而影响口感。通过流变动力学对酸奶发酵过程进行描述,可以实现对酸奶产品凝胶强度等的预测,为工业生产提供理论基础。目前,关于酸奶发酵过程流变动力学性质的研究尚未见报道,本文使用微流变测试手段,对琼脂-脱脂乳混合体系的发酵冷却过程进行研究,通过考察不同体系黏弹性随时间的变化关系,建立琼脂-牛乳蛋白混合体系特性发酵流变动力学模型,为琼脂在酸奶中的生产应用提供必要的参考。
1 材料与方法
1.1 材料与仪器
脱脂乳粉(丹麦Arla Food Ingredients公司,蛋白质量分数32.6%),琼脂(青岛利邦达海洋科技有限公司),菌种YO-MIX 387 LYO(丹麦Danisco公司)。
ALC-210型分析天平(德国Acculab公司),DK-8B型电热恒温水浴锅(上海精宏实验设备有限公司),APV-1000型均质机(德国APV公司),SW-CJ-2FD型超净台(苏景集团苏州安泰空气技术有限公司),SKP028型电热恒温培养箱(上海福玛实验设备有限公司),PHMS-410605型 pH计(瑞士Mettler Toledo公司),Rheolaser LAB型微流变仪(法国Formulaction公司)。
1.2 实验方法
1.2.1琼脂-脱脂乳体系制作
称取12 g脱脂奶粉,缓慢加入到88 g蒸馏水中,45℃搅拌30 min后转移至4℃冰箱静置12 h,完成复原乳的制备。取出复原乳,恢复室温(20℃)后置于磁力搅拌器上,中速搅拌。称取一定质量的琼脂,缓慢加入到正在磁力搅拌的烧杯中进行初步分散。将初步分散结束的琼脂-复原乳溶液用保鲜膜封口,置于90℃带水浴锅中,磁力搅拌加热1 h,即溶解完毕,随后将样品冷却至42℃,加入0.004 U的菌种YO-MIX 387LYO,搅拌均匀备用。
1.2.2微流变特性测试
取出配置好的琼脂-脱脂乳溶液20 mL,转移至微流变仪专用样品池中,将样品池插入微流变仪,运行测量程序,分析琼脂-牛乳蛋白酸凝胶的形成过程。温度设置:0~5 h为42℃,5 h时设置为10℃。
1.2.3流变特性和动力学模型参数分析
颗粒的均方位移(MSD)是样品粒子散射轨迹的平均值。MSD曲线可以直接从微流变仪中得到,从MSD曲线可以得到样品相关信息,如弹性因子(EI)、黏性因子(MVI)和晶格尺寸[7]。
1.3 统计分析
实验重复3次,数据结果以“平均值±标准差”的形式表示。利用软件SPSS 21.0进行Duncan’s判断:P<0.05判断为显著性差异;P≥0.05判断为不显著。
2 结果与分析
2.1 琼脂-脱脂乳混合凝胶弹性因子变化
图1为在恒温发酵过程中,没有添加琼脂的脱脂乳样品和添加不同质量分数琼脂的样品凝胶表征结构生成的EI值随时间的变化曲线。EI与凝胶弹性变化一致,EI值越大,凝胶的弹性越强,EI与凝胶的性质(如网格大小、硬度、凝胶化过程的速度、剪切后恢复程度)有关[9]。从图1可以看出,同一样品的EI值在发酵初期(发酵约3 h内)并无明显变化。这说明在发酵初期酪蛋白的结构并无变化,没有酪蛋白和琼脂网络结构形成。有研究表明,在脱脂乳发酵的初级阶段,胶体中的磷酸氢钙由于pH值的逐渐降低开始逐渐溶解,造成酪蛋白胶束融合,酪蛋白离解和重排,这一过程是胶体磷酸钙在凝胶网络中溶液化的过程[10],添加琼脂并没有对这一过程产生影响。
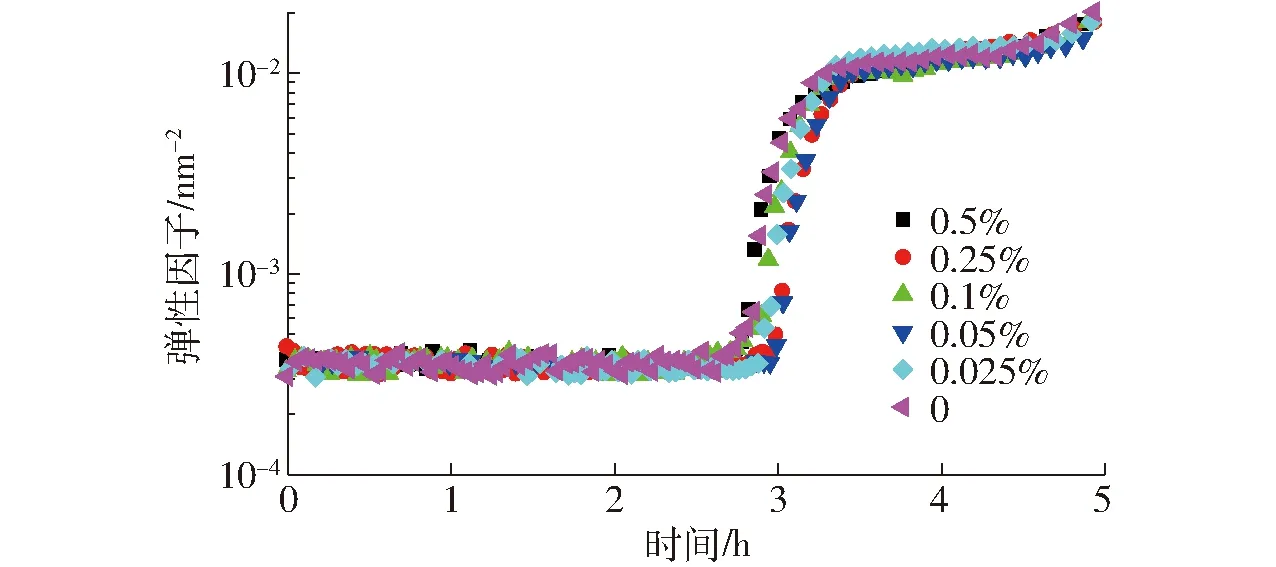
图1 不同质量分数琼脂对酸奶发酵过程弹性因子的影响Fig.1 Effect of agar concentration on EI of yoghurt fermentation
相分离动力学和凝胶动力学将决定混合体系在酸化结束时的流变学状态[11-12]。随着发酵时间的增加(发酵3 h后),体系的pH值继续下降,所有样品EI值开始明显增加。大约在30 min后,凝胶的EI增加速度才逐渐变缓和,不同浓度对于凝胶快速形成阶段的起始和结束时间没有明显影响,由此可以得出在恒温发酵阶段,添加琼脂质量分数在0.025%~0.5%范围内时,琼脂和热脱脂乳中的蛋白质形成互溶体系,两者没有相互作用。
图2为酸奶在冷却放置后熟阶段,EI随时间变化的曲线。在冷却后熟阶段的温度远低于琼脂的凝胶点(此温度下,质量分数为0.025%的琼脂不形成凝胶)。在初期阶段,所有样品表征结构的EI均有所增加,并且凝胶的EI值随添加琼脂浓度的增加而增加,但样品的EI值随后熟时间变化不明显。这表明琼脂(质量分数0.025%~0.5%)能够增强凝胶强度,并且在后熟阶段对样品的结构无明显影响,该结果与ROCHA等[13]研究乳清蛋白-刺槐豆胶凝胶结果相似。
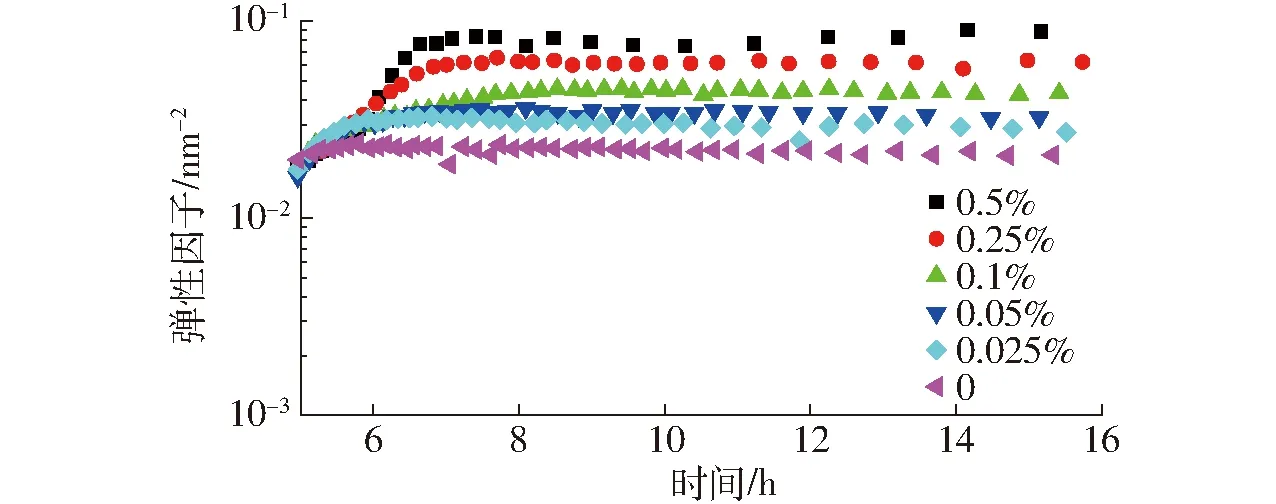
图2 不同质量分数琼脂对酸奶冷藏后熟过程弹性因子的影响Fig.2 Effect of agar concentration on EI of yoghurt cold storage
当琼脂质量分数为0.025%时,琼脂的添加使得样品EI值增加,这是由酪蛋白胶束和琼脂分子之间的排空相互作用所引起的。当两个酪蛋白胶束粒子相互靠近时,它们的排空层开始重叠,聚合物被排除出粒子间的重叠区域,溶液中和粒子重叠区域间聚合物的浓度存在差异,导致了酪蛋白胶束粒子间的有效吸引增强,从而表现为EI增加[14]。当琼脂质量分数在0.05%~0.5%范围内时,琼脂的增加使得样品EI增加,可能有两方面原因:一方面,酪蛋白胶束和琼脂分子之间存在排空相互作用;另一方面,由于琼脂分子在高温是舒展的,随着温度下降,琼脂分子收缩,形成质点,其可以均匀分散在酪蛋白凝胶的网络结构中,随着温度的降低,琼脂质点之间发生相互作用并形成连续的网络结构[15]。
2.2 琼脂-脱脂乳混合凝胶黏性因子变化
由图3可知,发酵前3 h样品的网络结构尚未形成(EI值无明显变化),此时琼脂-脱脂乳混合体系的MVI值显著高于脱脂乳体系,表明琼脂增加了未形成凝胶时样品黏度,这是由于琼脂自身具有增稠性。网络结构形成后各个样品的MVI值无显著性差异,这可能是由于在3 h之后样品开始形成凝胶,样品的MVI值急速增加并且在数值上明显高于琼脂自身的MVI值(P<0.05),此时琼脂的添加引起的MVI变化不明显。
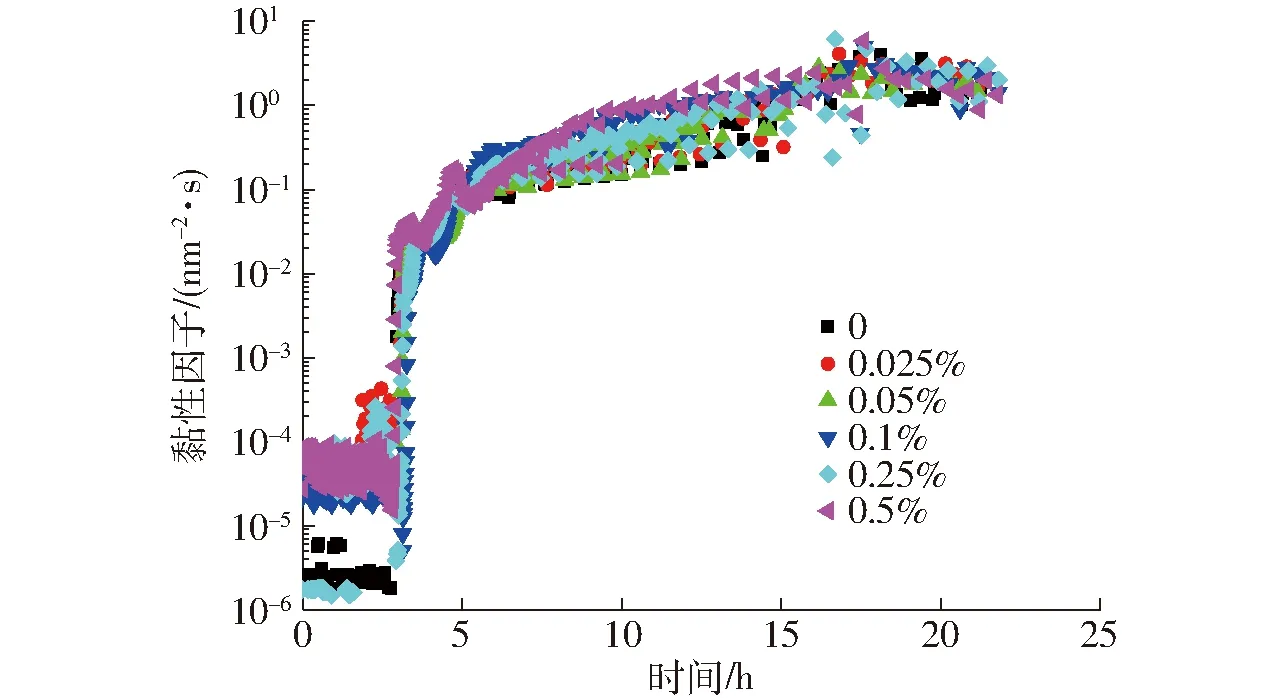
图3 不同质量分数琼脂对酸奶发酵、冷藏后熟过程黏性因子的影响Fig.3 Effect of agar concentration on MVI of yoghurt fermentation and cold storage
2.3 琼脂-脱脂乳混合凝胶网格晶格尺寸的变化
由图4可知,在恒温发酵初期凝胶的晶格尺寸无明显变化,随后随着发酵时间的增加,晶格尺寸急剧减小,晶格尺寸越小,凝胶弹性越大,表明酸凝过程中网络结构形成,并越来越细致紧密[16]。这是由于随着温度的下降,形成的琼脂的质点增多,琼脂之间相互靠近形成分子间氢键,构成琼脂的网络结构。琼脂凝胶结构填充了酪蛋白凝胶的空间,使酪蛋白凝胶的网络孔隙尺寸进一步减小,弹性增加[17]。
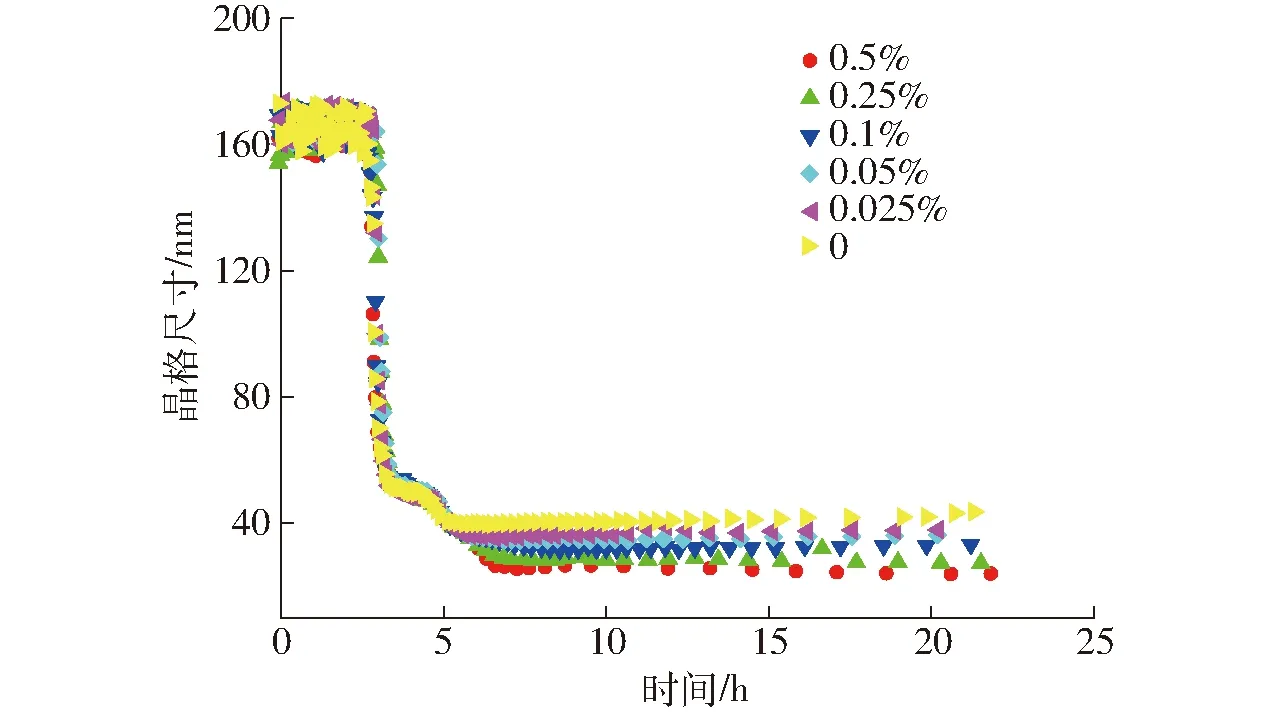
图4 不同质量分数琼脂对酸奶发酵、冷藏后熟过程晶格尺寸的影响Fig.4 Effect of agar concentration on mesh size of yoghurt fermentation and cold storage
2.4 琼脂-脱脂乳混合凝胶动力学分析
酸奶中的酪蛋白和琼脂形成凝胶的过程中,琼脂分子和酪蛋白相互缠绕,未参与缠绕的分子链逐渐减少,最终形成了具有空间网络结构的凝胶,从而影响到相应的流变学特性。实验数据得出的EI变化曲线可以用类似非牛顿流体Cross模型的流变动力学方程很好地拟合[18],即
式中E0——初始弹性因子,nm-2
Emax——终态弹性因子,nm-2
E——实验测定的弹性因子,nm-2
k——发酵过程结构变化速率常数,h-1
n——依赖系数
t——时间,h
琼脂-脱脂乳混合体系的交联流变动力学方程模型参数值如表1所示。通过此模型拟合获得的决定系数R2均不低于0.970,证明模型适用。
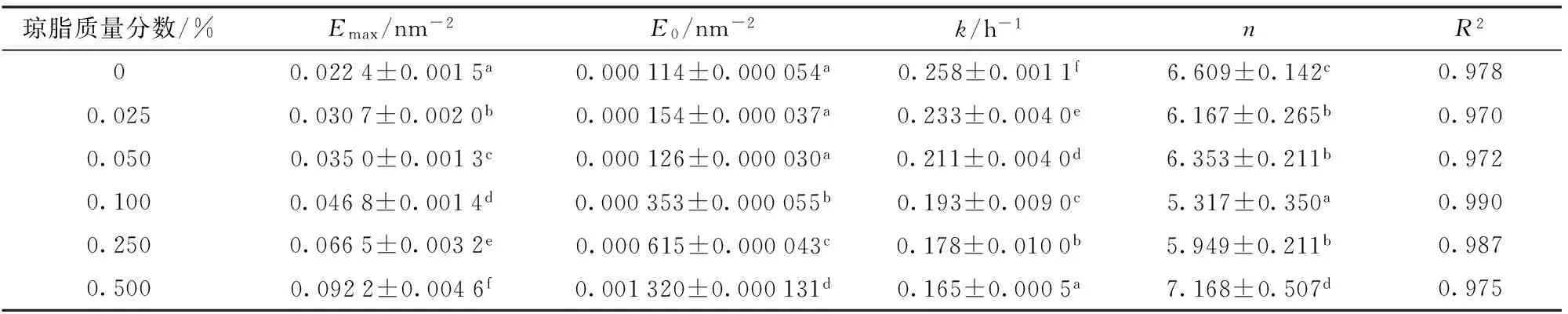
表1 流变动力学方程拟合参数Tab.1 Parameters of rheological kinetic equation
注:同一列不同字母表示有显著性差异(P<0.05)。
由图5和表1可以看出,改变琼脂的浓度对脱脂乳体系的交联过程影响有两部分。随着琼脂浓度的增加,交联结束时体系的弹性因子增加,这是由于较高浓度琼脂酸奶的凝胶更加致密和粗壮[19-20]。当琼脂质量分数大于等于0.1%时,琼脂浓度的增加使交联体系的初始弹性因子增大,这时因为在琼脂浓度增大后,由于琼脂自身具有的黏弹性使得混合体系溶液的弹性增强,初始EI值增大[21]。
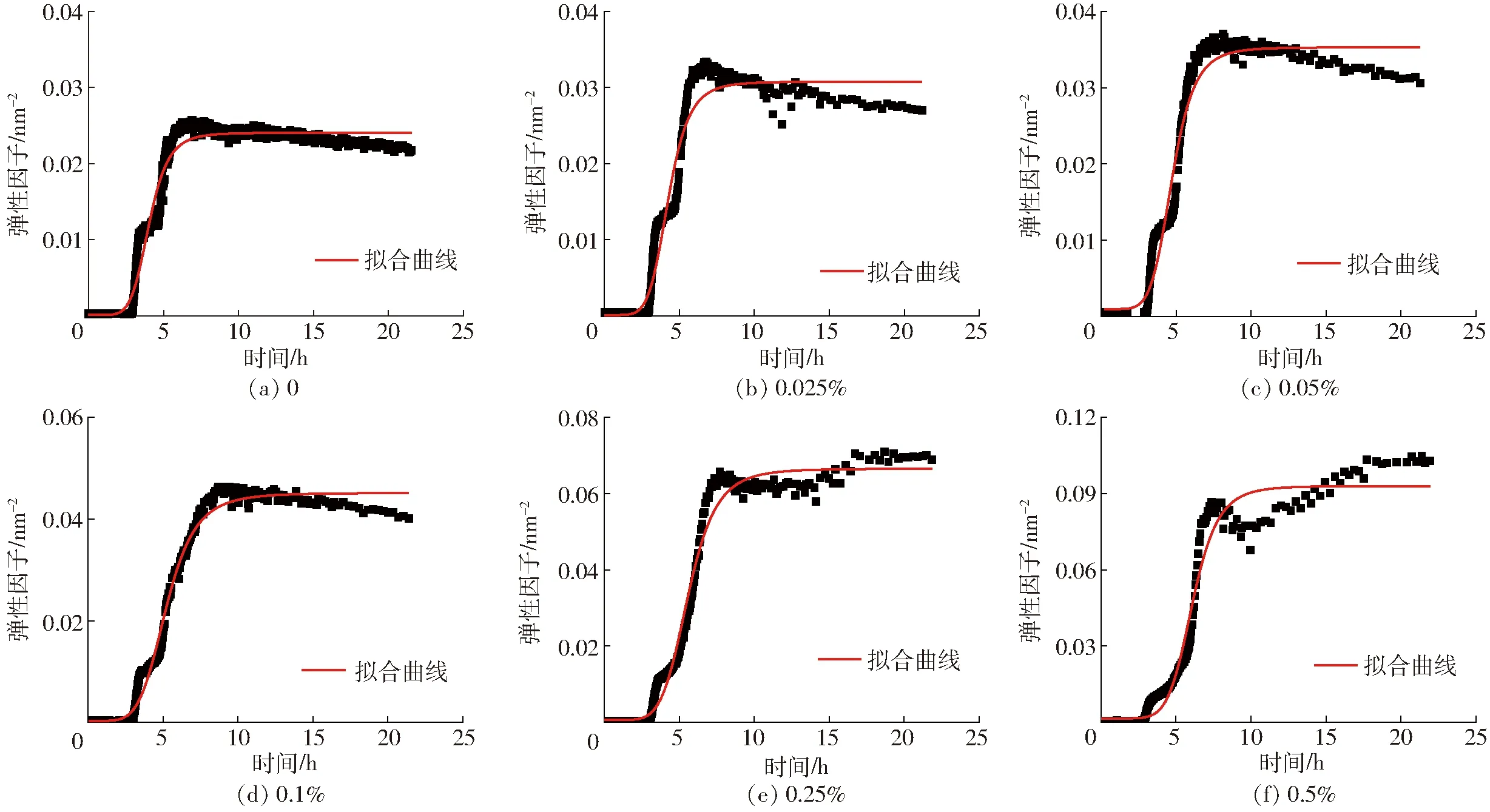
图5 不同质量分数琼脂下体系EI随时间变化规律Fig.5 Changes of EI in different agar concentrations system
当琼脂质量分数小于等于0.05%时,k值随着琼脂的增加而降低,这可能是由于琼脂的加入增加了体系的粘度,从而降低了蛋白质网络结构形成的速度,这与BI等[1]研究含有不同浓度刺槐豆胶的大豆分离蛋白-刺槐豆胶凝胶过程的结果一致。从表1中可以看出,随着琼脂浓度的增加,k减小,这表明琼脂浓度对酸奶的交联速度有影响,在一定范围内(质量分数0~0.5%),琼脂浓度增大降低了蛋白之间的有效碰撞几率,从而结构变化速率常数变低。
3 结束语
采用微流变仪研究了琼脂-脱脂乳混合体系凝胶特征。结果表明,琼脂-脱脂乳混合酸凝胶和脱脂乳酸凝胶的恒温发酵弹性因子变化趋势相似,但琼脂会增强混合凝胶冷却后熟阶段的弹性因子;琼脂-脱脂乳混合体系的黏性因子仅在未形成凝胶网络前比脱脂乳凝胶高,在恒温发酵的其他时间和冷却后熟阶段二者无显著差别。由此可以得出,添加琼脂可以增加凝固型酸奶的凝胶强度,但对其发酵过程并无显著影响。酸奶的最终食用特性与发酵过程中的流变特性密切相关,流变动力学揭示了酸奶的流变学特性随时间的变化规律。利用微流变技术对酸奶发酵过程进行描述,可以更好地掌握和预测酸奶流变特性,为工业生产提供理论基础。
1 BI C H, LI D, WANG L J, et al. Effect of LBG on the gel properties of acid-induced SPI gels [J]. LWT—Food Science and Technology, 2017, 75:1-8.
2 胡文娥,林士强.食用明胶对凝固型酸奶质量的影响探究[J]. 佛山科学技术学院学报:自然科学版, 2015,33(6): 22-25.
3 王璐,刘力,王艳梅,等.几种红藻琼脂的组分结构及理化性质的比较[J]. 海洋与湖沼, 2001, 32(6):658-664.
WANG L, LIU L, WANG Y M, et al. The comparation of several algal agar’s composition and physicochemical properties[J]. Oceanologia et Limnologia Sinica, 2001, 32(6):658-664.(in Chinese)
4 STEPHEN A M, PHILLIPS G O, WILLIAMS P A. Food polysaccharides and their applications[M]. Boca Raton, FL:CRC Taylor & Francis, 2006.
5 赵晓丽,李洁慧,宫春波,等.稳定剂添加对发酵型酸奶发酵效果的影响[J].中国食品添加剂, 2011(1):182-186.
ZHAO X L, LI J H, GONG C B, et al. Effect of the stabilizers in yoghurt fermentation[J]. China Food Additives, 2011(1):182-186.(in Chinese)
6 张国栋,马力,潘晓亚,等.增稠剂对凝固型酸奶品质的影响研究[J]. 中国乳品工业, 2005, 33(7):31-32.
ZHANG G D, MA L, PAN X Y, et al. Influence of thickeners on the quality of yoghurt [J]. China Dairy Industry, 2005, 33(7):31-32.(in Chinese)
7 ALEXANDER M, DALGLEISH D G. Dynamic light scattering techniques and their applications in food science [J]. Food Biophysics, 2006, 1(1):2-13.
8 HEMAR Y, SINGH H, HORNE D S. Determination of early stages of rennet-induced aggregation of casein micelles by diffusing wave spectroscopy and rheological measurements [J]. Current Applied Physics, 2004, 4(2):362-365.
9 MIN W, YANG X Q. Effects of molecular weight of dextran on the rheological behavior and texture properties of soy protein isolate cold-set gels[J]. Science & Technology of Food Industry, 2010, 31(5):71-72.
10 GASTALDI E, LAGAUDE A, FUENTE B T D L. Micellar transition state in casein between pH 5.5 and 5.0[J]. Journal of Food Science, 2010, 61(1):59-64.
11 LÖFGREN C, PERNILLA W A, HERMANSSON A M. Microstructure and rheological behavior of pure and mixed pectin gels[J]. Biomacromolecules, 2002, 3(6):1144-1153.
12 TADROS T. Protein-polysaccharide interaction[M]. Heidelberg: Springer Berlin Heidelberg, 2013.
13 ROCHA C, TEIXEIRA J A, HILLIOU L, et al. Rheological and structural characterization of gels from whey protein hydrolysates/locust bean gum mixed systems [J]. Food Hydrocolloids, 2009, 23(7):1734-1745.
14 DOUBLIER J L, GARNIER C, RENARD D, et al. Protein-polysaccharide interactions [J]. Canadian Institute of Food Science & Technology Journal, 2000, 5(3-4):202-214.
15 ZHANG G, FOEGEDING E A. Heat-induced phase behavior of β-lactoglobulin/polysaccharide mixtures [J]. Food Hydrocolloids, 2003, 17(6):785-792.
16 OELSCHLAEGER C, SCHOPFERER M, SCHEFFOLD F, et al. Linear-to-branched micelles transition: a rheometry and diffusing wave spectroscopy (DWS) study [J]. Langmuir, 2009, 25(2):716.
17 TIWARI S, BHATTACHARYA S. Aeration of model gels: rheological characteristics of gellan and agar gels [J]. Journal of Food Engineering, 2011, 107(1):134-139.
18 MA M, FANG B, LU Y, et al. Intrinsic rheo-kinetics on gelation process of hydrophobic amphoteric cellulose[J]. Journal of Dispersion Science & Technology, 2016, 37(8):1076-1082.
19 SHI A M, WANG L J, LI D, et al. Characterization of starch films containing starch nanoparticles. Part 2: viscoelasticity and creep properties [J]. Carbohydrate Polymers, 2013, 96(2):602-610.
20 CURA D E, LILLE M, PARTANEN R, et al. Effect of trichoderma reesei tyrosinase on rheology and microstructure of acidified milk gels[J]. International Dairy Journal, 2010, 20(12):830-837.
21 HEMAR Y, PINDER D N. DWS microrheology of a linear polysaccharide[J]. Biomacromolecules, 2006, 7(3):674-677.

