氨基羟乙酸对慢性酒精中毒大鼠学习记忆的影响及可能的机制*
秦浩志, 姜洪波,3, 代 玄, 黄亚迪, 罗晓秋, 张瑞岭,2△, 杜爱林,2△
(1. 新乡医学院生理学与神经生物学教研室, 中英脑功能损伤联合实验室, 河南省高校脑研究重点实验室培育基地, 河南 新乡 453003; 2. 新乡医学院第二附属医院 河南省生物精神病学重点实验室, 河南 新乡 453003; 3.新乡医学院第三附属医院, 河南 新乡 453003)
研究[1, 2]表明慢性酒精中毒可以导致神经系统损害, 引起学习、记忆水平下降和精神行为功能缺陷。在我国,慢性酒精中毒已成为不可忽视的社会公共卫生问题, 开发相关药物的意义重大。氨基羟乙酸(aminooxyacetic acid, AOAA)是胱硫醚-β-合成酶(cystathionine β-synthase, CBS)活性抑制剂[3],可抑制内原性H2S的生成,进而减少Ca2+内流以及细胞内Ca2+超载, 从而减少细胞损伤,提高包括ATP酶在内的各种酶类的活性,提高5-HT受体蛋白表达,改善受损中枢神经系统的功能。
本实验通过测定AOAA作用于慢性酒精中毒大鼠后大鼠学习记忆能力及海马内H2S、线粒体ATP酶活性和5-HT受体蛋白的含量,探究AOAA对慢性酒精中毒大鼠学习记忆的影响及可能机制。
1 材料与方法
1.1 实验动物、仪器与试剂
60只清洁级健康雄性SD大鼠, 体重120~160 g , 由郑州大学动物管理中心提供。 Morris水迷宫和行为学记录软件EthoVision XT 8购于德国Noldus公司;高速冷冻离心机购于德国Heraeus公司;Eclipse E200显微镜购于日本Nikon公司;超微量总ATP酶测定试剂盒、线粒体提取试剂盒和总蛋白定量测试盒购于中国南京建成生物工程研究所;AOAA购于美国ACROS公司。5-HT受体蛋白抗体、SP试剂盒购于中国博奥森公司;DAB显色试剂盒购于北京中杉金桥生物技术有限公司;其他试剂均为国产或进口分析纯级。
1.2 模型建立
实验前在22~25℃实验室中饲养大鼠5~7 d以适应实验室环境。随机平均分为空白对照组(Control group),AOAA治疗组(AOAA remedy group)、慢性酒精中毒模型组(Chronic alcoholosis model group), 每组20只。模型组和治疗组饮含6%(v/v)酒精水溶液28 d, 每日9:00置换酒精溶液,构建酒精中毒大鼠模型[4]。14 d后,按5 mg/kg 比例将AOAA溶解在1 ml生理盐水中,治疗组每日腹腔注射一次,连续14 d。空白对照组及慢性酒精中毒模型组每日腹腔注射1 ml生理盐水。
1.3 学习和记忆能力评价
各组大鼠进行水迷宫测试[5]。Morris水迷宫圆形水池池壁和池底均为黑色,水池四周挂有蓝色窗帘以起到遮蔽作用,水池内壁高处固定有不同形状和颜色的实验用参照物。游泳池等分为四个区域,代表四个象限,分别标记为SW、SE、NW、NE。SE象限中间为水面以下0.5 cm的平台,平台可拆卸。定位航行实验连续进行4 d,每天上午10点开始进行,每只大鼠每天每个象限训练一次,每天按逆时针方向改变大鼠游泳的开始象限,每次游泳训练的最长记录时间为60 s。假若大鼠在60 s内找到水下平台,则让其在平台上停留30 s,以加强大鼠学习记忆;假如大鼠60 s内未能找到水下平台,则用工具将其引导至水下平台停留30 s。在定位航行试验中,摄像装置记录大鼠的游泳轨迹,行为学记录软件EthoVision XT 8测量每只大鼠每天每次到达逃生平台的时间(潜伏期)和路径长度(游泳距离), 潜伏期和游泳距离越短,说明大鼠学习能力越强。空间探索实验在定位航行实验结束之后进行,以测量大鼠空间位置记忆的保持能力,只进行一天。此次实验与定位航行实验的差别在于将水面高度调节到预定高度后移除水下平台;大鼠在目标象限的对侧释放;大鼠的游泳时间延长为300 s,摄像装置记录大鼠的游泳轨迹,并制成轨迹图像。在空间探索实验轨迹图像中,穿越平台次数越多,平台所在象限游泳距离比重越大说明大鼠学习能力越强。
1.4 分光光度法间接测定海马组织H2S的含量
学习和记忆能力评价实验结束后,腹腔麻醉大鼠, 断头取脑, 分离海马新鲜组织,立即放入-80℃冰箱保存,在低温环境下制成组织液。采用亚甲基蓝分光光度法[6],使用分光光度计测大鼠海马组织液在波长670 nm处的吸光度,按照H2S标准曲线计算海马组织H2S含量。
1.5 海马线粒体提取
按照线粒体提取试剂盒说明书从冻存海马组织中获得线粒体。
1.6 总蛋白浓度测定
按照总蛋白定量测试盒说明书,利用酶标仪测试液体样品和海马组织样本吸光值,计算海马组织总蛋白浓度。
1.7 线粒体ATP酶活力的测定
按照超微量总ATP酶测定试剂盒说明书,依次经过组织前处理、酶促反应和定磷,测定在波长636 nm处的吸光度,计算出ATP酶的活性。
1.8 免疫组化观察5-HT受体
每组随机选取4只大鼠进行取脑、固定、石蜡包埋、切片。切片经过脱蜡、修复、免疫组化后在暗处进行DAB显色,显色完成后进行脱水、透明、中性树胶封片,之后用显微镜观察双侧海马并拍摄图片,并用image-pro-plus 6.0 图像分析软件分析蛋白的阳性表达情况。
1.9 统计学处理
2 结果
2.1 各组大鼠学习记忆成绩
如表1,2所示,定位航行实验期间,与空白对照组大鼠相比,慢性酒精中毒模型组大鼠学习和记忆能力明显降低, 表现为潜伏期和游泳距离的增多,第2至4日有极显著性差异(P<0.01);给予AOAA干预后,与模型组相比,治疗组大鼠潜伏期和游泳距离明显减少, 第2至4日有极显著性差异(P< 0.01)。
水迷宫第5日实验空间探索实验大鼠代表性轨迹, 如图1,在水迷宫第5日实验空间探索实验中,与空白对照组相比,模型组大鼠轨迹在各象限分布明显均匀,平台穿越次数明显减少,给予AOAA干预后,与模型组相比,治疗组大鼠轨迹明显集中在平台所在象限,且平台穿越次数明显增多。


GroupDay1Day2Day3Day4Control51.94±14.7930.13±16.7925.13±14.9317.03±9.13Model56.13±12.6049.38±17.72∗∗39.38±20.97∗∗29.06±15.86∗∗AOAA54.50±13.1336.69±16.88∗∗ ##34.09±16.30## 19.69±12.56##
Model: Chronic alcoholism model group; AOAA: Aminooxyacetic acid remedy group
**P<0.01vscontrol group;##P<0.01vsAOAA remedy group


GroupDay1Day2Day3Day4Control939.52±106.46714.74±117.54435.64±72.30230.55±23.78 Model1020.93±119.82898.33±147.45∗∗680.44±99.66∗∗454.00±98.07∗∗AOAA954.06±132.03759.55±153.94##473.08±72.41##239.85±31.49##
Model: Chronic alcoholism model group; AOAA: Aminooxyacetic acid remedy group
**P<0.01vscontrol group;##P<0.01vsAOAA remedy group

Fig.1Exploratory trajectory of rats in each group in spatial probe test
A: Control group; B: Chronic alcoholism model group; C: AOAA remedy group
2.2 海马组织中H2S和线粒体ATP酶活性的含量变化
如表3所示,与空白对照组相比,模型组大鼠海马组织内的H2S含量明显增高,有极显著性差异(P<0.01);给予AOAA干预后,与模型组大鼠相比,治疗组大鼠海马组织中H2S含量降低,有极显著性差异(P<0.01)。
与空白对照组相比,模型组大鼠海马组织内的线粒体ATP酶活性明显降低,有极显著性差异(P<0.01);给予AOAA干预后,与模型组大鼠相比,治疗组大鼠海马组织内线粒体ATP酶活性上升,有极显著性差异(P<0.01)。


GroupH2S level(nmol/g)Mitochondrial ATPase activity(μmolPi/mg prot hour)Control35.47±2.481.98±0.04Model57.44±3.04∗∗1.49±0.05∗∗AOAA42.88±3.27∗∗##1.75±0.11∗∗##
Model: Chronic alcoholism model group; AOAA: Aminooxyacetic acid remedy group
**P<0.01vscontrol group;##P<0.01vsAOAA remedy group
2.3 光镜观察海马组织CA1、CA3区5-HT受体蛋白表达
5-HT受体蛋白定位于细胞膜部位,阳性细胞显示棕黄色。对海马组织CA1、CA3区免疫组化染色阳性细胞平均光密度值进行分析。并将CA1、CA3区阳性结果表达情况进行比较。
如图 2,图3所示,各组大鼠海马CA1、CA3区均可见一定量5-HT受体阳性表达,阳性反应细胞着色呈深棕黄色(图2,3见彩图页Ⅰ)。如表4所示,与空白对照组相比,其余两组5-HT受体阳性表达量明显降低,差异有极显著性(P<0.01),其中以模型组降低最为明显。治疗组与模型组比较,5-HT受体阳性表达明显升高,有极显著差异性(P< 0.01)。

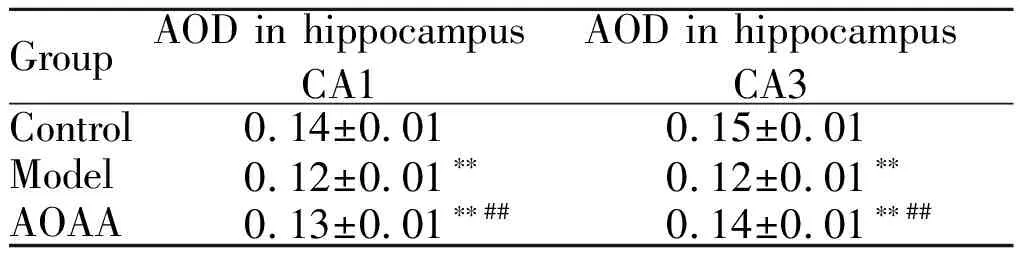
GroupAOD in hippocampus CA1AOD in hippocampus CA3Control0.14±0.010.15±0.01Model0.12±0.01∗∗0.12±0.01∗∗AOAA0.13±0.01∗∗##0.14±0.01∗∗##
AOD: Average optical density; Model: Chronic alcoholism model group; AOAA: Aminooxyacetic acid remedy group
**P<0.01vscontrol group;##P<0.01vsAOAA remedy group
3 讨论
慢性酒精中毒是一种对人神经系统造成损伤的进行性疾病,不仅严重损害患者的身体健康,而且极易引发社会问题。目前认为酒精中毒可能是涉及多种受体作用的复杂机制。H2S是人体内重要的气体信号分子。含硫氨基酸在体内分解代谢可生成半胱氨酸,半胱氨酸受CBS催化生成H2S[7]。H2S能够快速通过细胞膜,对许多生物靶点造成影响,兼具细胞保护和细胞毒性作用[8]。高浓度H2S的细胞毒性表现为两方面:一方面增强由N-甲基-D-天冬氨酸受体介导的钙超载,对线粒体能量代谢造成伤害,进而导致细胞损伤[4,9,10];另一方面通过对兴奋性突触后膜电位特异性的抑制,阻碍突触传递,对中枢神经系统的正常生理功能起到抑制作用[11, 12]。有研究显示,慢性酒精中毒能够激活CBS, 催化H2S的大量形成[13]。
ATP是组织细胞生命活动所需能量的直接来源。ATP酶催化ADP氧化磷酸化成ATP,对机体的正常运转具有十分重要的作用。ATP酶活性在细胞损伤状态下发生改变[14]。
5-HT在神经中枢中广泛存在,可参与对情感、睡眠、学习、体温和记忆等多种生理功能的调节[15,16]。有研究表明,中脑边缘多巴胺系统与酒精成瘾密切相关,5-HT系统一方面可以通过抑制中脑边缘多巴胺系统来缓解酒精中毒症状, 另一方面可以明显减弱谷氨酸诱导的钙离子内向电流,提高神经细胞的存活率。有研究显示,长期摄入乙醇可以抑制五羟色胺的表达,使5-HT 能神经体系功能活动减弱[17]。三突触环路是继Papez环路之后人类发现的又一记忆回路。内嗅皮层发出穿通纤维与齿状回颗粒细胞产生突触联系,随后齿状回颗粒细胞经过苔状纤维与海马CA3区神经元生成突触联系,CA3区再通过Schaffer侧支与CA1区产生突触联系[18]。
AOAA是CBS活性抑制剂[3],可以通过抑制CBS活性来减少H2S的生成,抑制细胞损伤。为了探究AOAA对慢性酒精中毒大鼠的脑保护作用,本研究检测了大鼠的学习记忆能力、海马H2S含量、线粒体ATP酶活性和CA1、CA3区5-HT受体的蛋白表达。结果显示,与空白对照组比较,模型组大鼠学习记忆能力下降, H2S含量升高,线粒体ATP酶活性降低, 5-HT受体蛋白含量下降,差异极具显著性(P<0.01);与模型组比较,AOAA治疗组学习记忆能力有所提高, H2S含量降低,线粒体ATP酶活性升高, 5-HT受体蛋白的表达有所增加,差异极具显著性(P<0.01)。
由此提示,AOAA改善慢性酒精中毒大鼠学习记忆功能的作用途径可能是AOAA通过抑制CBS活性,减少体内H2S生成,从而减轻细胞内钙超载,进而改善受钙超载损害的线粒体能量代谢,能量代谢的改善使得5-HT受体蛋白的表达改善,最终使得海马三突触循环通路得到改善,大鼠学习记忆能力随之提高。该AOAA作用途径的提出可为慢性酒精中毒的治疗提供新的思路。但由于本实验只对大鼠学习记忆能力、海马组织硫化氢含量、线粒体ATP酶活性以及5-HT受体蛋白的含量进行检测,因此,要想为慢性酒精中毒的损伤机制和AOAA对其治疗提供更加科学的依据,还需更进一步的研究。

