猪感染PRRSV后Cathelicidins抗菌肽基因的表达情况
卢艳敏
(衡水学院生命科学系,河北衡水 053000)
抗菌肽是动物天然免疫反应的重要组成部分,具有广谱抗菌活性,对细菌、真菌、原虫和病毒均具有较强的杀伤作用[1],另外还可以抗癌、促进伤口愈合,因此具有较大的药用开发价值。抗菌肽是生物体经诱导产生的具有抗菌活性的小分子多肽,在机体抵抗病原入侵中起着重要作用[2],具有分子量小、抗菌谱广、抗菌活性高、不易使病原菌产生耐药性、不破坏动物体细胞、无免疫原性等优点。抗菌肽作用机制独特,主要有膜作用机制和胞内作用机制。最新研究表明,抗菌肽还存在其他的杀菌机制,Chu等研究发现,抗菌肽α-defensin 6可以结合到鼠伤寒沙门氏菌表面,通过自我组装,在细菌周围形成一些小纤维和纳米样纤维,从而减少细菌黏附到肠道黏膜,以达到保护机体的目的[3]。汪以真发现,猪源hepcidin能够使大肠杆菌K88聚集成团,形成网状结构包裹[4]。
猪源抗菌肽主要包括防御素(defensins)和cathelicidins两大家族,目前已发现了约30种猪源抗菌肽,其中Cathelicidins有PR-39、PG1-5(protegrin)、PF1-2(prophenin)和PMAP等4类抗菌肽[1]。cathelicidins基因由4个外显子和3个内含子组成,1~3个外显子编码N-端信号肽区域(PRE)和保守的cathelin区域(PRO),第4个外显子编码Pro区的最后几个残基和高度特异的C-端成熟肽区域。与其他抗菌肽相比,cathelicidins家族的抗菌活性更强[5-6],抗菌作用迅速[7],对耐药菌株也具有较强的活性[8]、低的溶血活性以及细胞毒性,在新型抗菌药物开发领域显示出巨大的潜力[9]。
猪繁殖与呼吸综合征(PRRS)是猪的一种高度传染性疾病,最早在北美洲和欧洲发现,我国于1955年首次分离到猪繁殖与呼吸综合征病毒(PRRSV)。PRRSV可引起妊娠母猪流产、死胎、木乃伊胎及产弱仔等繁殖障碍,并可引起各年龄阶段猪的呼吸道症状,仔猪死亡率高,同时还会导致免疫抑制和持续性感染等症状。PRRSV对我国乃至世界养猪业造成了巨大的经济损失,已成为严重威胁养猪业发展的重要传染病之一,而现有疫苗及药物效果均不理想[10]。本试验主要研究猪感染PRRSV后体内cathelicidins抗菌肽的表达情况,为PRRSV新药物的开发提供思路。
1 材料与方法
1.1 材料
1.1.1 试验材料 PRRSV由国家野生动物疫病研究中心保存,PRRSV感染1月龄无特定病原体(SPF)猪(24头),分别于感染后12、24、72、168 h取样(以未感染病毒的1月龄SPF猪6头作为对照),取肺脏、肺门淋巴结、脾脏、肝脏、骨髓等组织,将样品置于冻存管中,液氮速冻,-80 ℃保存。
1.1.2 试剂 超纯RNA提取试剂盒(Ultrapure RNA Kit),购自北京康为世纪生物科技有限公司;SupermoⅢM-MLV反转录酶,购自北京百泰克生物技术有限公司;dNTP Mixture、Ribonuclease Inhibitor和Oligo(dT)18Primers,购自宝生物工程(大连)有限公司(TaKaRa);TransStart Green qPCR SuperMix,购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 RNA的提取及cDNA的合成 采用超纯RNA提取试剂盒(Ultrapure RNA Kit)取冻存组织进行总RNA提取,操作过程按照试剂盒说明书进行。琼脂糖凝胶电泳检测RNA的质量,紫外分光光度计下测定RNA浓度,随后进行反转录,合成cDNA第一链。以合成的cDNA作为Real-Time PCR(即实时定量PCR)分析的模板,-20 ℃保存备用。
1.2.2 Real-Time PCR Real-Time PCR(实时定量PCR)引物(由上海英骏生物技术有限公司合成)序列[1,11]见表1,按照北京全式金生物技术有限公司TransStart Green qPCR SuperMix说明书进行Real-Time PCR,反应体系:P10.5 μL,P20.5 μL,2×TransStartTMGreen qPCR SuperMix 12.5 μL,Passive Reference Dye 0.5 μL,模板1.0 μL,ddH2O 10.0 μL。反应程序:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,40个循环。相对定量分析参照2-ΔΔCT法[12]。实时定量PCR分析共进行3次生物学重复。

表1 Cathelicidin引物序列
2 结果与分析
2.1 PR39的表达情况
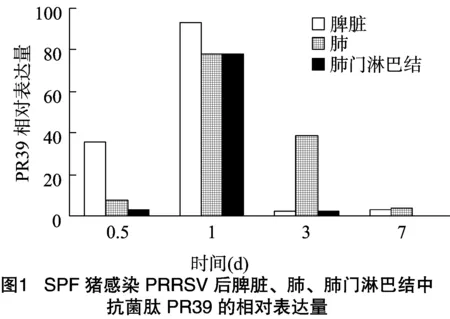
猪感染PRRSV之后,在脾脏、肺、肺门淋巴结中均检测到PR39的表达,且随着感染时间的增长,表达量也有所变化。如图1所示,猪感染PRRSV后,PR39在脾脏中的表达量在 0.5、1、3和7 d的4个感染时间段中,感染1 d后表达量最高,其次为感染0.5 d;猪感染PRRSV后,PR39在肺中的表达量在0.5、1、3和7 d的4个感染时间段中,感染1 d后表达量最高,其次为感染3 d;猪感染PRRSV后,PR39在肺门淋巴结中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高,然后依次是感染0.5、3、7 d,但感染0.5 d和 3 d 后的表达量差异不大。
综上所述,猪感染PRRSV后,PR39在肺、肺门淋巴结和脾脏3种组织中的表达量均呈现先升高后降低的趋势,且都是在感染1 d后表达量达到最高值。
2.2 Progerin 1的表达情况
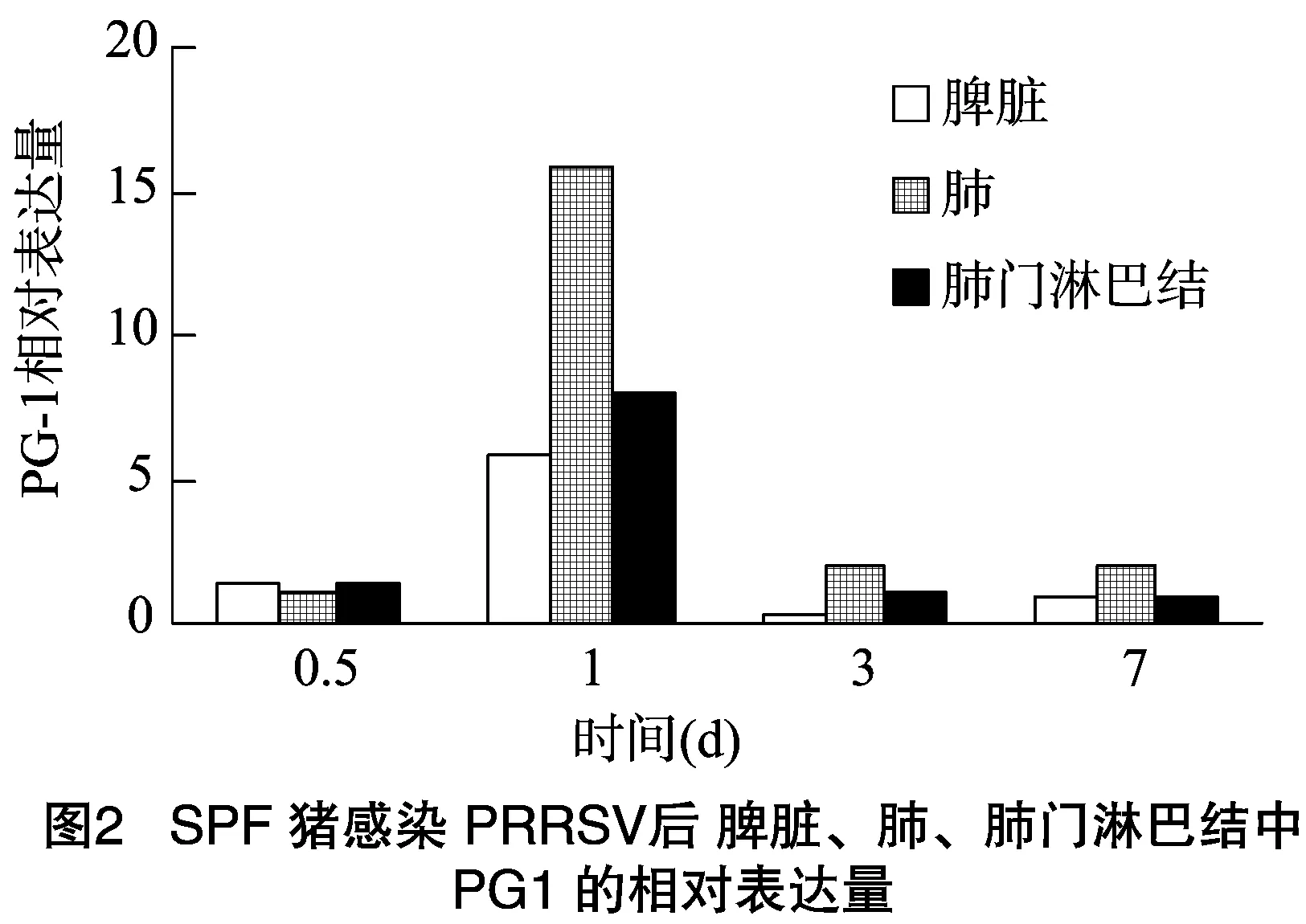
猪感染PRRSV之后,在脾脏、肺、肺门淋巴结中均检测到Progerin1(PG1)的表达,感染时间不同,其表达量有所变化,但差异较小。如图2所示,猪感染PRRSV后,Progerin1在脾脏中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染 1 d 后表达量最高,其次为感染0.5、7、3 d;猪感染PRRSV后,Progerin1在肺中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高,其次为感染3、7、0.5 d;猪感染PRRSV后,Progerin1在肺门淋巴结中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高,然后依次是感染0.5、3、7 d。综上所述,猪感染PRRSV后,Progerin1在脾脏、肺和肺门淋巴结3种组织中的表达量均呈现先升高后降低的趋势,且都是在感染1 d后表达量达到最高值,Progerin1的表达量在3种组织中的变化均不明显。
2.3 progerin 1-5的表达情况
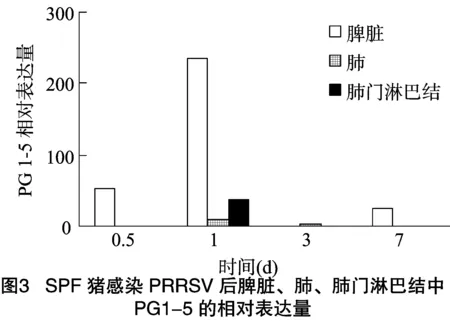
猪感染PRRSV后,在脾脏、肺、肺门淋巴结中均检测到Progerin1-5(PG1-5)的表达,在脾脏中表达量较高,而在肺与肺门淋巴结中表达量较少,随着感染时间的增长,表达量也有所变化。如图3所示,猪感染PRRSV后,progerin1-5在脾脏中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染 1 d 后表达量最高,然后依次为0.5、7、3 d;猪感染PRRSV后,progerin1-5在肺中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高;猪感染PRRSV后,progerin1-5在肺门淋巴结中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高,然后依次是感染0.5、3、7 d,但感染3 d与7 d后的表达量差异不大。
综上所述,猪感染PRRSV后,progerin1-5在脾脏、肺和肺门淋巴结3种组织中的表达量均呈现先升高后降低的趋势,且都是在感染1 d后表达量达到最高值,其中在脾脏中的表达量变化较大,而在肺中的表达量变化不明显。
2.4 PMAP23的表达情况
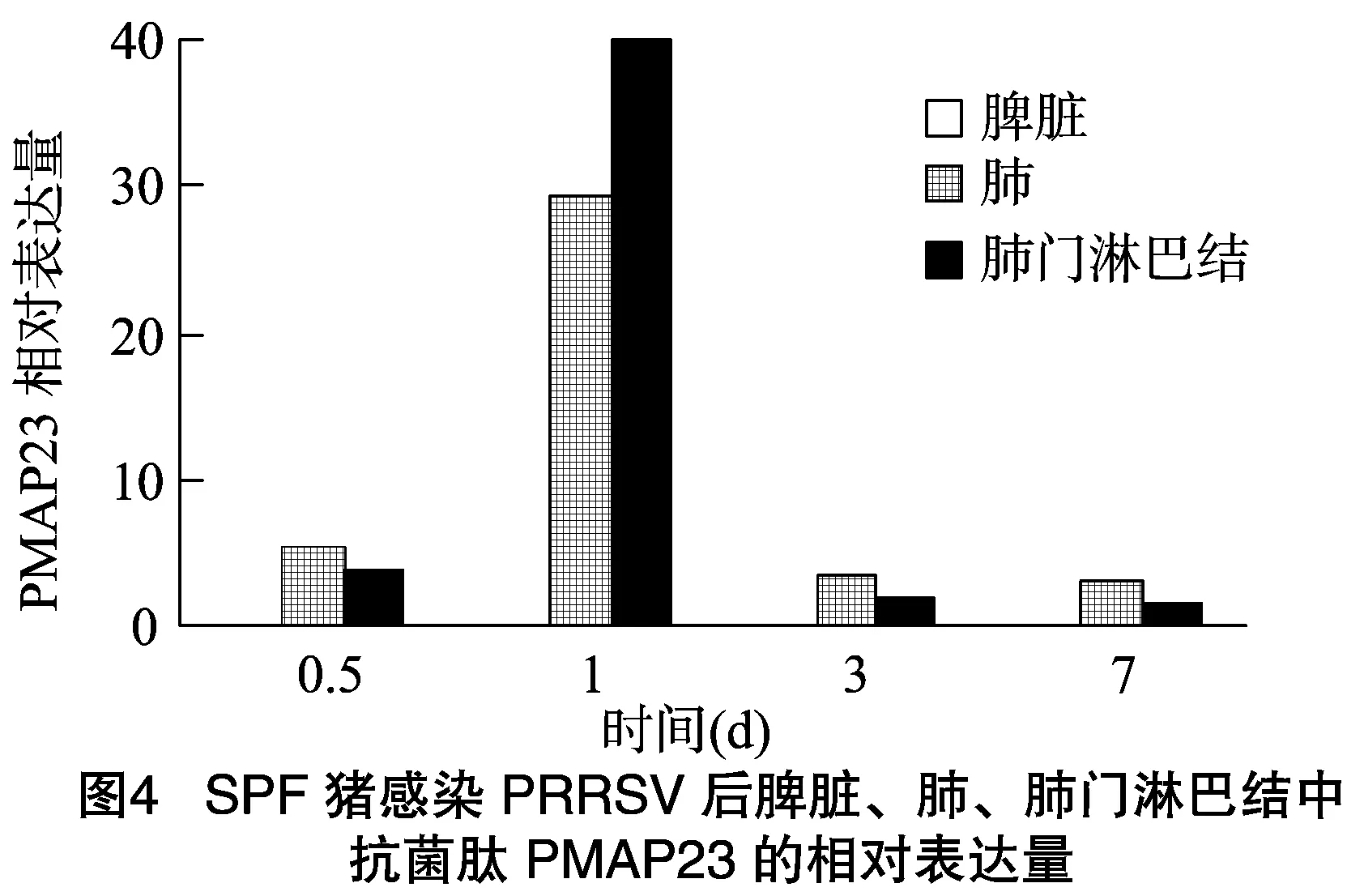
猪感染PRRSV之后,在脾脏中未检测到PMPA23的表达,肺、肺门淋巴结中检测到PMPA23的表达,且随着感染时间的增长,肺、肺门淋巴结中PMAP23的表达量有所变化。如图4所示,猪感染PRRSV后,PMAP23在肺、肺门淋巴结中的表达量在0.5、1、3和7 d 4个感染时间段中,在感染1 d后表达量最高,然后依次为感染0.5、3、7 d。
综上所述,猪感染PRRSV后,PMAP23在肺、肺门淋巴结中的表达量均呈现先升高后降低的趋势,且都是在感染1 d后表达量达到最高值。
3 讨论
抗菌肽分子量小,大部分具有12~50个氨基酸,具有强碱性、热稳定性以及广谱抗菌性等特点,在农业、医药等领域受到广泛的重视,全球科研人员对抗菌肽的作用机制、药物疗效、安全性等进行了深入的研究,并且建立了抗菌肽数据库(APD:http://aps.unmc.edu/AP/main.php)[13]。目前,该数据库已收录2 700多种抗菌肽,其中272种抗菌肽来源于细菌,4种抗菌肽来源于古细菌,8种抗菌肽来源于原生生物、13种抗菌肽来源于真菌,335种抗菌肽来源于植物,2 043种抗菌肽来源于动物。这些抗菌肽具有抗细菌、抗病毒、抗真菌、抗寄生虫、抗癌、抗原虫等活性。
研究发现,多种抗菌肽具有抗病毒活性,如抗艾滋病病毒、疱疹病毒。LL-37是人体内唯一的cathelicidins,通过直接的灭活试验发现,LL-37可以显著降低几种病毒对人的感染[14-17]。动物抗菌肽通过与病毒糖蛋白或细胞表面的病毒受体的相互作用,可以直接抑制病毒的感染,也可以通过激活其他抗病毒反应来间接地抑制病毒感染[18]。
本试验测定了PRRSV在感染猪后的不同时间段内,脾脏、肺、肺门淋巴结中cathelicidins表达量的变化情况。研究结果表明,PR39、PG1、PG1-5、PMAP23的表达受到PRRSV的影响,猪感染PRRSV后,脾脏、肺、肺门淋巴结中的PR39、PG1、PG1-5、PMAP23表达量上调,其中PRRSV对PR39与PG1-5表达量的影响较大。下一步工作合成PR39、PG1、PG1-5、PMAP23多肽,测定抗菌肽对PRRSV的灭活效果以及对细胞的毒性,为PRRSV新药物的开发提供新的思路。
[1]Sang Y M,Ruchala P,Lehrer R I,et al. Antimicrobial host defense peptides in an arteriviral infection:differential peptide expression and virus inactivation[J]. Viral Immunology,2009,22(4):235-242.
[2]刘 伟,皮雄娥,王 欣. 抗菌肽与肠道健康研究进展[J]. 微生物学报,2016,56(10):1537-1543.
[3]Chu H,Pazgier M,Jung G,et al. Humanα-defensin 6 promotes mucosal innate immunity through self-assembled peptide nanonets[J]. Science,2012,337(693):477-481.
[4]汪以真. 动物源抗菌肽的研究现状和展望[J]. 动物营养学报,2014,26(10):2934-2941.
[5]Wang Y P,Lu Z K,Feng F F,et al. Molecular cloning and characterization of novel cathelicidin-derived myeloid antimicrobial peptide fromPhasianuscolchicus[J]. Developmental and Comparative Immunology,2011(3):314-322.
[6]Feng F F,Chen C,Zhu W J,et al. Gene cloning,expression and characterization of avian cathelicidin orthologs,Cc-CATHs,fromCoturnixcoturnix[J]. FEBS Journal,2011,278(9):1573-1584.
[7]Wang Y P,Hong J,Liu X H,et al. Snake cathelicidin from bungarus fasciatus is a potent peptide antibiotics[J]. PLoS One,2008,3(9):e3217.
[8]Turner J,Cho Y,Dinh N N,et al. Activities of LL-37,a cathelin-associated antimicrobial peptide of human neutrophils[J]. Antimicrobial Agents and Chemotherapy,1998,42(9):2206-2214.
[9]广慧娟. Cathelicidin家族抗菌肽研究进展[J]. 动物学研究,2012,33(5):523-526.
[10]韩 军,杨汉春. 猪源抗菌肽的研究进展[J]. 中国兽医杂志,2004,40(5):29-32.
[11]Cheng Q,Jiang Z G,Xu C C,et al. CpG oligodeoxynucleotide promotes protective immunity in the enteric mucosa and suppresses enterotoxigenicE.coliin the weaning piglets[J]. International Immunopharmacology,2010,10(10):1249-1260.
[12]Livak K J,Schmittgen T D. Analysis of relative gene expression data using realtime quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[13]Wang G S,Li X,Wang Z. APD2:the updated antimicrobial peptide database and its application in peptide design[J]. Nucleic Acids Research,2009,37(S1):D933-D937.
[14]Bergman P,Walter-Jallow L,Broliden K A,et al. The antimicrobial peptide LL-37 inhibits HIV-1 replication[J]. Current HIV Research,2007,5(4):410-415.
[15]Gordon Y J,Huang L C,Romanowski E G,et al. Human cathelicidin (LL-37),a multifunctional peptide,is expressed by ocular surface epithelia and has potent antibacterial and antiviral activity[J]. Current Eye Research,2005,30(5):385-394.
[16]Howell M D,Jones J F,Kisich K O,et al. Selective killing of vaccinia virus by LL-37:implications for eczema vaccinatum[J]. Journal of Immunology,2004,172(3):1763-1767.
[17]Howell M D,Gallo R L,Boguniewicz M,et al. Cytokine milieu of atopic dermatitis skin subverts the innate immune response to vaccinia virus[J]. Immunity,2006(24):341-348.
[18]Klotman M E,Chang T L. Defensins in innate antiviral immunity[J]. Nature Reviews Immunology,2006(6):447-456.

