增龄条件下Wnt/β-catenin信号通路在骨髓间充质干细胞中的变化*
刘娜 张贤华 李影 张维 杨坤 顾斌
随着增龄的变化,人体多种重要器官由于干细胞维持组织平衡能力下降,出现衰老相关疾病表现,与人体大部分组织器官一样,骨具有发育、增龄、衰老的过程和受损后的再生能力,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨组织代谢或骨改建的重要细胞学基础[1]。在骨发育、衰老和再生修复中干细胞起到了主导作用,同时干细胞的各项功能受到严密的分子调控,这些调控因素不仅是维持骨生理性功能活动的基础,而且是决定病理状态产生、发展和转归的机制。
经典的Wnt/β-catenin信号在骨骼的发育和代谢方面有重要作用。近年来的研究提示,Wnt信号通路与干细胞的增龄变化有密切关系,有学者发现Wnt/β-catenin信号通路对骨髓间充质干细胞的衰老发挥重要调控作用[2],也有研究表明Wnt/β-catenin信号通路可以通过促进细胞产生ROS进而诱导间充质干细胞的衰老[3]。除此之外,机体的生理、病理状态发生改变会改变干细胞所处的微环境,进而影响干细胞内Wnt信号通路的活化水平[4-7]。本研究采用不同年龄大鼠来源骨髓间充质干细胞结合Wnt/β-catenin信号通路来探讨增龄因素导致的体内环境改变对间充质干细胞的影响。
1.材料方法
1.1 材料 胎牛血清,L-DMEM培养基(Gibco BRL);0.25%胰蛋白酶(Sigma,St Louis,MO,美国);青链霉素(Gibco BRL);链霉素(Gibco BRL);实时定量PCR仪(Applied Biosystems 7500,美国Life Technologies公司);RNA抽提试剂盒及逆转录试剂盒(Fermentas,美国);Taq DNA聚合酶、dNTPs和引物上海生物工程公司(中国);Syber Green荧光定量PCR检测试剂盒(Takara,日本);衰老β-半乳糖苷酶染色试剂盒,Westen及IP裂解液,核蛋白提取液,BCA蛋白浓度测定试剂盒(碧云天公司,中国);IL-6、TNF-αELISA检测试剂盒(R&DSystems,美国);β-catenin(Abcam,美国);β-Act in,羊抗兔IgG(中杉金桥,中国)。
1.2 实验动物 3月龄级18月龄SD大鼠共16只,均为雄性大鼠,每组各8只,平均体重(590±17)g,由北京维通利华实验动物有限责任公司提供。各月龄实验动物适应性喂养一周后,两组实验动物处死,取双侧股骨,每个样本取单侧股骨-80℃冰箱保存待查,另一侧股骨进行细胞培养。
1.3 骨密度测定 采用Discovery Wi(Hologic,美国)双能X线骨密度仪对实验动物的股骨样本进行骨密度测定。首先将骨组织样本放置在骨密度仪探头下,应用动物骨密度测定软件,自动分析出大鼠股骨的骨密度。
1.4 骨髓间充质干细胞的体外培养 骨髓间充质干细胞的体外培养及鉴定遵循本实验室前期的实验步骤[6]。3月龄及18月龄SD大鼠各8只,脱颈处死,消毒后取下股骨,无菌去除骨组织周围肌肉及筋膜等软组织,暴露骨髓腔。用注射器吸取L-DMEM培养基,反复冲洗骨髓腔,将所得悬液以1500r/min离心5min。重悬细胞,加入培养基(90%L-DMEM和10%胎牛血清),放入37℃、5%CO2恒温培养箱培养,48h后半量换液,3d后铺满瓶底80%时传代。采用低密度稀释法扩增培养获取BMSCs,取3-4代细胞进行实验。
1.5 衰老β-半乳糖苷酶染色(SA-β-Gal染色) 将纯化获取的P3代BMSCs制成单细胞悬液,以5×104个/mL的密度接种于6孔板中,常规培养至细胞融合达50%。按衰老β-半乳糖苷酶染色试剂盒检测说明首先将细胞用β-半乳糖苷酶固定剂固定10min,PBS洗涤三次(每次3min)后,随后用新鲜制备的β-半乳糖苷酶的染色工作液对细胞进行染色,37℃放置12h,随机选择10个微观领域的阳性染色细胞计数。
1.6 细胞因子酶联免疫吸附测定(ELISA检测)将P3代BMSCs按1×105个/mL的密度接种到24孔板中,每孔800ul,每组设3个复孔。待细胞贴壁后,弃原培养液,PBS冲洗1遍,换新鲜的L-DMEM(10%FBS)进行常规培养,72h后收集各个培养孔内的培养液,离心后取上清液进行ELISA检测。按照TNF-α、IL-6 ELISA检测试剂盒说明建立标准曲线后每孔加入待测样品100μl,洗板,每孔加入一抗工作液50μl反应板充分混匀后置于37℃60min,洗板,加入酶标抗体工作液100μl反应板充分混匀后置于37℃60min,洗板后加入底物液100μl,置于37℃避光反应10min,最后每孔加入50μl终止液混匀,在450nm处测吸光值。
1.7 Western blotting检测BMSCs中的蛋白表达 将P4代3月龄及18月龄BMSCs以2×105个/mL的密度接种于直径9cm的培养皿中,培养72h细胞密度达70%,在预冷的PBS中清洗3遍,采用细胞裂解液试剂盒分别提取各组标本中的总蛋白,另外根据实际说明应用细胞核蛋白、细胞浆蛋白抽提试剂盒分离提取BMSCs细胞核蛋白。采用BCA法测定蛋白样本浓度,沸水煮5min,12000r/min离心1min,制备蛋白样品,-20℃保存。配置8%的分离胶、6%的浓缩胶和1×SDS电泳液,依据蛋白定量结果进行蛋白上样,电压为80V,电泳20min,待溴酚蓝进入分离胶后调整电压至 120V,电泳 60min。在转移电泳槽(200mA,2h)中将凝胶中的蛋白转至聚偏氟乙烯(polyvinylidene fluorid,PVDF)膜,用 TBST配制的含有5%脱脂奶粉的封闭缓冲液封闭2h,PVDF膜封闭β-catenin(1∶800),4℃过夜。次日取出封有一抗的PVDF膜,用TBST洗膜,每次5min,共计3次。按说明书加入1∶1000工作浓度的二抗,室温条件下封闭2h。TBST洗脱二抗,每次10min,共计3次。漂洗膜后加入电化学发光底物发光显色试剂盒显色,采用蛋白凝胶成像系统照相观察。
1.8 实时定量PCR 检测BMSCs基因表达将2组P4代BMSCs以1×105个/mL的密度接种至T25培养瓶,待细胞贴壁后PBS冲洗两遍,随后换液进行常规培养,72h后用Trizol裂解并提取总RNA,测定RNA浓度,分别逆转录为cDNA,采用Sybr Green试剂盒进行荧光定量PCR检测,目的基因及管家基因在不同的反应管中进行扩增,反应体系均为20μl。引物序列:TERT:Forw ard 5’-CTAGCATCCTGCTGCTACGC-3’,Reverse 5’-AGGGGACAGGGTTAGTCCAA-3’; LEF-1:Forward 5’-TCAGGCAAGCCTACCCATCTTC-3’,Reverse5’-GGGTGCTCCTGTTTGACCTGA-3’;TCF-4:Forward 5’-TCCCAGTACTACC CATATTCCAGCA-3’,Reverse 5’-AGTCCCTG TTGTAGTCGGCAGTG-3’;β-Actin:Forward 5’-GGGTCCTCTGTGAACTTGCTC-3’,Reverse 5’-TGTAATCCTGTGGCTTGTCCTC-3’。反应条件:95℃变性20min,95℃30s,60℃1min,40个循环。采用实时荧光定量PCR仪监测记录数据,结果根据标准曲线由软件自动计算后得出。验证该方法的重复性和扩增效率。本实验重复3次。
1.9 统计学处理 采用SPSS16.0统计软件进行数据分析,数据以均数±标准差表示。两组间比较采用独立样本t检验;进行多组间比较时,P值进行Bonferroni校正。P<0.05为差异有统计学意义。
2.结果
2.1 大鼠股骨密度测定结果 双能X线检测结果显示随着年龄的增殖大鼠股骨密度显著降低。我们所检测的3月龄雄性大鼠股骨密度为0.394±0.0491g/cm2,18月龄雄性大鼠股骨密度为0.2540±0.0437g/cm2,其显著低于3月龄组(P<0.05,图1)。
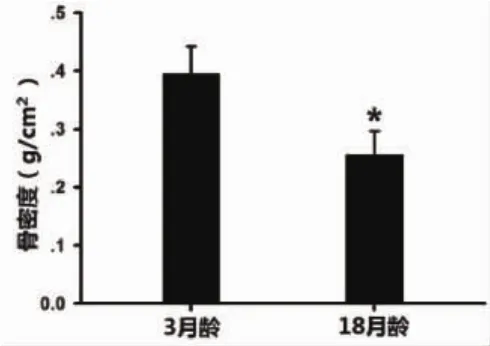
图1 大鼠股骨密度检测(*P<0.05)
2.2 SA-β-Gal染色检测BMSCs增龄性变化将3月龄及18月龄大鼠BMSCs均匀接种,常规培养待细胞密度达到80%后进行SA-β-Gal染色。镜下观察细胞形态为长梭形,胞突略短,胞浆饱满,细胞状态良好。此外,2组均可见BMSCs成功染色,浅蓝色为阳性,3月龄组少数细胞染色阳性,18月龄组细胞染色阳性数目较多(图2A)。随后我们将染色后细胞进行显微镜下计数,统计染色阳性细胞百分比,经10个视野的综合统计分析可见18月龄BMSCs SA-β-Gal染色阳性率高达37.902%,显著高于3月龄组BMSCs(P<0.05,图2B)。为了进一步验证BMSCs的衰老程度,我们从基因水平检测了TERT的表达,结果显示18月龄BMSCs表达量显著低于3月龄组(P<0.05,图2C)。

图2 3月龄及18月龄BMSCs SA-β-gal染色结果及TERT mRNA的相对表达量
2.3 增龄因素对BMSCs炎症因子分泌量的影响 将3月龄及18月龄大鼠P3代BMSCs种到24孔板中,细胞贴壁72小时候提取细胞上清液进行ELISA检测。在提取的细胞外基质中均检测到了炎症因子TNF-α及IL-6。检测结果显示18月龄大鼠BMSCs所分泌的TNF-α(P<0.05,图3A)及IL-6(P<0.05,图3B)均显著高于3月龄BMSCs的炎症细胞因子分泌量。

图3 3月龄及18月龄大鼠BMSCs培养液中炎症因子TNF-α及IL-6的分泌量
2.4 增龄因素对大鼠BMSCs Wnt/β-catenin信号通路的影响 由于Wnt信号通路骨发育及骨再生中发挥重要作用,在上述实验的基础上我们对经典Wnt/β-catenin信号通路的关键蛋白及基因进行检测。首先我们分离提取3月龄及18月龄BMSCs的全细胞蛋白并进一步分离提取了细胞核蛋白。分别将3月龄及18月龄BMSCs的全细胞蛋白及细胞核蛋白进行Western Blot检测,检测结果显示18月龄BMSCs无论全细胞蛋白还是细胞核蛋白的表达量均高于3月龄BMSCs组(图4A)。Real Time PCR检测结果显示Wnt通路关键基因LEF-1及TCF-4在18月龄大鼠BMSCs中的表达显著高于3月龄BMSCs组(P<0.05,图4B)。
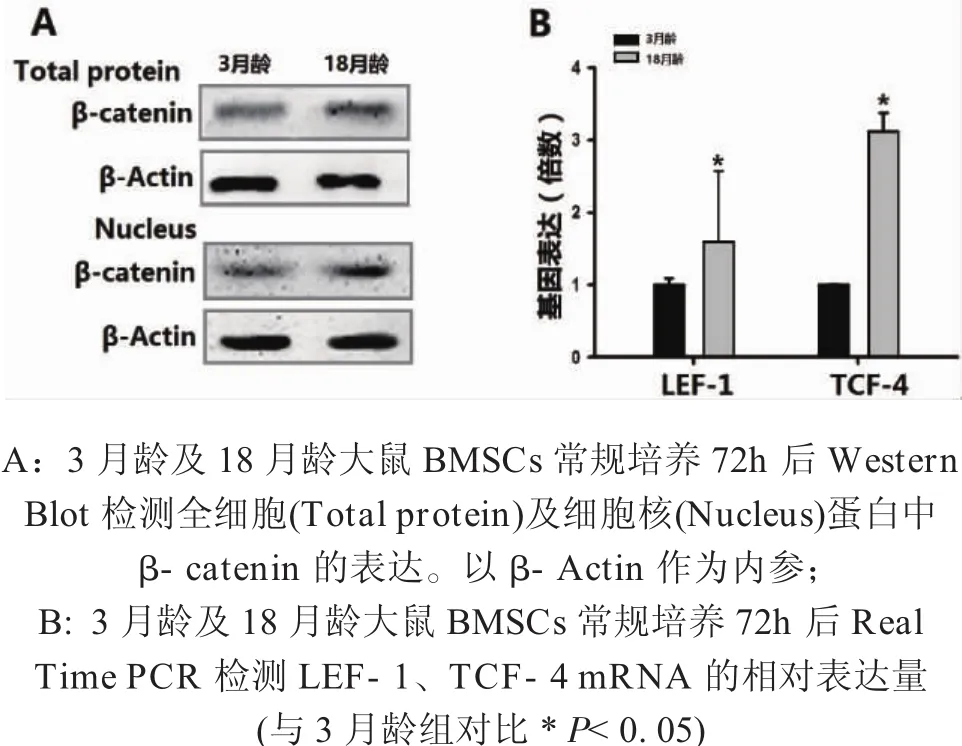
图4 3月龄及18月龄大鼠BMSCs常规培养72h后β-catenin蛋白的表达量及LEF-1、TCF-4 mRNA的相对表达量
3.讨论
干细胞在机体中处于一种平衡状态,但是随年龄的增长,干细胞的功能受到一定影响,其平衡遭到破坏。机体增龄过程中,间充质干细胞的自我调节机制发生改变,从而使其某些生物学性状不再稳定,主要表现为自身抵抗力的降低及其对外界环境刺激的反应能力的降低。骨髓间充质干细胞在骨骼发育和重建过程中发挥着重要作用,前期有文献报道随着小鼠年龄的增加BMSCs的增殖能力及成骨分化能力均受显著抑制[8]。另有研究表明骨髓间充质干细胞的增殖能力随着年龄增长或分裂次数的增加而下降,来自老年供体的间充质干细胞的增殖能力和抗凋亡能力均低于年轻供体来源的细胞[9]。
由于前期研究证实长期体外培养后间充质干细胞可能在基因表达、增殖和分化能力等方面发生变化甚至发生恶性转化[10],因此,本研究采用的是收集不同年龄阶段大鼠的股骨骨髓进行骨髓间充质干细胞的分离培养,在此基础上进行增龄因素对大鼠BMSCs的影响及可能的机制。首先我们通过对实验动物的检测发现随着年龄的增殖大鼠股骨密度显著降低,在此基础上我们再进一步进行干细胞衰老情况的鉴定。SA-β-Gal是被广泛认可的经典细胞衰老标记物之一[11],因此我们应用衰老相关β半乳糖苷酶染色试剂盒对两组BMSCs的SA-β-Gal的表达水平进行检测,染色结果显示两组BMSCs均有蓝色沉淀形成,但是18月龄组BMSCs蓝色沉淀的数量、面积等显著高于3月龄组,这也与前期的报道一致[11]。端粒相对长度和端粒酶活性也是细胞增龄和衰老的重要指标,端粒酶是一种逆转录酶,由RNA和蛋白质组成,是以自身RNA为模板,合成端粒重复序列,加到新合成DNA链末端。因此,细胞每有丝分裂一次,就丢失一段端粒序列,当端粒长度缩短至一定程度,细胞停止分裂导致衰老与死亡。端粒酶逆转录酶(telomerase reverse transcriptase,TERT)起源于反转录转座子,在其他辅助酶作用下利用RNA合成DNA,TERT是端粒酶起作用的关键结构和主要调控亚单位,可通过逆转录端粒酶R NA模板序列,合成端粒DNA重复序列并添加到染色体末端,从而延长端粒长度[12]。本课题应用 qRT-PCR对两组BMSCs的端粒酶mRNA表达水平进行相关检测。结果显示18月龄BMSCs TERT表达量显著低于3月龄BMSCs组。
前期研究表明随着年龄的增长,机体功能在逐渐发生变化,当增龄性变化达到衰老程度时,天然免疫被激活并产生促炎介质,炎症因子的水平会呈现不同程度的升高[13]。近期研究证实衰老与炎症是相互作用的,衰老过程常伴随炎症稳态失衡,而炎症又可导致衰老的发生发展[14]。我们通过将3月龄及18月龄大鼠BMSCs所分泌的TNF-α及IL-6进行对比,结果证实随着年龄的增长BMSCs所分泌的细胞因子的水平显著增高,这些结果与前期研究结果一致,表明增龄性变化会引起机体免疫水平的改变,使其炎症因子表达增高进而使机体各器官产生衰老相关表型。在增龄性骨代谢过程中骨质及骨量都会随着年龄的增加而减少,炎症因子水平的升高会直接影响骨髓腔的微环境,TNF-α及IL-6水平的长期持续增高可以导致干细胞成骨分化能力的降低,并抑制干细胞的骨再生潜能。阐明增龄性骨代谢异常的作用机制并探寻增强增龄性BMSCs成骨分化能力是近期研究的热点。
Wnt家族蛋白是体内一类重要的调节蛋白,参与机体生长发育、干细胞自我更新及肿瘤发展过程,同时在维持骨稳态中也起到重要作用。有文献报道Wnt3a+/-雄性小鼠骨质含量较正常下降[15]。另有研究表明Wnt经典信号通路抑制成骨作用的原因是成骨细胞的转录因子的表达水平降低以及抑制在成骨过程中发挥重要作用的c-JNK以及P38MAPK,Wnt经典信号通路的高表达能够抑制hMSC形成新生骨[16]。在骨髓微环境中,β-catenin需要长期的表达来维护原始造血细胞的能力[17]。本研究中我们分别提取了3月龄及18月龄大鼠BMSCs的全细胞蛋白及细胞核蛋白,我们的实验结果表明,随着年龄的增加细胞核内的β-catenin聚积量显著增高,全细胞蛋白中的β-catenin表达水平也呈上升趋势,这提示Wnt经典信号通路的激活是增龄性骨代谢异常的重要因素。另外,经典Wnt通路通过转录因子TCF/LEF和FOXO与β-catenin特异性关联从而影响老化过程。这些转录因子的胞内水平以及它们在核内的定位与细胞老化密切相关。细胞内不同的wnt通路水平调控着老化过程。当β-catenin与TCF/LEF结合时,可以减缓老化;当β-catenin与FOXO结合时,可以加速细胞衰老[18]。此外,已经进入到细胞核内的β-catenin与 TCF/LEF结合后可启动 Runx2、c-myc、cyclinD等靶基因,促使细胞进入S期,进而促进成骨细胞的分化、发育与成熟。本研究的qRT-PCR结果显示,18月龄组BMSCs随着细胞核内β-catenin聚积量增高Wnt经典信号通路被激活,细胞核内的转录因子LEF-1、TCF-4的表达水平显著增高,这两种转录因子的增高会影响BMSCs的增殖能力。
本研究通过对比研究不同年龄阶段BMSCs的炎症细胞因子分泌水平及Wnt经典信号通路关键基因及蛋白的变化,探索增龄因素影响下BMSCs生物学行为异常的发生机制。在机体的增龄至衰老过程中其表观遗传的变化,如干细胞数量的变化、自我更新及增殖能力的变化、多项分化潜能的变化对其有一定的影响,在这个过程中干细胞所处的微环境变化发挥同样重要的作用。本研究发现随着年龄的增长机体的炎症因子表达水平会有所增高,这也是干细胞功能变化的重要干扰因素,此外还发现Wnt/β-catenin信号通路在此过程中发生明显变化,基于此后期我们将系统研究增龄导致干细胞功能变化的作用机制,为提高增龄条件下干细胞增殖及成骨分化能力提供理论依据。
[1]Polymeri A,Giannobile WV,Kaigler D.Bone Marrow Stromal Stem Cells in Tissue Engineering and Regenerative Medicine[J].Horm Metab Res,2016,48(11):700-713
[2]Gu Z,Tan W,Feng G,et al.Wnt/β-catenin signaling mediatesthesenescenceof bonemarrow-mesenchymal stem cells from systemic lupuserythematosuspatients through thep53/p21 pathw ay[J].Mol Cell Biochem,2014,387(1-2):27-37
[3] Zhang DY,Pan Y,Zhang C,et al.Wnt/β-catenin signaling induces the aging of mesenchymal stem cells through promoting the ROSproduction[J].Mol Cell Biochem,2013,374(1-2):13-20
[4] Li X,Liu N,Wang Y,et al.Brain and muscle aryl hydrocarbon receptor nuclear translocator-like protein-1 cooperatesw ith glycogen synthasekinase-3βto regulateosteogenesis of bone-marrow mesenchymal stem cells in type 2 diabetes[J].Mol Cell Endocrinol,2017,440:93-105
[5] Liu W,Qi M,Konermann A,et al.The p53/miR-17/Smurf1 pathw ay mediates skeletal deformities in an age-related model via inhibiting the function of mesenchymal stem cells[J].Aging(Albany NY),2015,7(3):205-218
[6] 刘 娜,李 华,张 洋,等.炎症微环境作用下非经典Wnt/Ca2+信号通路对牙周膜干细胞成骨分化的影响[J].中华老年口腔医学杂志,2015,13(5):257-262
[7] Zhang B,Liu N,Shi H,et al.High glucose microenvironments inhibit the proliferation and migration of bone mesenchymal stem cells by activating GSK3β[J].J Bone Miner Metab,2016,34(2):140-150
[8]Liao L,Shi B,Chang H,et al.Heparin improves BMSC cell therapy:Anticoagulant treatment by heparin improves the safety and therapeutic effect of bone marrow-derived mesenchymal stem cell cytotherapy[J].Theranostics,2017,7(1):106-116
[9]Li C,Wei G,Gu Q,et al.Donor Ageand Cell Passage Affect Osteogenic Ability of Rat Bone Marrow Mesenchymal Stem Cells[J].Cell Biochem Biophys,2015,72(2):543-549
[10]Vassilev A,DePamphilis ML.Links betw een DNA Replication,Stem Cellsand Cancer[J].Genes,2017,8(2)pii:E45
[11]Debacq-Chainiaux F,Erusalimsky JD,Campisi J,et al.Protocols to detect senescence-associated beta-galactosidase(SA-betagal)activity,a biomarker of senescent cells in cultureand in vivo[J].Nat Protoc,2009,4:1798-1806
[12]Wang F,Pan X,Kalmbach K,et al.Robust measurement of telomere length in single cells[J].Proc Natl Acad Sci U S A,2013,110:e1906-1912
[13]Revuelta M,Matheu A.Autophagy in stem cell aging[J].Aging Cell,2017,16(5):912-915
[14]Mendelsohn AR,Larrick JW.Inflammation,Stem Cells,and the Aging Hypothalamus[J].Rejuvenation Res,2017,20(4):346-349
[15]Moschouris P,Retzepi M,Petrie A,et al.Effect of Wnt3a delivery on early healing events during guided boneregeneration[J].Clin Oral Implants Res,2017,28(3):283-290
[16]Liu G,Vijayakumar S,Grumolato L,et al.Canonical Wnts function as potent regulators of osteogenesis by human mesenchymal stem cells[J].JCell Biol,2009,185(1):67-75
[17]Nemeth MJ,Mak KK,Yang Y,et al.beta-Catenin expression in the bone marrow microenvironment is required for long-term maintenance of primitive hematopoietic cells[J].Stem Cells,2009,27(5):1109-1119
[18]Marchand A,Atassi F,Gaaya A,et al.The Wnt/betacatenin pathw ay is activated during advanced arterial aging in humans[J].Aging Cell,2011,10(2):220-232

