三种内阿米巴原虫巢式多重PCR检测方法
, , , , , , , 文超*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.六安市动物疫病预防与控制中心,安徽 六安 237000)
溶组织内阿米巴(E.histolytica) 又称痢疾阿米巴,是目前唯一已确定具有致病性的内阿米巴原虫,全世界约有5 000万人感染,每年导致10万人死亡,其死亡率在原虫寄生虫病患者中仅次于疟疾[1-4]。迪斯帕内阿米巴(E.dispar)是与溶组织内阿米巴形态相同,生活史相似的另一虫种。全世界约有5亿人感染内阿米巴,其中很大一部分为迪斯帕内阿米巴。莫氏内阿米巴(E.moshkovskii)为一种非致病性的内阿米巴原虫,但经常出现在人、鼠、非人灵长类等动物的粪便中。
从形态上看,E.histolytica的包囊或裂殖子阶段与寄生于人或非人灵长类肠道的非致病性E.dispar和E.moshkovskii难以区分,因此传统的镜检方法难以区分不同的阿米巴原虫虫种[5]。尽管可通过粪便培养后利用同工酶分析区分E.dispar和E.histolytica,但该方法周期较长,且对试验设备的要求较高,难以普及应用[6]。因此,目前主要通过分子诊断方法对阿米巴原虫进行种类鉴定和基因分型,常用的靶基因有HLY6基因、16SrDNA、30-kDa蛋白基因等,其中16SrDNA基因已成为区分阿米巴原虫虫种的重要靶基因[7-8]。鉴于国内目前有关溶组织内阿米巴、迪斯帕内阿米巴和莫氏内阿米巴的分子检测方法报道较少,本试验根据3种内阿米巴原虫16SrDNA基因序列,建立一种能够检测上述3种内阿米巴原虫的巢式PCR方法,为其分子检测和防控提供简便可靠的技术工具。
1 材料与方法
1.1 虫体及基因组DNA
E.histolytica、E.dispar和E.moshkovskii包囊和滋养体均由实验室收集、保存,其中3种内阿米巴原虫包囊分离自单独感染上述阿米巴原虫的食蟹猴粪便(经镜检和3种阿米巴原虫特异的PCR方法鉴定[4]);3种内阿米巴原虫滋养体收集于上述粪便经培养后的带菌培养物。含有E.histolytica、E.dispar和E.moshkovskii16SrDNA片段的重组质粒为自制,并以检测符合要求,保存。100份食蟹猴粪便样品采集于实验动物猴场。
1.2 主要试剂
rTaq DNA聚合酶、10×PCR缓冲液、dNTPs和DNA MarkerDL2000均购于Takara公司;粪便DNA提取试剂盒天根生化科技(北京)有限公司产品(批号:DP328-02)。
1.3 主要仪器
PCR仪(Tgradient)购于德国Biometra公司;凝胶成像系统(Gel Doc XR+)购于美国Bio-Rad公司。
1.4 引物的设计与合成
参照Que等的方法,根据E.histolytica、E.dispar和E.moshkovskii的16SrDNA基因设计引物,由生工生物工程(上海)股份有限公司合成[8]。
1.5 巢式多重PCR反应
两轮PCR反应体系均为5 U/μL rTaq酶0.2 μL,2.5 mM dNTP 2 μL,10×PCR缓冲液2.5 μL,20 mol/L上、下游引物各0.25 μL,模板1 μL,加双蒸水至25 μL,其中第2轮PCR时用1 μL首轮PCR产物作为模板。巢式PCR首轮反应条件为96 ℃ 2 min、92 ℃ 60 s、56 ℃ 60 s、72 ℃ 90 s、共30个循环;72 ℃,7 min。三种阿米巴原虫的第二轮PCR反应条件相同,均为96 ℃ 2 min、92 ℃ 60 s、48 ℃ 60 s、72 ℃ 90 s、共30个循环、72 ℃ 7 min;分别用含E.histolytica、E.dispar和E.moshkovskii的人粪便DNA提取物作为相应的阳性对照。取10 μL PCR产物,1%琼脂糖凝胶电泳,于凝胶成像系统下观察,拍照。
1.6 特异性试验
分别把浓度相同的E.histolytica、E.dispar和E.moshkovskii重组阳性质粒DNA按同样稀释倍数单独、两两混合或三种混合后作模板,进行PCR扩增,以评价该PCR方法的特异性。
1.7 敏感性试验
1.7.1 巢式多重PCR检测阿米巴滋养体下限的确定 将E.histolytica、E.dispar和E.moshkovskii的滋养体用血细胞计数板计数后,然后分别将含106个E.histolytica、E.dispar和E.moshkovskii滋养体的溶液(各100 μL)混合后用PBS进行稀释。将上述稀释后的滋养体溶液分别加入到20 mg的无任何阿米巴原虫感染的食蟹猴粪便中,提取其基因组DNA后进行巢式多重PCR检测。
1.7.2E.histolytica、E.dispar和E.moshkovskii混合感染条件下巢式多重PCR检测阿米巴滋养体下限的确定 3种阿米巴原虫,分别固定其中2种阿米巴原虫滋养体数量(1 000个滋养体),对另外1种阿米巴原虫滋养体数量进行10倍系列稀释(范围从0.001~1 000个滋养体),从每个稀释液中各取1 μL作为首轮PCR模板进行巢式PCR扩增。
1.8 粪便样本的检侧
采集自国内某实验动物猴场的100份食蟹猴粪便样品,经提取粪便基因组DNA后,分别用单独检测E.histolytica、E.dispar和E.moshkovskii的单一PCR和巢式多重PCR进行检测,以验证巢式多重PCR方法的稳定性和重复性。
2 结果与分析
2.1 特异性试验
由图1可知,巢式多重PCR能够分别获同时扩增出3种不同的阿米巴原虫特异条带,E.histolytica、E.dispar、E.moshkovskii的特异条带大小分别为439、174、553 bp,条带大小区分明显。
2.2 敏感性试验

图1 E. histolytica、E. dispar和E. moshkovskii粪便样本的巢式多重PCR检测
注:M:DL2000 DNA Marker;1:E.histolytica单一扩增;2:E.dispar单一扩增;3:E.moshkovskii单一扩增;4:E.histolytica和E.dispar双重扩增;5:E.histolytica和E.moshkovskii双重扩增;6:E.dispar和E.moshkovskii双重扩增;7:E.histolytica、E.dispar和E.moshkovskii多重扩增。
2.2.1 巢式多重PCR检测阿米巴滋养体下限 由图2可知该方法可检测至1 000个滋养体/0.2 g粪便,因所用模板量为1 μL,而提取的基因组DNA溶解体积为50 μL,因此所建立的巢式多重PCR方法最少可检测到大约20个上述阿米巴原虫滋养体。

图2 巢式多重PCR敏感性试验
2.2.2E.histolytica、E.dispar和E.moshkovskii混合感染条件下巢式多重PCR检测阿米巴滋养体下限的确定 1 000个E.dispar和E.moshkovskii滋养体作为背景的情况下,巢式多重PCR方法可检测到最低0.01个E.histolytica滋养体(图3A),类似地,分别用1 000个其它另外两种阿米巴原虫滋养体作为背景的情况下,巢式多重PCR方法可检测到最低1个E.dispar(图3B)和0.1个E.moshkovskii滋养体(图3C)。
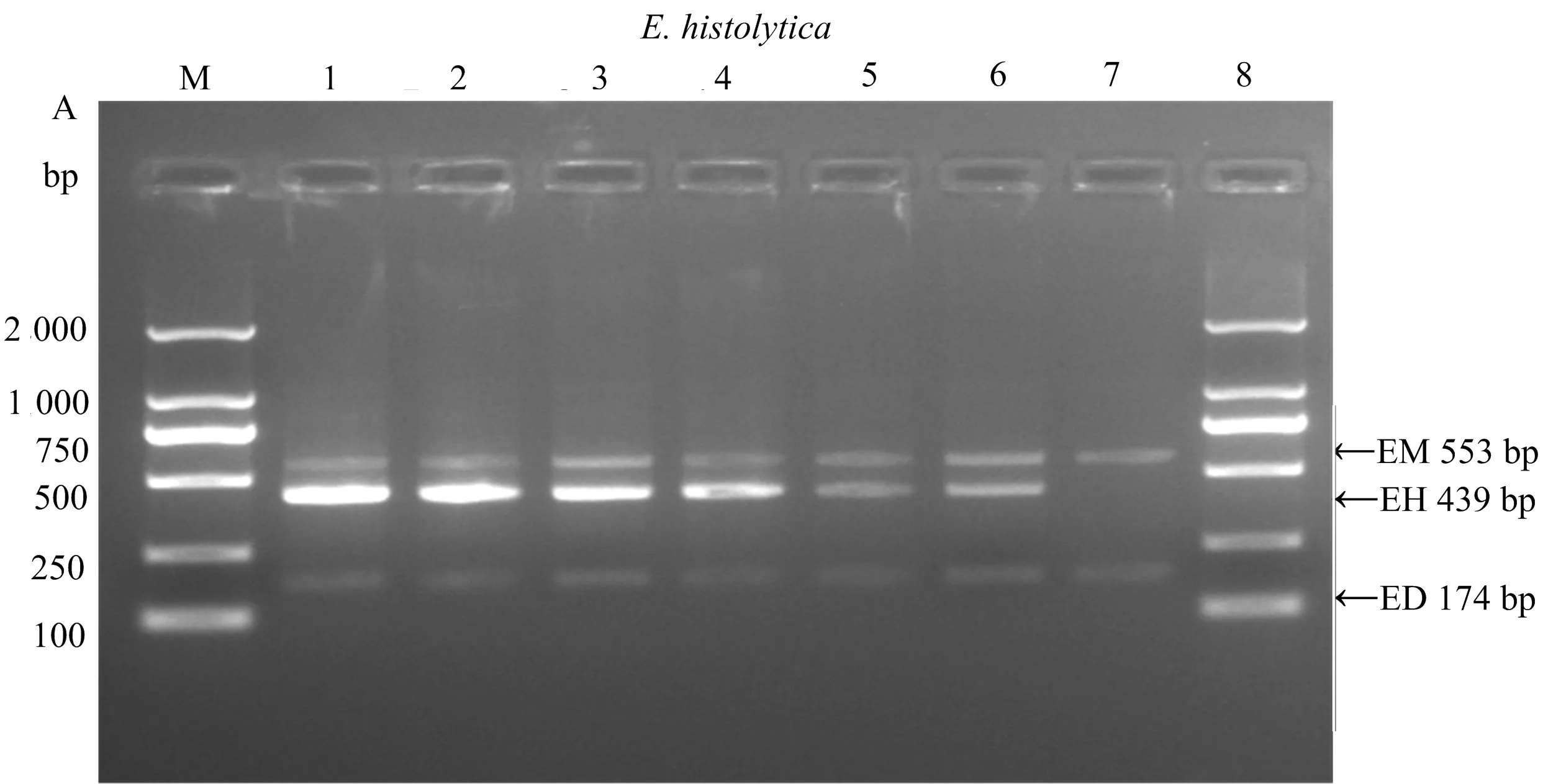


图3混合感染情况下分别检测E.histolytica(A)、E.dispar(B)和E.moshkovskii(C)的最小滋养体数量
Fig.3 Detection ofE.histolytica(A),E.dispar(B) andE.moshkovskii(C) in mixed cell lysates
注:M:DL2000 DNA Marker;1~7为分别加入1 000、100、10、1、0.1、0.01和0.001个其它两种阿米巴原虫滋养体。
2.3 验证性试验
用分别检测E.histolytica、E.dispar和E.moshkovskii的单一PCR方法对100份食蟹猴粪便样品进行检测,共检测出20份E.histolytica阳性,11份E.dispar阳性和1份E.moshkovskii阳性的样本,巢式多重PCR方法共检测出18份E.histolytica阳性,11份E.dispar阳性和1份E.moshkovskii阳性的样本,除2份E.histolytica样本巢式多重PCR方法未检出阳性外,其余样本用巢式多重PCR方法均检出阳性。
3 结论与讨论
有多种内阿米巴属原虫寄生于人和动物的肠道内,包括E.histolytica、E.dispar和E.moshkovskii、波列基内阿米巴(E.polecki)、结肠内阿米巴(E.coli)、哈氏内阿米巴(E.hartmanni)、恰氏内阿米巴(E.chattoni)等[1]。尽管从形态学上可以将部分内阿米巴虫种进行区分,但在实际中仅根据形态进行内阿米巴虫种鉴定难度较大,尤其是难以将E.histolytica、E.dispar和E.moshkovskii进行区分,以前的流行病学报道可能在一定程度上因检测方法的缺陷而高估了E.histolytica的感染率,这非常不利于疾病的诊断及防治,因此开发一种新的方便、快捷、敏感性高的检测方法准确鉴定和区分上述三种内阿米巴原虫势在必行。
本研究建立了能同时检测E.histolytica、E.dispar和E.moshkovskii的巢式多重PCR方法。对PCR检测方法而言,特异性和敏感性是评价其优良与否的关键指标,两者缺一不可[9]。特异性试验中靶基因的选择至关重要,因16SrDNA基因在不同内阿米巴虫种之间存在稳定的遗传偏差,且该基因在基因组上具有多拷贝性而使得该基因比单拷贝基因更易检测,因此本试验中选择16SrDNA基因作为靶基因[10]。本研究中特异性试验显示E.histolytica、E.dispar和E.moshkovskii均扩增出目的条带,目的条带大小分别为439、174和553 bp,3个目的条带能够明显区分,表明所建立的巢式多重PCR方法具有较强的特异性。敏感性试验显示该方法可检测混合感染粪便样品中阿米巴原虫滋养体的最小值约为20个,在固定其它两种内阿米巴原虫滋养体细胞数量的条件下,该方法能分别检测到最低0.01个E.histolytica、1个E.dispar和0.1个E.moshkovskii滋养体,显示该方法具有较高的敏感性。验证性试验也显示巢式多重PCR方法与单一PCR具有较高的一致性,可应用于临床粪便样本中3种内阿米巴原虫的检测。

