钛白副产物硫酸亚铁的精制研究
赵 蕾,王 富
(武汉华夏理工学院 生物与制药工程学院,湖北 武汉 430223)
二氧化钛是目前现阶段非常重要的一种无机颜料[1]。我国企业大部分用硫酸法生产二氧化钛,每生产1t二氧化钛就会产生3.5~4t的七水硫酸亚铁(俗称绿矾),这些副产的硫酸亚铁除了有很少一部分会用于生产净水剂和化肥,绝大部分都是直接排放到河流湖泊中,还有一些厂家直接将硫酸亚铁堆积在厂区里。这样的处理方法会对环境造成严重的污染并占据紧张的土地资源,而且人体一旦摄入了含有重金属的水资源就会对人体造成巨大的伤害。近来,人们对于环境问题和可持续发展的理念越来越重视,所以对于钛白副产物硫酸亚铁的精制研究引起了人们强烈的关注[2]。
硫酸亚铁除了用来生产颜料[3]外,还可用于制铁盐、氧化铁颜料、媒染剂、净水剂、防腐剂、消毒剂等[4-5]。目前,钛白副产物硫酸亚铁提纯的方法主要有:离子交换法、还原及重结晶法、硫化物除杂质法、絮凝剂分离法、空气氧化法除杂质,其中运用最多的是絮凝剂分离法和还原及重结晶法[6]。其中,重结晶只要是利用硫酸亚铁在水溶液当中溶解度随温度变化较大的原理,若硫酸亚铁的含量在90%~95%,就可以将溶液加热至80℃左右,然后将水溶液调节成饱和溶液,用H2SO4调溶液pH值=2.0~2.5,并在反应池内投入一定量的废弃铁片,使Fe3+还原成Fe2+;如果钛白副产物硫酸亚铁的含量低于90%,就要用还原重结晶法[7]。而絮凝剂分离法是指将钛白副产物溶解在水溶液中,然后加絮凝剂,同时使Ti,Si等小颗粒杂质形成絮状物,快速沉降分离[8]。
本文将钛白副产物绿矾通过铁粉还原金属杂质,再通过絮凝剂分离提纯,考察了不同的实验条件对硫酸亚铁纯度的影响,找出了最佳反应条件,从而提高硫酸亚铁资源的利用价值。
1 钛白副产物硫酸亚铁提纯的过程以及原理
1.1 钛白副产物的提纯过程
高钛白副产物硫酸亚铁→加铁屑→加硫酸调pH值→ 恒温加热水解→絮凝→离心分离→降温结晶→干燥→精制硫酸亚铁
1.2 钛白副产物的提纯实验过程
称取10 g钛白副产物溶于60 mL蒸馏水中,向溶液中加入3g铁屑用硫酸调节溶液的pH值,然后用恒温水浴锅进行加热记录加热时间。停止加热,趁热加入絮凝剂并且进行充分搅拌,过滤收集滤液。用KSCN检测Fe3+是否完全被还原成Fe2+。
1.3 硫酸亚铁溶液浓度的检测方法
1.3.1 高锰酸钾标准溶液的配置与标定
(1)KMnO4溶液的配置:称取KMnO4固体1.6 g溶于500 mL蒸馏水中,盖上表面皿加热至微沸并保持1 h,暗处放置2~3 d,用微孔玻璃漏斗过滤后置于棕色试剂瓶中备用。
(2)KMnO4标准溶液(0.02 mol/L)的标定:取基准草酸钠约0.2 g,精密称定,置于250 mL锥形瓶中,加新沸过的冷水50 mL与3 mol/L H2SO4溶液15mL,使溶解,向滴定管中迅速加入本液约30 mL,待褪色后,水浴上加热至65℃,继续滴定至溶液显微红色并保持30s不褪,即为终点(此时温度不能低于55℃)。平行滴定三次,记录数据按照下式计算KMnO4标准溶液的浓度。
式中:M-草酸钠的相对分子质量,134.00 g/mol。
1.3.2 提纯后硫酸亚铁溶液浓度的测定
向250mL锥形瓶中加入提纯后的硫酸亚铁溶液1.5 mL,用水稀释至20 mL左右,加入10 mL硫磷混合酸以高锰酸钾标准溶液滴定至溶液呈现粉红色在30s内不消失即为终点。
硫-磷混合酸:在冷却下向140mL水中加入30mL硫酸,再加入30mL磷酸。
硫酸(GB625):1+1溶液;
磷酸(GB1282):1+1溶液。
结果计算:溶液中硫酸亚铁含量X(g/mL)按下式计算
式中:X- 硫酸亚铁含量,g/mL;
c-高锰酸钾标准溶液的浓度,mol/L;
v-滴定硫酸亚铁溶液消耗的高锰酸钾标准溶液的体积,mL;
V-吸取的硫酸亚铁溶液体积,1.5mL;
M-硫酸亚铁的相对分子质量,152。
2 结果与讨论
2.1 实验室分析纯硫酸亚铁作标样
称取10g硫酸亚铁(FeSO4·7H2O)溶于60 mL蒸馏水中,完全溶解后吸取溶液1.5 mL加入到250 mL锥形瓶中,用水稀释至20 mL左右,加入10 mL硫磷混合酸以高锰酸钾标准溶液滴定至溶液呈现粉红色在30s内不消失即为终点。
2.2 初始pH值对钛白副产物硫酸亚铁提纯的影响
实验在其他条件都相同的情况下,通过改变溶液的初始pH值比较出不同初始pH值对产品纯度的影响,其结果如图1。

图1 初始pH值对产品纯度的影响
由图1可知,当溶液的初始pH值为1.0时水解反应基本上不进行;当溶液的初始pH值低于3.0时,溶液中的酸性较强,抑制了钛离子进行水解反应;溶液的初始pH值大于3.0时溶液中的Fe2+容易被氧化成Fe3+,所以容易产生氢氧化铁沉淀,从而使得产品纯度有所降低。故最佳溶液的初始pH值为3.0,此时产品的纯度达到最大值为96.8%。
2.3 水解温度对钛白副产物硫酸亚铁提纯的影响
不同水解温度对产品纯度的影响如图2所示。
由图2可知,温度对于硫酸亚铁提纯的影响非常明显,升高溶液的温度有利于水解反应的进行,当溶液的温度达到80℃时继续升高温度使得溶液中水解产生的水合二氧化钛沉淀部分分解,所以影响到最后的硫酸亚铁的纯度。故最佳水解温度为80℃。
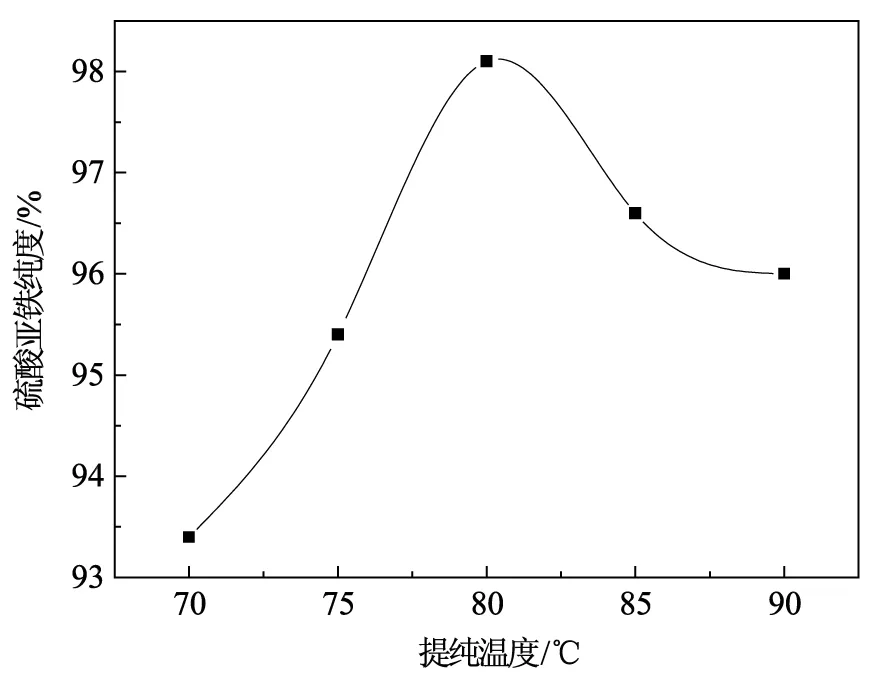
图2 水解温度对产品纯度的影响
2.4 水解溶液浓度及反应时间对钛白副产物硫酸亚铁提纯的影响
不同水解溶液浓度及反应时间对产品纯度的影响如图3所示。
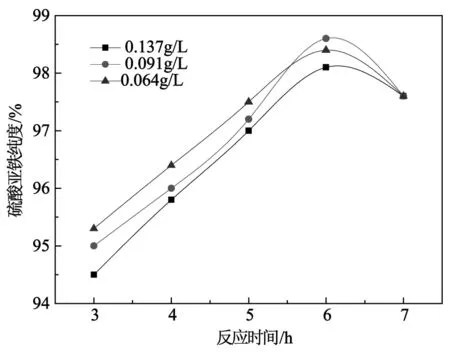
图3 水解溶液浓度对产品纯度的影响
从图3中可以看出,溶液浓度对于硫酸亚铁的纯度影响不明显,最佳的溶液提纯浓度为0.091 kg/L。当反应时间进行到6 h时,三组溶液浓度条件下硫酸亚铁的纯度都达到了最大值,再延长反应时间就造成部分水合二氧化钛沉淀分解使产品纯度均有所降低。
2.5 絮凝对钛白副产物硫酸亚铁提纯的影响
加絮凝剂进行除杂时,通过改变溶液的温度、改变絮凝剂的量、电磁搅拌器的转速、絮凝时长来进行。经过多次的实验发现进行絮凝除杂实验的最佳溶液温度为50~60℃,当溶液的温度低于50℃有硫酸亚铁晶体析出,对后续的杂质分离过程不利,当溶液温度高于60℃时,可能由于絮凝剂性能的改变使得絮凝的效果不太理想;最后得到,最佳的絮凝条件为絮凝剂的投加量在1.3 mg/L,以70 r/min慢速搅拌15min时为最佳,实验后得到的硫酸亚铁纯度能够达到98%。
2.6 结晶过程对钛白副产物硫酸亚铁提纯的影响
将离心过滤后的溶液进行结晶,结晶时将温度控制在20℃,实验时主要是以控制搅拌器的转速为主。最后得到的硫酸亚铁经过搅拌的粒径较小,未搅拌的粒径比较粗大,纯度也有所降低,可能是由于颗粒的粒径较大夹带水分使得滴定的结果偏低,实验结果显示搅拌器的搅拌速率设定为50r/min时的结晶效果最好。
3 结束语
3.1 钛白副产物硫酸亚铁的精制方法
钛白副产物硫酸亚铁中含有的大量杂质元素的除杂方法是:将定量的副产物溶液溶解在蒸馏水中,然后通过用硫酸调节其pH值,并加入过量的铁屑到溶液中,加热至沸腾可以使得钛水解生产偏钛酸并以沉淀的形式析出,加入絮凝剂,使水合二氧化钛和其他的杂质形成沉淀通过过滤分离,而且加入的铁屑可以除去溶液中的Fe3+、Cu2+、Pb2+等离子。提纯的流程为:先加硫酸和铁屑进行水解-絮凝-过滤-结晶-干燥。
3.2 钛白副产物硫酸亚铁的最佳精制条件
最佳的实验条件:溶液的初始pH值控制在3.0,溶液的温度控制在80℃,水解溶液浓度对钛白副产物绿矾提纯的影响不明显,絮凝的最佳水温控制在50~60℃,絮凝剂的投加量控制在1.3 mg/L以70 r/min慢速搅拌15min,结晶时温度控制在20℃搅拌的速率控制在50 r/min。
[1]唐振宁.钛白粉的生产与环境治理[M].北京:化学工业出版社,2000.
[2]程文敢.硫酸法钛白副产硫酸亚铁制取氧化铁红的研究[J].福建化工,2000(2):25-27.
[3]李功军.钛白副产硫酸亚铁制备氧化铁系列颜料的研究[D].湘潭:湘潭大学,2004.
[4]景海艇,郑晓冬.硫化亚铁作为锂离子电池负极材料的电化学性能研究[J].化学工程与装备,2015(5):7-9.
[5]曹人玻.以钛白副产物绿矾为原料低温制备纳米三氧化二铁的研究[D].广州:华南理工大学,2011.
[6]郑晓虹,林智虹.用还原焙烧法从硫铁矿烧渣中提取铁的研究[J].河南科学,2003,21(6):713-716.
[7]谢全模,胡文方,张 莉,等.废渣绿矾精制高纯度硫酸亚铁的研究[J].河南化工,2007,24(11):33-35.
[8]郑明凯,杨为学.利用钛白副产绿矾和废酸制备氧化铁黄的研究[J].中国资源综用,2011,29(8):22-25.

