水貂变形杆菌病的检测与防治
张笑春,王瑛华,陈 刚
(肇庆学院生命科学学院,广东肇庆 526061)
变形杆菌(Proteeae)是一类大小、形态不一的细菌,有时呈球形,有时呈丝状,具有明显的多形性;周身鞭毛,能运动且运动活泼;无芽孢荚膜,需氧及兼性厌氧,为革兰氏阴性菌,属于肠杆菌科。变形杆菌病是各种动物均易感的一种传染病。水貂变形杆菌病主要由变形杆菌属细菌引起。近年来,不断有各种禽类、鹿、熊猫等动物感染变形杆菌的报道[1-4],同时也有变形杆菌感染水貂引起发病的相关报道[5-6]。
2015年3月某水貂养殖场的水貂每天死亡4~8只。病貂死亡前出现气喘,口吐血水、血沫,下痢等症状。用青霉素和土霉素对发病水貂进行治疗,未见好转。剖检病死貂,可见肺脏多为紫红色,有大量出血点,肺脏、气管切开后有泡沫状血水;胸腔大量积液,心脏、心包膜有出血点;肠道呈弥散性出血。经流行病学调查、临床诊断、病理剖检、实验室检验,鉴定为变形杆菌病。现将对该病例的诊断和治疗报告如下。
1 材料与方法
1.1 被检病料
病料来自畜主送检的水貂(貂场规模500只)。无菌条件下,取心、肝、脾、肺、肾等病变明显的内脏组织样品,4 ℃冷藏备用。
1.2 培养基和试剂
鲜血琼脂培养基、普通琼脂培养基、麦康凯培养基、十六烷琼脂培养基:按常规方法配置并灭菌,在无菌条件下制成平板培养基;大豆肉汤培养基:按常规方法配制[7];革兰氏染色液和细菌生化微量鉴定管:购自杭州天和微生物试剂有限公司。
1.3 试验动物
12只健康昆明小白鼠(4周龄、平均体重20 g)。
1.4 犬瘟热和犬细小病毒检测
使用犬瘟热病毒快速检测试纸、犬细小病毒快速检测试纸条(韩国安捷公司)进行检测。严格按照生产商说明书,垂直滴加4滴无气泡样本混合液于试纸卡加样孔(S)内,开始计时。阳性结果为:除质控区(C)外,另有1条粉红色带出现在检测区(T)。阳性结果表示加入样本中含有犬瘟热或犬细小病毒抗原。
1.5 细菌分离与镜检
在无菌条件下,对水貂病变部位进行涂片、镜检;发现有细菌存在后,用灭菌接种环挑取病死水貂的病变部位,接种于十六烷琼脂平板、普通营养琼脂平板、麦康凯平板、全血琼脂平板,37 ℃培养1 d;挑取单个菌落涂片,革兰氏染色后镜检。
1.6 细菌鉴定
各种糖(醇)发酵试验:在无菌条件下,用接种针将分离的细菌接种到发酵微量管中,恒温置于生化培养箱培养1 d后,观察结果并记录。
其他试验:按常规方法分别进行脲酶试验、触酶试验、硫化氢试验、MR试验和VP试验。
1.7 药敏试验
按姚火春[8]的圆纸片扩散法,即用灭菌棉球擦拭涂布器后,蘸取纯培养物制成的细菌悬液,均匀涂布于普通营养琼脂表面,盖好平皿;在室温干燥5 min,待平板表面稍干即可放置药敏片;用灭菌镊子无菌操作取出药敏片,贴在涂有细菌的平板培养基表面[9],于恒温培养箱中37 ℃培养16~18 h,观察结果。
1.8 动物试验
将体重为20 g左右的12只健康小鼠随机分为2组,分别是攻毒组、空白对照组,每组6只。攻毒组小鼠腹腔注射0.2 mL109cfu 的变形杆菌肉汤稀释液;空白对照组小鼠腹腔注射0.2 mL无菌肉汤液。连续观察2 d,记录小鼠的存活情况;剖检死亡小鼠观察病变,并取心脏、肝脏进行细菌分离鉴定。
2 试验结果
2.1 病毒检测
犬瘟热与犬细小病毒检测均为阴性;除质控区(C)外,未见有粉红色带出现在检测区(T),说明病貂体内不含有犬瘟热与犬细小病毒。
2.2 细菌形态
经染色镜检可见革兰氏阴性、单个或成对的球杆状、长丝状或短链状多形性杆菌;以杆状为主,多为单个存在,无芽胞和荚膜。
2.3 分离培养
该菌在十六烷琼脂培养基中生长良好,呈薄膜状扩散、厚薄交替呈层层波状的同心环样菌苔。在普通琼脂平板上形成半透明、光滑菌落,边缘有迁徙生长现象。在鲜血琼脂培养基上有薄膜样菌落生成,无溶血现象。在麦康凯琼脂培养基上有半透明、光滑、粉色菌落。
2.4 生化试验
该菌经培养后可以分解葡萄糖、乳糖、木糖;甘露醇、硫化氢、脲酶、触酶、MR、苯丙氨酸、半乳糖、甘露醇试验阳性(在种间有不同的反应)。这些与变形杆菌的生化特性基本相符(表1)。

表1 生化试验结果
2.5 药敏试验
通过药敏试验发现,该菌对丙氟哌酸及奥复星敏感,对阿米卡星中等敏感,对其他药物不敏感(表2)。抗菌药物的抑菌环与敏感标准见表3。
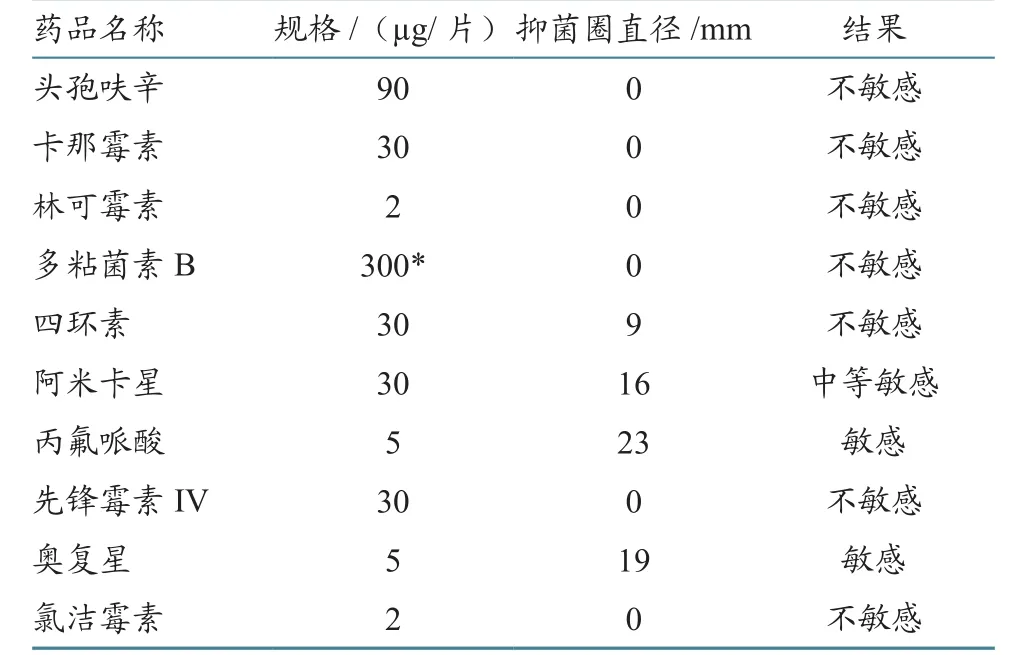
表2 分离菌药敏试验结果
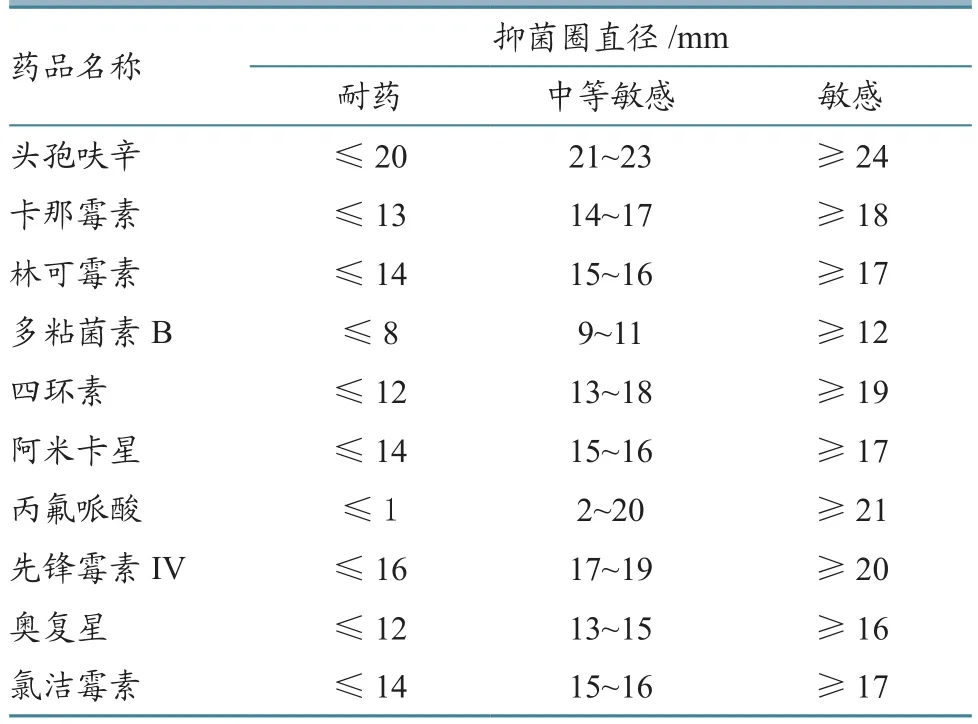
表3 抗菌药物的抑菌环与敏感标准
2.6 动物试验
攻毒组,注射3 h后小鼠出现呼吸急促、腹泻、阵痛、精神沉郁等症状,1 d内小鼠无死亡;扑杀剖检其中3只,可见小鼠脾脏肿大,肝脏发黄,肠道水肿、臌气;从肝脏、心脏中均分离出变形杆菌;1~2 d内有3只小鼠死亡。空白对照组,6只小鼠在2 d内无异常反应;扑杀后分离不到任何细菌。经生化试验、细菌学试验鉴定,证实小鼠体内分离的细菌和从水貂体内分离的细菌是同一种菌。
3 讨论
3.1 水貂变形杆菌病的病理变化特点
变形杆菌是一种食源性条件致病菌,是肠道内正常菌群,广泛存在于水、泥土和被粪便污染的物质之中,一般情况下不致病,但在特殊条件下可引起动物发病,是引起医源性感染的重要条件致病菌,在临床上常为混合感染或继发感染。近年来,该菌在发病水貂体内经常分离到,给广大养殖户造成很大经济损失,因此应引起水貂养殖业的高度重视。水貂感染变形杆菌的典型病理变化是肺脏淤血,呈鲜红色,个别边缘坏死,胸腔大量积液,心脏、心包膜有出血点;肠道呈弥散性出血;肠系膜淋巴结肿大,脾脏呈深红色,上有淤血斑,肾脏呈深红色,上有出血斑,甚至化脓灶。本病例中患病水貂症状与该病的典型症状基本一致。
3.2 初步诊断注意事项
接诊病例时,应以浅显明确的问讯方式向畜主了解情况。首先要了解貂场情况、发病史、免疫情况,然后对饲养水平做出基本判断。正常情况下变形杆菌属致病机理主要有以下两个方面:(1)由于机体防卫功能减弱,引起自身感染;(2)由于正常菌群寄居部位改变,发生了定位转移,引起疾病[10]。所以,消除诱发因素是防治变形杆菌病的重要手段。
3.3 药物治疗与药敏试验
针对水貂变形杆菌病,使用土霉素对发病水貂养殖场进行大群投喂,在辽宁省的效果不明显,后改用喹乙醇,每只每次30 mg入饲料中投喂,2次/d,3~4 d后病情得到控制[11]。在药敏试验中,四环素对细菌生长抑制和杀灭作用不明显,因此临床使用土霉素对发病水貂的治疗效果不佳。在使用药物治疗细菌病时,最好先进行药敏试验,再选择对该菌敏感的药物进行治疗。这样既可以节省成本,缩短治疗时间,亦可达到良好的治疗效果。根据本试验中的药敏试验结果及各地区用药治疗情况,对该病例采用口服丙氟哌酸和补液盐,在饮水中加入适量水溶性维生素,投服葡萄糖粉和维生素E粉等措施,病情得到基本控制。在用药期间要注意饲喂优质且易于消化的饲料,补充营养,若水貂下痢严重,要注意补充电解质。
同时应做好消毒隔离工作,避免病菌扩散。将病死貂和扑杀的病重貂深埋,清除养殖舍内粪便并集中烧毁;对貂舍、饲具,用百毒杀消毒药水喷洒消毒或用3%~5%来苏儿、10%石灰乳、15%漂白粉进行消毒;舍外则选用20 g/ L 的烧碱喷洒消毒,以达到彻底消灭病原菌的目的;严禁非饲养人员不经防护随便进出貂舍,以防止疾病传入。
3.4 预防措施
据了解,水貂发病前,水貂养殖场所在地区出现了暴雨天气,加上饲养场内排水不畅,出现大量积水,饲料也进行了更换,所以环境因素及饲料的变更是这次疾病暴发的重要原因。变形杆菌广泛存在于水、土壤中的腐败有机物,以及人和动物的肠道中,为条件致病菌,多为继发感染。因此,做好饲料卫生,加强日常饲养管理,对于预防本病的发生具有重要作用。在饲养中,饲养员应注意观察水貂的饮食和健康状况,保证饲料营养全面,以免因营养不均衡造成机体抵抗力下降而引发疾病。
4 结论
本试验通过细菌分离培养、细菌生化试验、药敏试验及动物试验,同时进行病毒检测,最终诊断致病菌为变形杆菌。该病多以呕吐、腹泻为主要临床症状,病理变化多呈现全身性出血性败血症表现。随后通过药敏试验发现变形杆菌对丙氟哌酸和奥复星敏感,对阿米卡星中等敏感。本次治疗采用对该菌最为敏感的丙氟哌酸进行治疗,配合补液,最终达到了良好的治疗效果。
[1] 虞德屏,阳艳,朱梦代,等. 肉鸡奇异变形杆菌病的诊断与治疗[J]. 中国家禽,2005,27(10):23.
[2] 许海峰. 雏鸡奇异变形杆菌病的诊断[J]. 中国畜禽传染病,1997,96(5):45-46.
[3] 陈武. 鹿科动物奇异变形杆菌病的诊治[J]. 中国兽医杂志,2002,38(5):28-29.
[4] 陈武,黄勉,桑青芳. 小熊猫奇异变形杆菌病的诊治[J]. 畜牧与兽医,2003,35(9):28-29.
[5] 胡传伟,贾赟,简中友,等. 水貂奇异变形杆菌的分离与鉴定[J]. 经济动物学报,2006,10(2):77-79.
[6] 王建科,程悦宁,易立,等. 水貂奇异变形杆菌的分离鉴定及16S rRNA基因序列分析[J].中国畜牧兽医,2015,42(4):852-858.
[7] 陆承平. 兽医微生物学[M]. 3版. 北京:中国农业出版社,2004:248-254.
[8] 姚火春. 兽医微生物学试验指导[M]. 2版. 北京:中国农业出版社,2002:19-21.
[9] 洪秀华. 临床微生物学检验[M]. 北京:中国医药科技出版社,2004:140-145.
[10] 毕水莲,李琳,唐书泽,等. 变形杆菌属食物中毒的特点与防控措施[J]. 现代食品科技,2009,25(6):690-695.
[11] 王鹏. 一种耐药变形杆菌的分离、鉴定及其免疫学效应的实验研究[J]. 第一军医大学学报,2009,30(8):51-53.

