15N稳定同位素标记副溶血弧菌的培养基制备与培育
赵丽青,王 勇,黄小华,张晓良,刘恩德,胡 炜,孙 宇,吴振兴,贾俊涛,李正义
(1.山东出入境检验检疫局检验检疫技术中心,山东青岛 266002;2.贵州出入境检验检疫局,贵州贵阳 550000)
弧菌是海洋环境中最常见的细菌类型,维持着 正常的海洋生态环境。但有些弧菌对人类和海洋动物有害。1995年《美国临床微生物手册》(第六版)确定了弧菌中的致病菌有12种,其中最重要的是霍乱弧菌、副溶血弧菌(Vibrio parahaemolyticus)和创伤弧菌[1]。在烹饪不当或食物容器生熟不分时,致病性弧菌可引起胃肠炎、创伤感染和食物中毒等症状[2],因此美国食品药品管理局(FDA)、北欧食品分析委员会(NMKL)和我国卫生部都制定了相应的检测标准[3]。
近年来,副溶血弧菌引起的食物中毒比例较高,已成为沿海地区食物中毒的首要病原,其危害程度仅次于沙门氏菌、大肠杆菌和金黄色葡萄球菌[4]。副溶血弧菌的致病因子有溶血素、脂多糖、胞外蛋白酶、尿素酶及Ⅲ型分泌系统等[5-6]。在多种环境刺激下,如低温(冷链食品)、高盐(腌渍食品)、高温、酸和碱等,副溶血弧菌处于损伤状态,致病性会发生变化。如何有效监测受损的致病性弧菌,尤其是副溶血弧菌在多种环境中的残存状态,以及评估消费者最终暴露于副溶血弧菌等致病菌的可能性,具有重要的指导意义。
稳定同位素标记(Stable isotope probing,SIP)技术具有示踪、指示和判断的功能,其检测快速,结果准确,是了解致病菌受损过程中蛋白质和核酸动态变化的重要手段之一[7]。SIP技术主要包括两种不同的路线:一种称为代谢标记法,是以同位素标记的氨基酸形式在培养时加入;另一种称为化学标记法,是在蛋白质提取后,酶解前、中、后蛋白质的一些功能基团与含有稳定同位素标记的试剂发生化学反应。前者一般采用含有重稳定同位素型必须氨基酸的培养基对微生物进行培养,但是无论是采用微生物发酵法,还是有机化学合成稳定同位素标记氨基酸的方法,其成本高,工艺复杂,相关报道较少;后者采用蛋白质提取,使蛋白质功能基团(如肽段)与稳定同位素标记的试剂发生化学反应,虽然应用广泛,但副反应多,工艺复杂[8-9]。
本文提供了一种15N稳定性同位素标记副溶血弧菌培养基的方法。副溶血弧菌通过标记培养基进行多次转接培养,将菌细胞中氮原子置换成稳定同位素15N,再通过质谱法LC-MS/MS进行验证。在富含15N的培养介质中,生长繁殖的细胞内,蛋白质被标记。培养结束后,将正常介质(14N)中生长繁殖的细胞和被15N标记的细胞混合,破碎细胞,通过选择性亲和分离、色谱分离等过程,提取相关蛋白质,进行消化酶解,使其成为肽段,最后进行质谱分析。来自两个对比样本的每一肽段在质谱图中表现为对峰,峰的间距等于标记肽段中的15N原子数。通过比较质谱图中同位素标记内标物的对峰强度,便可确定对照细胞体系中蛋白质表达水平的差异。由于两个对比样本测定是在同一分析过程下完成的,因此具有很高的准确性;同时内标质谱法的信噪比高,测定灵敏度也较高。在传统的蛋白质研究中,质谱只能应用于蛋白质的鉴定,而不能用于定量分析。这是因为不同的蛋白质或多肽具有不同的离子化率,而用同位素标记差异质谱巧妙地解决了这个问题[10],从而为以后的蛋白质组学研究打下基础。
1 材料和方法
1.1 菌株
副溶血弧菌ATCC17802,购自美国菌种保藏中心。
1.2 仪器和试剂
仪器:液相色谱系统(Thermo Scientific EasynLC 1000), 质 谱 仪(Thermo Fisher Orbitrap Velos)。试剂:蛋白胨10 g/L,氯化钠30 g/L,蒸馏水1 L,NH4Cl 2 g/L,葡萄糖10 g/L,KH2PO40.6 g/L,KH2PO40.9 g/L,MgSO40.2 g/L,NaCl 20 g/L。
1.3 副溶血弧菌15N稳定同位素标记最优培养基的制备
培养基成分对副溶血弧菌的生长有显著影响。不同成分及各成分的用量和配比,不仅影响副溶血弧菌的产量和质量,而且也是决定生产成本的关键因素。碱性蛋白胨水是培养弧菌的通用配方,但是蛋白胨为有机氮源,无法进行15N标记。优化15N-副溶血弧菌培养基的制备,以15N-副溶血弧菌产量高、15N的投入成本低为原则。本研究在国标GB4789.7的基础上,设计了正交试验方法来优化碳源和氮源的用量和比例。
选择(NH4)2SO4、NH4Cl和尿素作为无机氮源,葡萄糖和乙酸钠为碳源,其他培养基成分(KH2PO4、K2HPO4、MgSO4和NaCl)固定,设计了“五因素、四水平”正交试验方案。
1.4 副溶血弧菌在15N稳定同位素标记培养基上的培育
将副溶血弧菌ATCC17802接种到3%氯化钠碱性蛋白胨水中进行第1次增菌,于36 ℃摇床条件下培养18 h;用接种环将第1次增菌的副溶血弧菌转接10环到15N稳定同位素标记培养基上,于36 ℃摇床条件下培养40 h;用接种环将第2次增菌的副溶血弧菌转接3环到15N稳定同位素标记培养基中,进行第3次增菌,于36 ℃摇床条件下培养36 h;用接种环将第3次中增菌的副溶血弧菌转接2环到15N稳定同位素标记培养基中进行第4次增菌,于36 ℃摇床条件下培养24 h。待上述培养达到所需菌量后,10 000 r/min离心5~10 min,收集第4次增菌的副溶血弧菌细胞。
使用15N稳定同位素标记培养基,连续多次转接培养副溶血弧菌。进行高丰度15N稳定同位素标记副溶血弧菌的逐步富集培养,驯化出高丰度15N稳定同位素标记副溶血弧菌。
1.5 蛋白提取
将收集的15N标记副溶血弧菌和碱性蛋白胨水培养的副溶血弧菌提白分别用PBS清洗1次,然后加入200 μL 8 mol/L尿素和蛋白酶抑制剂,冰浴超声(3 s、3 s、1 min、25%)。4 ℃、10 000 g离心10 min,去沉淀;使用Bradford法对蛋白进行定量;将总蛋白定量后取5 μg,将其还原烷基化后加入胰蛋白酶酶解。
1.6 副溶血弧菌细胞中蛋白质氮原子标记效率的LC-MS/MS验证
1.6.1操作 将酶解液10 000 r/min、4 ℃离心后取上清液,ZipTip脱盐,经离心浓缩仪干燥后,用0.1%甲酸溶液复溶,高速离心后取上清液注入LC-MS/MS仪器分析。
1.6.2质谱条件 取制备好的样品5 μL进行上样,设备为Thermo Fisher Orbitrap Velos。反向高效液相色谱条件(流动相)为A:0.1% Formic acid in water,B:0.1% Formic acid in Acetonitrile;流速为400 nL/min。质谱检测条件为轨道肼质谱仪Thermo fisher Orbitrap Velos
正离子扫描方式,一级质谱扫描范围375~1 300 m/z,250 ms,MS1resolution 为 60 000,选择一级图谱最高的50个峰进行二级扫描,扫描范围375~1 300 m/z,碰撞电压35 CID(表1)。

表1 色谱梯度
2 结果
2.1 15N稳定同位素最优培养基
试验计划及结果见表2。对表2进行方差分析,结果列见表3;对表2进行因素指标分析,结果见图1。
由表2分析可知,各因素对副溶血弧菌生长影响的次序由大到小为葡萄糖(4)>NH4Cl(2)> 乙酸钠(5)> 尿素(3)>(NH4)2SO4(1)。由表3分析可知,葡萄糖对副溶血弧菌的产量有极显著影响,其他因素影响不显著。由图1可知,本次正交试验的优化配方为(NH4)2SO4(3 g/L)、NH4Cl(2 g/L)和葡萄糖(10 g/L),不添加乙酸钠和尿素,此条件下的副溶血弧菌产量最高。
15N稳定同位素标记的(NH4)2SO4和NH4Cl价格十分昂贵。考虑到经济成本,采用NH4Cl为唯一氮源,浓度为2 g/L,最终副溶血弧菌15N稳定同位素标记培养基配方为:NH4Cl(2 g/L)、葡萄糖(10 g/L)、KH2PO4(0.6 g/L)、KH2PO4(0.9 g/L)、MgSO4(0.2 g/L)和NaCl(20 g/L)。配方经过多次重复增菌试验,产量稳定。
2.2 标记效率LC-MS/MS验证
副溶血弧菌通过该标记培养基进行多次转接培养,菌细胞中氮原子置换成稳定同位素15N,其中在质谱法特别是LC-MS/MS中,验证相对容易且安全。该方法工艺简单合理,培养基组分简单,成本低,为工业化制备15N标记副溶血弧菌培养基提供了新的制备方法。
通过改变流动相A和流动相B的比例,优化色谱分离条件。在优化的LC-MS/MS条件下,最后得到副溶血弧菌ATCC17802 总蛋白的总离子色谱图(图2-A)。取1个15N稳定同位素标记蛋白(Lipoic acid amine dehydrogenase)的一个肽段的一级色谱图(图2-B)。经过分子量计算验证可以得出结论:该蛋白中的氮原子由14N置换成稳定同位素15N,标记效率达到91.5%。
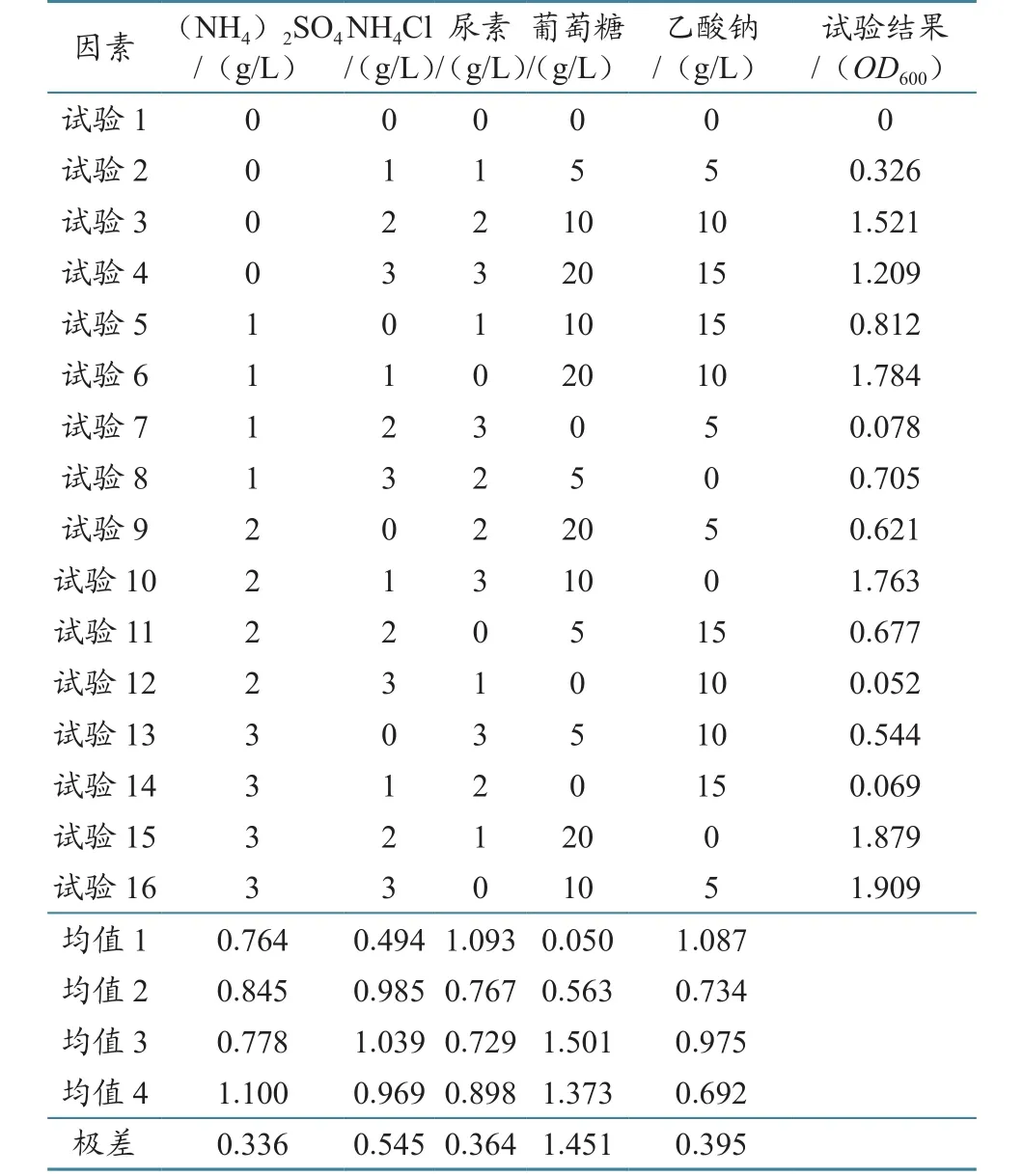
表2 副溶血弧菌正交试验直观分析
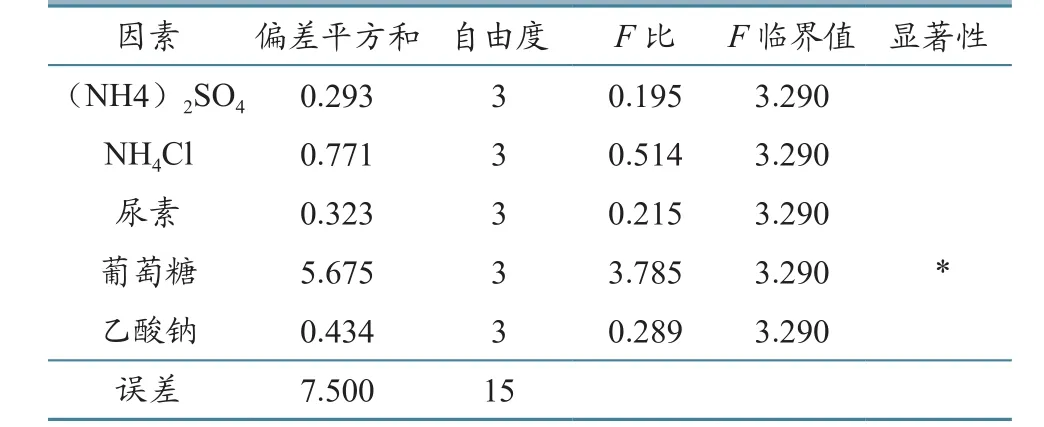
表3 副溶血弧菌正交试验方差分析
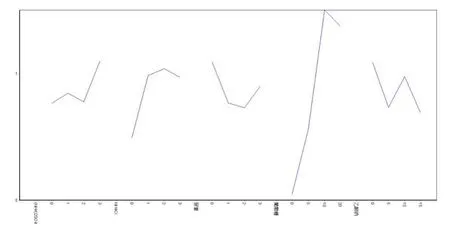
图1 副溶血弧菌正交试验效应曲线

图2 色谱图
3 结论
本文研究了一种15N稳定性同位素标记副溶血弧菌培养基的制备及其培育方法,所述培养基的配方是:NH4Cl(2 g/L)、葡萄糖(10 g/L)、KH2PO4(0.6 g/L)、KH2PO4(0.9 g/L)、MgSO4(0.2 g/L)、NaCl(20 g/L)、蒸馏水(1 L,pH 7.0~7.5);氮源的氮原子采用15N进行标记。培育15N标记副溶血弧菌的方法为连续多次
转接培养副溶血弧菌,LC-MS/MS验证标记的副溶血弧菌细胞中蛋白质氮原子的标记效率,标记效率为91.5%。该工艺简单合理,培养基组分简单,成本低,为工业化制备15N标记副溶血弧菌培养基提供了新的制备方法。
[1] MURRAY P R. 美国临床微生物手册[M]. 北京:科学出版社,2005:1863-1865.
[2] 高围溦,刘弘,刘诚,等. 三疵梭子蟹中副溶血性弧菌定量风险评估探索[J]. 环境与职业医学,2011,28(7):414.
[3] 王志刚,邵平阳,吴展. 创伤弧菌的微生物学特征及临床感染特点[J]. 中华临床感染病杂志,2008,5(1):314.
[4] 程云苏,罗芸,叶菊莲,等. 副溶血弧菌快速检测方法研究[J]. 疾病监测,2007,22(9):642-645.
[5] 赵峰,马丽萍,孙永,等.我国沿海城市海产品中副溶血性弧菌的半定量风险评估[J].中国渔业质量与标准,2012,4(2):33.
[6] 周缀琴,虞艳,石亚素,等. 舟山市七种市售海产品中创伤弧菌、副溶血性弧菌等检测分析[J]. 中国卫生检验杂志,2013,23(7):3432.
[7] SMOLKA M B,ZHOU H,PURKAYASTHA S,et al.Optimization of the isotope-coded affinity tag-labeling procedure for quantitative proteome analysis[J]. Analytical biochemistry,2001(297):25-31.
[8] LU Y,CONRAD R. In situ stable isotope probing of methanogenic archaea in the rice rhizosphere[J].Science,2005,309(5737):1088.
[9] REYNOLDS K J,YAO X,FENSELAU C. Proteolytic18O labeling for comparative proteomics:evaluation of endoprotease Glu-C as the catalytic agent[J]. Journal of proteome research,2002(1):27-33.
[10] 孟丽丽,齐孟文. 稳定同位素标记方法在蛋白质组学定量分析中的应用[J]. 同位素,2005,18(4):245-246.

