规模羊场环境气载产气荚膜梭菌耐药性及其ERIC-PCR分型
钟召兵,王 宁,孙红华,杨夫会
(泰安市岱岳区畜牧兽医局,山东泰安 271000)
微生物气溶胶可以借助空气进行扩散和传输,引发人类和动植物疾病的流行与传播,如传染病、过敏症和中毒等[1]。畜禽中的许多重大烈性传染病的传播为气源性传播,其病原微生物形成气溶胶后容易扩散,并且传播距离远。如1981年口蹄疫病毒(FMDV)从法国布列塔尼通过空气传播到英格兰南部,导致英格兰口蹄疫暴发[2];2001—2002年在美国由于气载炭疽引起了人的大批死亡[3];肺炎克雷波氏菌可通过空气传播等。大量研究证明,人们要重视环境气溶胶的危害。
产气荚膜梭菌(Clostridium perfringens),又称魏氏梭菌,属于腐生性厌氧芽胞致病菌,是引起畜禽猝死症、坏死性肠炎、肠毒血症和气性坏疽的主要致病菌[4],在自然界中广泛分布,可见于土壤、污水、饲料、粪便及人畜胃肠道内,是一种条件性致病菌[5]。由产气荚膜梭菌引起的羊产气荚膜梭菌病,主要表现为毒血症,包括羊猝狙、羊肠毒血症和羔羊痢疾等[3]。近年来,该病在我国的发病数量逐年增多,流行特点也由点状散发发展为片状散发,给我国养殖业造成了巨大经济损失[6]。该病病死率高,且不同菌型的产气荚膜梭菌常混合感染,导致原先使用的抗生素和疫苗随着时间的推移耐药性增强,对畜群的保护率越来越低,产气荚膜梭菌病的暴发呈上升趋势[7]。
大量研究表明,空气中的微生物及其代谢产物(内毒素、氨和硫化氢等)是影响动物和人类健康的重要因素[8]。本研究应用基因间重复序列 引 物PCR(Enterobacterial repetitive intergenic consensus sequence-based PCR,ERIC-PCR)方法,分析空气中气载产气荚膜梭菌基因表型及耐药性,为指导规模羊场临床合理使用抗生素,以及感染防控方案动态调整或修订、监测和控制耐药产气荚膜梭菌等提供依据。
1 材料与方法
1.1 被研究羊场
采样地点为泰安市的6个规模羊场(表1)。试验前使用VTTEK-32全自动细菌分析仪系统进行重新鉴定,质控菌株参考铜绿假单胞菌株ATCC27853,大肠埃希氏菌ATCC25922作为对照株。
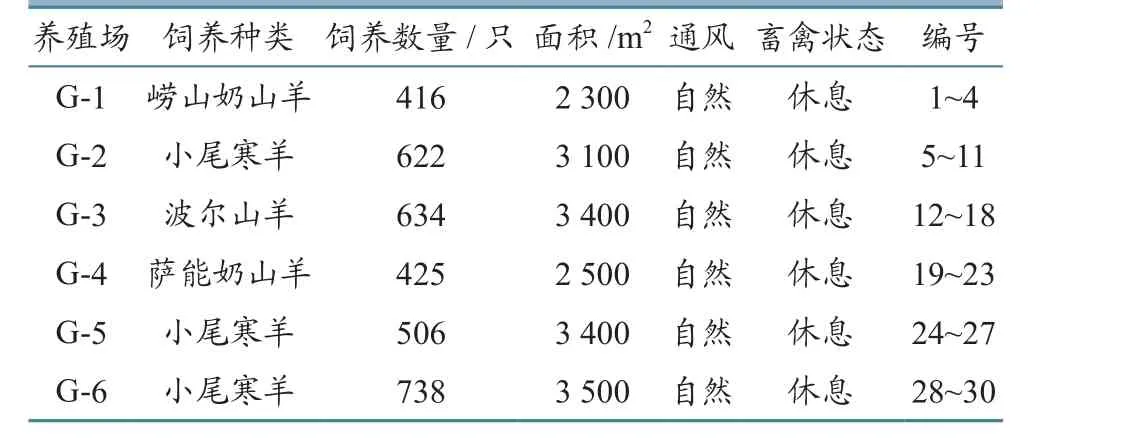
表1 羊场情况
1.2 样品采集
采用国际标准ANDERSEN-6级空气微生物样品收集器(辽宁市应用技术研究所)。收集器置于羊舍中央,放置高度为1 m,空气流量是28.3 L/min,以血-葡萄糖-琼脂培养基为采样介质,驱动时间根据不同卫生条件设在1~5 min之间,2016—2017年在泰安市6个规模羊场分离气载产气荚膜梭菌30株。
1.3 药敏试验
采用美国临床和实验室标准协会(Clinical and laboratory standards institute,CLSI)推荐纸片扩散法(K-B法),选用以下抗生素药敏纸片:氨苄青霉素、头孢噻肟、先锋霉素、诺氟沙星、阿米卡星、强力霉素、头孢他啶、青霉素和庆大霉素。结果判定及质量控制按2010年CLSI标准[9]进行(表2)。
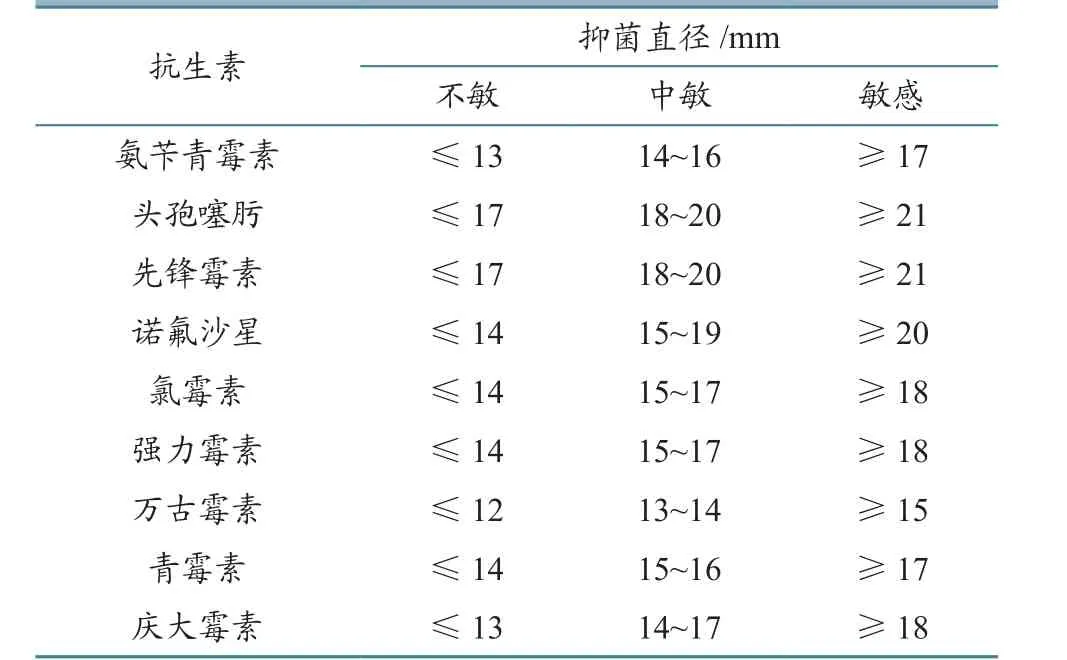
表2 抗生素耐药标准
1.4 同源性检测
1.4.1细菌总DNA提取 细菌DNA提取按细菌基因组提取试剂盒操作说明书进行,提取后的产物于–20 ℃保存备用。
1.4.2引物序列 ERIC1:5´-ATGTAAGCTCCTGGGGATTCAC-3´,ERIC2:5´-AAGTAAGTGACTGGGGTGAGCG-3´[10]。所有引物由上海生工生物有限公司合成。
1.4.3ERIC-PCR反 应 体 系 10×PCR buffer(Mg2+free )2.5 µL,MgCl2(2.5 mmol/L)2 µL,dNTP(2.5 mmol/L)2.5 µL,上下游引物(25 µmol/L)各 1 µL,模板 DNA 2 µL,Taq DNA 聚合酶(5 U/µL)0.5 µL,灭菌双蒸水补足25 µL。PCR基本反应程序为预变性 95 ℃ 4 min、94 ℃ 30 s、36 ℃ 1 min、68 ℃ 8 min、10个循环,变性温度上升到48 ℃、52 ℃分别设为15和10个循环,最后于68 ℃延伸16 min。琼脂糖凝胶电泳,溴化乙锭染色成像。
1.4.4数据处理 每个样品的扩增带存在时赋值为“1”,不存在时赋值为“0”,用电泳图像分析软件(Gel image system,Version 4.00)自动生成矩阵图。采用非加权对数算术平均法(Unweighted pair group method using averages algorithm,UPGMA),利用NTSYS-pc 2.10软件构建聚类树状图。另外,每个分离株看作是一个分类学单位(Operational taxonomic unit,OUT),并且把相似性≥90%的菌株看作起源相同的菌株[11]。为了减少误差,所有菌株在同一个反应条件下一次完成,而且电泳也是在相同凝胶中一次完成。
2 结果
2.1 分离株对常用药物的敏感性
参照《中华人民共和国兽药典》选取9种针对革兰氏阳性厌氧菌的药物分别对分离的气载产气荚膜梭菌进行药敏试验,其中对庆大霉素的耐药性最强,耐药率达到了86.7%,其次为青霉素,耐药率为43.3%,再次为强力霉素(36.7%)、头孢他啶(30%)和阿米卡星(23.3%),对其他药物耐药率为1.0%~16.7%(表3)。

表3 30株气载产气荚膜梭菌对抗菌药物的耐药性
2.2 ERIC-PCR分型
30株气载产气荚膜梭菌株的ERIC-PCR指纹图谱的条带数为3~12,片段大小在0.1~4.5 kb之间。以相似系数0.8为分界线,30株气载产气荚膜梭菌可以分为14个基因型,分别描述为Ⅰ、Ⅱ…XIII和XIV型,其中V型最多,有8株,占总菌株的26.7%。A9、A12、A13、A14、A15、B22和 B30菌株各自单独成为1个型。所有气载产气荚膜梭菌菌株均具有大小约为1 000 bp的特异性条带,最远亲缘关系为70.0%,B26与B27号菌株亲缘关系最近(图1)。

图1 30株气载产气荚膜梭菌的ERIC-PCR聚类图
3 讨论与结论
抗生素在畜禽养殖上的应用,对治疗和预防动物疫病、促进生长和提高畜牧业生长效能等方面都起到了积极作用。但是,随着抗生素的广泛应用,细菌耐药性变得越来越严重。细菌耐药性的出现,与菌株长期处于多种抗生素选择压的环境中,其耐药基因通过染色体或耐药质粒在菌群间广泛传播或扩散有关。
本研究结果显示,30株临床分离的气载产气荚膜梭菌耐药率高,对庆大霉素几乎耐药,对青霉素耐药率达43.3%。耐药性较高的抗生素是兽医临床使用频率较高的药物,原因是养殖场过量使用抗生素或规模化养殖场饲料中长期添加抗生素或促生长剂。因此,本试验的药敏数据为本地区用药提供了一定参考,对建立和完善抗菌药物临床应用和细菌耐药预警机制具有重要意义。
临床分离菌株的基因同源性分析对于流行病学调查,特别是传染源和传播途径的追踪具有重要意义。近年来随着分子生物学技术的迅速发展,特别是聚合酶链式反应(PCR)技术的发展,出现了一系列的分子生物学分型方法,其中细菌基因间重复共有序列PCR(Enterobacterial repetitive intergenic consensus PCR,ERIC-PCR)分型技术是以肠杆菌科基因重复序列为引物进行PCR,能扩增出多态性DNA图谱[12]。DNA条带特征能反映出细菌整个基因组结构的差异,能区别含有ERIC重复序列的不同菌种或株,因此具有很强的鉴别种乃至菌株的能力。ERIC-PCR作为行之有效的分子分型技术,是一种被广泛应用的分子流行性病学调查方法,有利于快速判断出地区流行菌株及其传播情况,从而为防控疫病提供重要参考[13]。
气载产气荚膜梭菌间存在遗传多样性,不仅存在于同一个血清型的不同菌株之间,而且存在于大量不可分型菌株之间。相对于血清学分型,ERIC-PCR技术对菌株的描述和比较的区分能力更高。本研究结果显示,30株气载产气荚膜梭菌ERIC-PCR指纹图谱条带数为3~12,片段大小在0.1~4.5 kb之间,可清晰分为14个基因型,大部分来源于不同的克隆株,其中Ⅴ型菌株数量最多,III型和Ⅵ型次之,表明气载产气荚膜梭菌在本地区规模羊场内存在感染和流行,导致克隆株在不同羊场及个体间相互传播。
本研究发现部分菌株的同源性可达99%以上(菌株B26和B27),此两株在场G-5中采集到,说明本研究所收集的气载产气荚膜梭菌可能来源于同一克隆菌株,存在场内克隆传播,其耐药谱特征也较为相似,但耐药水平存在一定程度的差异,可能与该克隆株在不同感染个体所受到的抗生素选择压力的差异有关,使其能自行启动外排泵等抗药机制以适应生存环境。同一个规模羊场的基因型也有不同,不同羊场之间也存在相同的基因型。
规模羊场气载产气荚膜梭菌多重耐药现象比较严重,菌株之间存在很高的遗传多样性,克隆株在不同羊场及个体间相互传播。不同环境和条件下同一种病原菌的基因型也存在一定差异,同一个规模羊场的基因型可有不同,不同羊场之间也可能存在相同的基因型。因此在规模养殖场内,要密切关注气载产气荚膜梭菌的监测动态,防止场内感染的进一步流行和暴发,同时执行严格场内消毒制度。
[1] HO J,DUNCAN S. Estimating aerosol hazards from an anthrax letter[J]. Journal of aerosol science,2005,36(5/6):701-719.
[2] DONALDSON A I,GLOSTER J,HARVEY L D,et al.Use of prediction models to forecast and analyse airborne spread during the foot-and-mouth disease outbreaks in Brittany,Jersey and the Isle of Wight in 1981 [J].Veterinary record,1982(110):53-57.
[3] BERRY K,COLVIN S,BLYTHE D,et al. Follow-Up of Deaths Among U.S. Postal Service Workers Potentially Exposed to Bacillus anthracis—District of Columbia,2001—2002[J]. Morbidity & mortality weekly report,2003,52(39):937.
[4] ANDERS J,ANNA A,KALDHUSDAL M,et al.Genetic diversity and prevalence of netB in Clostridium perfringens isolated from a broiler flock affected by mild necrotic enteritis[J]. Veterinary microbiology,2010(144):87-92.
[5] AIKHALDI S F,VILLANUEVA D,CHIZHIKOV V. Identitication and characterization of Clostridium perfringens using single target DNA microarmy chip[J].International journal of food microbiology,2004,91(3):289-296.
[6] 蔡宝祥. 家畜传染病学[M]. 北京:中国农业出版社,1996.
[7] 张红英,卢中华,杨霞,等. 我国魏氏梭菌病的流行特点[J]. 中国畜牧兽医,2004,31(1):39-41.
[8] PRAZMO Z,DUTKIEWICZ J,SKORSKA C,et al.Exposure to airborne gram-negative bacteria,dust,and endotoxin in paper factories[J]. Annals of agricultural and environmental medicine,2003(52):937-938.
[9] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twentieth informational supplement M100-S20[S].Wayne:NCCLS,2010.
[10] GUIFANG W,LI P,HUIMIN D,et al. ERIC-PCR fingerprinting-based community DNA hybridization to pinpoint genome-specific fragements as molecular markers to identify and track populations common to healthy human guts[J]. Journal of microbiological methods,2010(59):91-108.
[11] YUAN W,CHAI T J,MIAO Z M,et al. ERIC-PCR identification of the spread of airborne Escherichia coli in pig houses[J]. Science of the total environment,2010(408):1446-1450.
[12] FITTIPALDI M,NOCKER A,CODONY F. Progress in understanding preferential detection of live cells using viability dyes in combination with DNA amplification[J].Microbiology methods,2012,91(2):276-289.
[13] MARTAIN G T,SMYTH J A. Prevalence of netB among some clinical isolates of Clostridium perfringens from animals in the United States[J]. Veterinary microbiology,2009(136):202-205.

