林窗尺度对侧柏人工林土壤微生物量和功能多样性的影响
管云云,叶钰倩,钟远标,费 菲, 陈 斌,关庆伟,*
1 南方现代林业协同创新中心,南京 210037 2 南京林业大学生物与环境学院,南京 210037
微生物是土壤生态系统碳氮库的重要组成部分,其代谢活动在土壤碳氮循环与固持、枯落物和细根分解等生态过程中起着主导作用[1],因此微生物代谢活性的研究一直备受关注。目前,主要运用Biolog法测定微生物代谢活性对各类干扰的响应[2],但对林窗的响应研究还鲜见[3]。林窗是由林冠乔木的死亡等原因造成林地上形成不连续的林中隙地[4],影响地上地下各类生态过程和功能[5-6]。人工林窗是加速同龄人工纯林结构优化的重要管理措施[7]。目前的林窗研究主要集中在林窗的基本特征[8-9],林窗对小气候和植物群落特征[6,10]等地上生态过程的影响上。越来越多的研究发现林窗对土壤碳氮动态[11- 13]、枯落物分解[14-15]、细根动态[16-17]、酶活性[13,18]等地下生态过程存在着明显的干扰作用,进而影响到森林生态功能的发挥。微生物活性对地下生态过程的发生存在激发作用,但林窗对土壤微生物量[19- 21]、微生物物种和功能多样性[22]、菌根侵染[23]等的影响鲜有研究。因此还应深入研究林窗对地下生态过程的影响,并且明晰林窗影响的生物学机制,加强土壤微生物代谢活性和多样性的研究。
苏北丘陵山地人工林由于林分密度过高等原因导致林分生产力低下,亟待通过人工林窗干扰优化林分结构、提高生态功能。为此,本研究以徐州九里山侧柏人工纯林为研究对象,应用氯仿熏蒸浸提法和Biolog法,研究了3种尺度人工林窗对土壤微生物量碳氮和功能多样性的影响。旨在明晰:1)不同尺度林窗干扰下,土壤微生物量碳氮和功能多样性有何变化?2)从林窗边缘到林下水平梯度上不同位置的的上述变化趋势有无差异?期望通过以上研究,寻求合理的林窗干扰强度,为林窗对土壤碳循环影响的理论研究和人工林科学经营提供依据。
1 研究区概况
徐州市地处苏北,33°42′—34°58′N,116°21′—118°43′E,属亚热带向暖温带过渡的半湿润季风气候,年均温14℃左右,年均降水量800mm左右。徐州市九里山侧柏人工纯林的土壤以淋溶褐土为主,黏重且土层薄,中性至弱碱性,林下自然更新的乔木树种主要为构树(BroussonetiapapyriferaL.),另外伴有化香(PlatycaryastrobilaceaSieb.et Zucc.)、臭椿(Ailanthusaltissima(Mill.) Swingle)、苦楝(MeliaazedarachL.)等,林下灌木和草本的发育较差,灌木主要有牡荆(VitexnegundoL.)、柘树(CudraniatricuspidataCarriere)等。九里山样地基本概况如下:海拔达134m,坡度30°左右,侧柏林林龄51a,平均树高8.6m,平均胸径13.7cm,林分密度1317株/hm2,郁闭度达0.87。
2 材料与方法
2.1 实验设计与样本采集
在徐州市九里山阳坡海拔70m左右的侧柏人工纯林中,于2012年1月随机开伐共27个3种尺度(每种9个)的近圆形林窗,每个林窗之间相距至少50m。林窗尺度按照径高比(林窗半径与林窗边缘木平均树高8m的比值,R/H)确定,小(S)、中(M)、大(L)3种林窗的半径分别为4、8、12m,R/H分别为0.5、1.0、1.5,面积分别约50、200、450m2。林窗开设后清除了树枝等残体,未进行掘根处理。本实验在27个林窗中选取小中大林窗各3个,选择距离林窗至少30m未受干扰的地带为对照样地(CK),于2014年1月、2015年4月、7月、10月共采样4次。依据前人对林窗内小气候变化特征的研究,确定取样点之间距离为小林窗半径,即4m。鉴于以往对林窗中心与林下2点土壤微生物量的对比研究较多,而对从林窗边缘到林下不同位置的水平梯度变化研究鲜见,本研究则选取扩展林窗边缘(D1)、距林窗边缘4m(D2)和8m(D3)处林下3个取样点,初步探究林窗对微生物活性在水平梯度上的影响,共9个处理,每个处理3次重复。小林窗的边缘点、距小林窗边缘4m和8m的点分别用S1、S2、S3表示;中(M)、大(L)林窗的3点以此类推。

图1 林窗实验取样点位置示意图(图例• 代表取样点) Fig.1 Sample sites of gaps(legend • represents the sampling points)
每个处理的土样为同一个圆上至少东南西北4个方向上0—15cm土层非根际土的混合,同时采集侧柏的根际土,见图1。整个采集过程带灭菌手套,取好的土样装入塑料袋并置于保鲜箱中,立即运回实验室,过2mm筛后置冰箱中4℃保存。本论文利用夏季非根际土数据进行分析,采样当日阴转多云。
2.2 实验方法
土壤微生物功能多样性应用Biolog方法测定,称取相当于10g烘干土的鲜土,加90mL 0.85%的无菌NaCl溶液于三角瓶中,封口振荡15min,静置30min,再将悬浊液在操净台上稀释至10-3,再用8通道加样器取150μL该菌液接种到ECO板中,将接种好的板立即在波长设为590nm,ELx808-Biolog微孔板读数仪( BIO-TEK Instruments INC,USA)上读取吸光值,记为背景值(第0天),之后置于25℃的恒温培养箱中培养10d,每隔24h读取一次吸光值[1- 2]。
微生物量碳(MBC)、氮(MBN)采用氯仿熏蒸-0.5mol/L K2SO4浸提法[24],称取相当于10g烘干土的鲜土,加40mL K2SO4溶液,摇匀,充分震荡30min后静置30min,取5mL澄清液稀释至100mL,取部分稀释液在总有机碳分析仪(TOC-VCPH+TNM- 1, Shimazu Inc., Japan)上测定,同时设未熏蒸的对照样品,测定出熏蒸前后可溶性碳(Dissolved carbon,DC)和可溶性氮(DN)的浓度,两次实验结果之差即为熏蒸后土壤碳氮的增量。
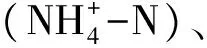
2.3 数据处理
2.3.1 微生物功能多样性数据处理方法
BiologECO平板(美国)是一种用31种碳源作底物的96孔反应板,各反应3次重复,1个重复4列(分别用1、2、3、4表示)8行(分别用A、B、C、D、E、F、G、H表示),各类碳源分布和分类见表1和表2[26]。运用10d的数据(每个反应孔皆减去第0天的背景值)[2],分析微生物代谢活性随培养时间的变化趋势,同时对第96h[27]的数据,运用SPSS进行采用单因素方差分析(one-way ANOVA),多重比较(Duncan,P=0.05)、相关性分析(Pearson法)、主成分分析和Q型聚类分析,所有数据为3 次重复的平均值。微生物代谢活性和4种功能多样性计算方法如下[28-29]:

表1 BiologEco板31种碳源分布

表2 BiologEco板碳源分类
(1)土壤微生物的代谢活性用每孔颜色平均变化率(average well color development,AWCD)来描述,计算公式如下:
AWCD =∑(Ci-R)/31
式中,Ci为各反应孔在590nm下的吸光值;R为ECO板对照孔A1的光密度值,31为生态板的碳源数目。Ci-R<0的孔,记为0。
(2)丰富度指数(Richness index,S)
用碳源代谢孔的数目表示(Ci-R>0,则代表该孔碳源被利用)。
(3)多样性指数(Diversity index,H′)
H′ =-∑(Pi×logPi)
式中,Pi=(Ci-R)/∑(Ci-R),表示有碳源的孔与对照孔A1的光密度值之差与整板总差的比值。
(4)均匀度指数(Evenness index,E)
E=H′/lnS
(5)优势度指数(Dominance index,Ds)
2.3.2 土壤微生物量碳氮和基本理化性质的分析方法
MBC与DC增量,MBN与DN增量之间的转换系数分别为KC=0.45,KN=0.54。
DC(mg/g)=a×100×ts/m
MBC(mg/kg)=(DC熏蒸-DC未熏蒸)×1000×KC
a为测试液浓度(mg/mL);100为测试液体积(mL);ts为分取倍数;m为鲜土质量(g);KC=0.45,即浸提效率。
a为测试液浓度(mg/mL);50为测试液体积(mL);ts为分取倍数;m为鲜土质量(g)。
3 研究结果
3.1 林窗对土壤理化性质的影响
据表3可知,林窗总体上提高了土壤温度、pH、含水率,影响程度因林窗尺度和位置而异。土壤温度随林窗尺度增大而增大,从D1到D3点,逐渐降低。土壤呈偏碱性,pH值总体表现为小>大、中林窗。从D1到D3点,小林窗的pH和大中林窗的含水率先增后减,大中林窗的pH和小林窗的含水率先减后增,pH皆表现为D3>D1。随林窗尺度增大,D1、D2的pH先减后增,D3的pH 和D2、D3的含水率先增后减,D1的含水率减小。

表3 林窗对土壤理化性质的影响
图中小写字母不同代表处理间差异显著(P<0.05),下同。S:小林窗,Small gap;M:中林窗,Medium gap;L:大林窗,Large gap
林窗总体上降低了土壤TC、TN含量和C/N比值,S1点有所增加,TS含量表现为小林窗>CK>大中林窗。TC和TN的趋势相近,总体表现为小>中>大林窗,从D1到D3,小林窗的TC和TN先减后增,大中林窗则先增后减。从D1到D3,中小林窗的C/N先减后增,大林窗则相反。从D1到D3,小林窗TS先减后增,大林窗相反,中林窗增加,变化显著。
3.2 林窗对土壤微生物量碳氮的影响
据图2可知,与CK(2820.33mg/kg)相比,林窗样点MBC总体降低,但S1显著提高;MBN显著降低,MBC/MBN显著上升,S1点高达20。大林窗的MBC总体偏小,低至2069.42mg/kg,中、小林窗偏大。从D1到D3点,小林窗的MBC先显著下降后显著上升,大林窗趋势相反,中林窗显著上升,且大、小林窗的D3皆小于D1。
MBN与MBC趋势相反,大、小林窗的MBN总体偏小,S2低至126.21mg/kg,中林窗偏大。从D1到D3,小林窗的MBN先显著下降后显著上升,中林窗无显著变化,大林窗显著降低。3点的MBC/MBN皆随林窗尺度增大而显著下降;从D1到D3,大中林窗基本先升后降,小林窗则显著下降。

图2 不同位置土壤微生物量碳氮含量及碳氮比Fig.2 The comparison of MBC, MBN and MBC/MBN of all samples S:小林窗,Small gap;M:中林窗,Medium gap;L:大林窗,Large gap
3.3 林窗对土壤微生物代谢活性的影响
据图3可知,林窗干扰下土壤微生物的AWCD值随培养天数增加总体上呈S型增长趋势,上升至1后变化不大。林窗对AWCD增长趋势的影响因林窗尺度和位置而异。林窗总体降低了AWCD值,小林窗的影响最小,大中林窗相近。从D1到D3,中小林窗的AWCD先降后升,且D3>D1,大林窗趋势相反。随林窗尺度增大,3点基本先降后升。不同处理之间第96 h的AWCD的差异显著性结果详见表4,CK显著大于L3和M1,其他点之间均无显著差异。从D1到D3,小林窗的AWCD先降后升,中(大)林窗上升(下降);3点的AWCD基本随林窗尺度增加而降低。不同尺度林窗的影响程度和范围不同。
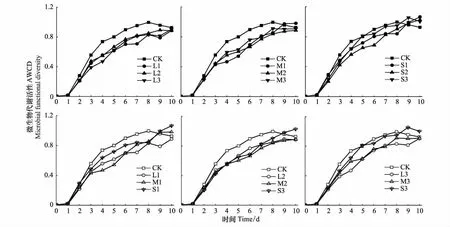
图3 林窗对土壤微生物代谢活性的影响Fig.3 The comparison of the AWCD of all samplesAWCD: 微生物代谢活性,Microbial functional diversity
3.4 林窗对土壤微生物利用6类碳源的影响
据表4可知,侧柏人工林土壤微生物对6类碳源中的酚类,聚合物类,氨基酸类利用较高,其次是碳水化合物。林窗降低了土壤微生物对6类碳源的利用,中林窗的影响总体最小,但其D1对6类碳源的利用皆小于大小林窗的D1。
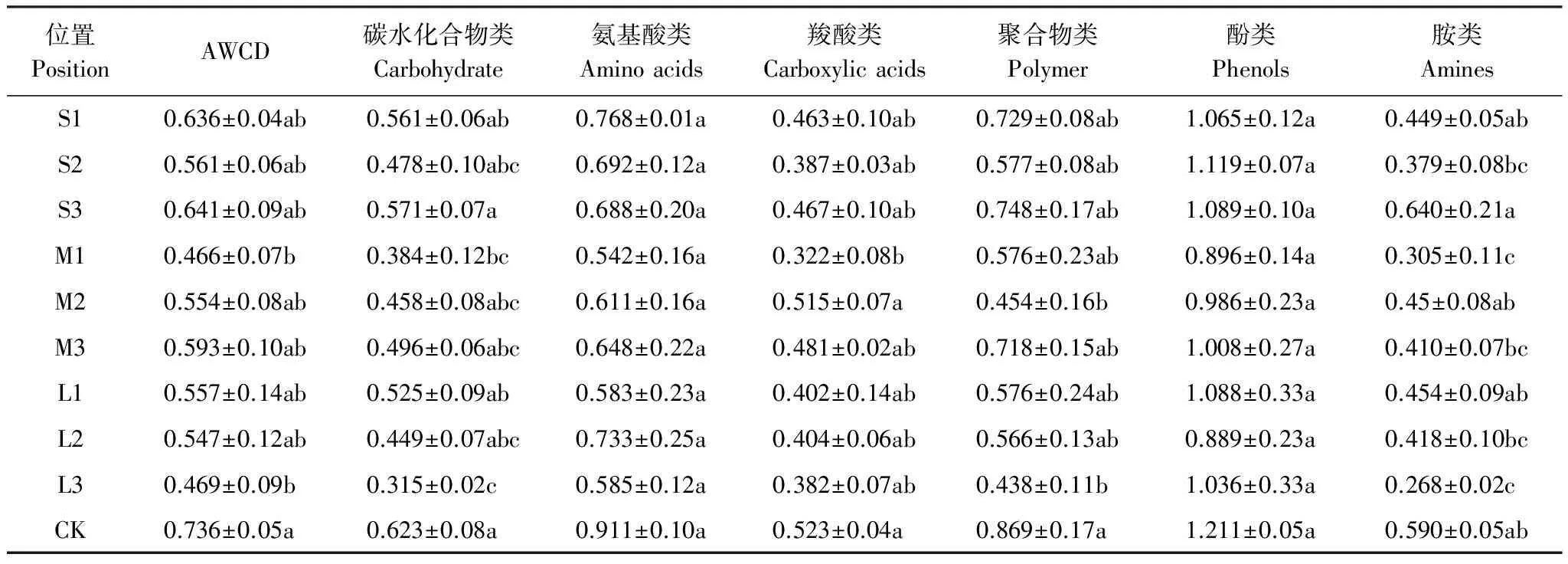
表4 各处理之间AWCD和6类碳源利用程度的差异显著性
数值为平均值±标准差(n=3),小写字母不同代表处理间差异显著(P<0.05)。 AWCD: 微生物代谢活性, Microbial functional diversity
碳水化合物的利用表现为S3和CK显著大于M1和L3,总体上小>中>大林窗;从D1到D3,小林窗先降后升,中大林窗上升,大林窗下降。氨基酸类和酚类的利用在各点之间皆无显著差异,总体上表现为小>大>中林窗,D2对氨基酸、D3对酚类的利用都随林窗尺度增大先减后增,D2对酚类、D3对氨基酸的利用都随林窗尺度增大而减小;从D1到D3,中林窗的微生物对这2种碳源的利用增大,大林窗则都先增后减,小林窗对氨基酸的利用减少,对酚类则先增后减。
CK对聚合物的利用显著大于M2和L3,CK和M2对羧酸类的利用显著大于M1,S3对胺类的利用显著大于M1和L3。随林窗尺度增大,D2对羧酸和胺类的利用先升后降,对聚合物的利用相反,D3对聚合物和胺类的利用减小,对羧酸则先升后降。从D1到D3,中林窗对羧酸类和胺类的利用先升后降,对聚合物则相反,大林窗对聚合物和胺类的利用下降,对羧酸类先升后降,小林窗对这3类碳源的利用皆先降后升。
3.5 林窗对土壤微生物4种功能多样性的影响
H′、S和E多样性指数在各点之间均无显著差异,S3、S1和CK的Ds指数则显著大于L1和L2。大中林窗提高了H′和E指数,降低了Ds指数,小林窗基本相反;林窗基本提高了D1的S指数,D1无变化,D3则降低,小林窗总体偏高。不同指数在不同尺度林窗和不同位置上的变化不同,详见表5。
H′和E指数的变化趋势相近,总体上,大>中>小林窗>CK,仅小林窗的E指数小于CK。从D1到D3,大小林窗的H′和E指数表现为先增后减,中林窗则增加。D1、D2的S指数随林窗尺度增大先增后减,D3则减小;从D1到D3,3个林窗的S指数呈下降趋势。
Ds指数总体表现为小>CK>中>大林窗。3点的Ds指数随林窗尺度增大的变化趋势与H′指数相反,且林窗之间相同点Ds的差异越往林下越小。从D1到D3,小林窗Ds指数先降后升,中林窗相反,大林窗上升,且林窗内部的差异随林窗尺度增大而增大。

表5 林窗对微生物4种功能多样性的影响
H′:多样性指数,Diversity index;S:丰富度指数,Richness index;E:均匀度指数,Evenness index;Ds:优势度指数,Dominance index
3.6 土壤微生物对31种碳源利用的主成分和聚类分析
对第96 h的培养数据进行主成分和聚类分析,共提取了6个主成分,累计贡献率达87.5%,其中第1主成分(PC1)的贡献率为35.95%,详见表6。31种碳源在6个主成分中的得分(表7)表明,对PC1贡献较大的碳源有6种(系数>0.8),主要是聚合物类和氨基酸类,有β-甲基-D-葡萄糖苷(碳水化合物)、α-环状糊精、肝糖(聚合物)、L-丝氨酸、甘氨酰-L-谷氨酸(氨基酸类)、苯乙基胺(胺类),碳水化合物的贡献总体不大。
图4的Q型聚类分析表示:若分为3类,CK为一类,M1和L3为一类,其余点为一类,归属一类的说明代谢能力相近,这也与上述6类碳源利用和多样性指数的变化趋势相近。
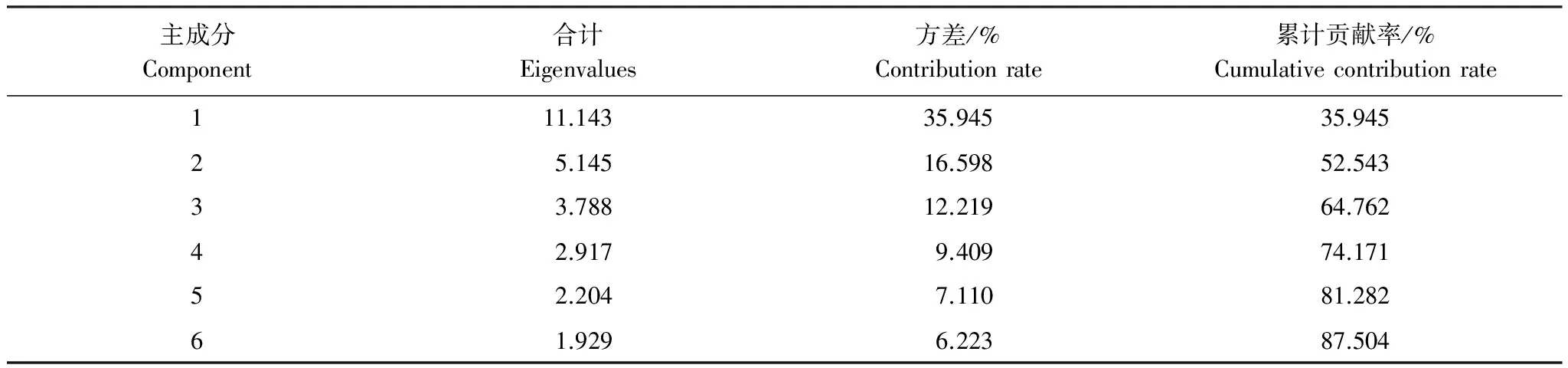
表6 土壤微生物碳源利用的各个主成分特征值和累计贡献率
3.7 土壤微生物指标与土壤理化性质的相关性分析
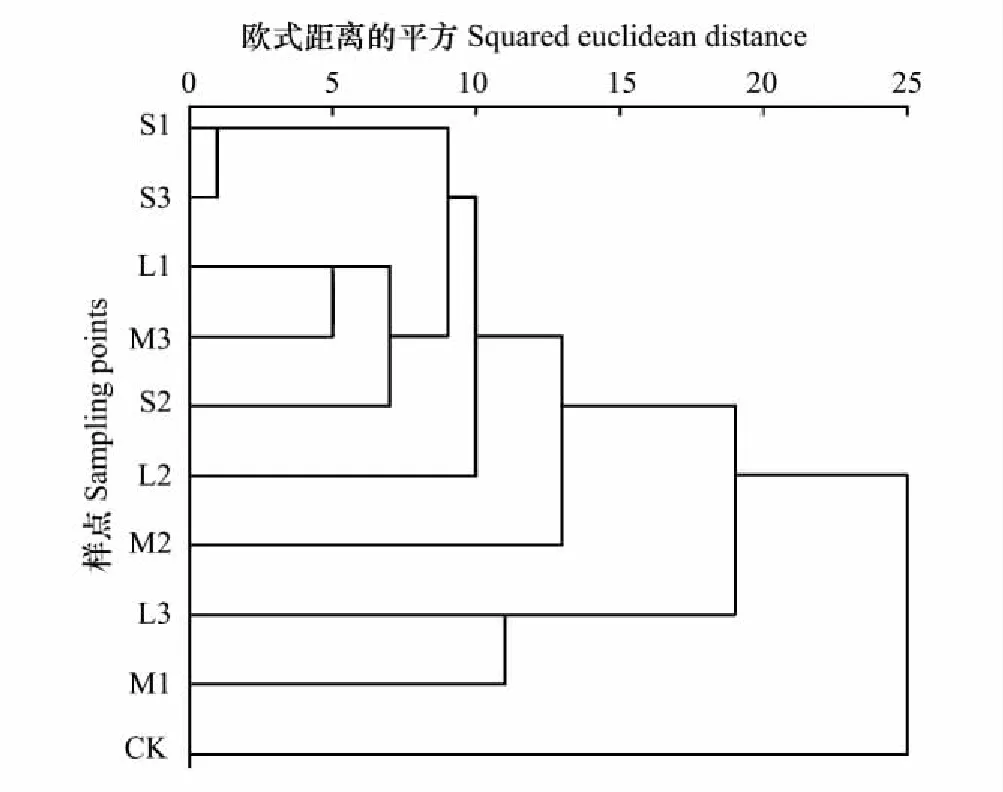
图4 土壤微生物对31种碳源利用的聚类分析 Fig.4 Cluster analysis of 31 kinds of carbon source consumption by soil microbial communities
4 讨论与结论
4.1 林窗尺度对土壤微生物量碳氮和代谢多样性的影响
本研究中,大林窗MBC偏小,小林窗MBN偏小,MBC/MBN与随林窗尺度增大而减小,是因为大林窗的凋落物、细根量较少[17],小林窗中C/N较高,抑制了MBN。而在意大利的黑松(Pinusthunbergii)林中,小林窗的土壤MBC、MBN最高[13];林窗显著提高表层土MBC、MBN含量,随林窗尺度增大而减小[20],高天雷等发现在川西云杉(Piceaasperata)林中MBC、MBN与林窗尺度(50、100、150m2)显著正相关[36],在马尾松(Pinusmassoniana)人工林中则随林窗尺度(100—1600m2)增大先增后减,但均无显著差异[21]。这可能与所选的林窗尺度、林窗年龄、立地条件等有关。
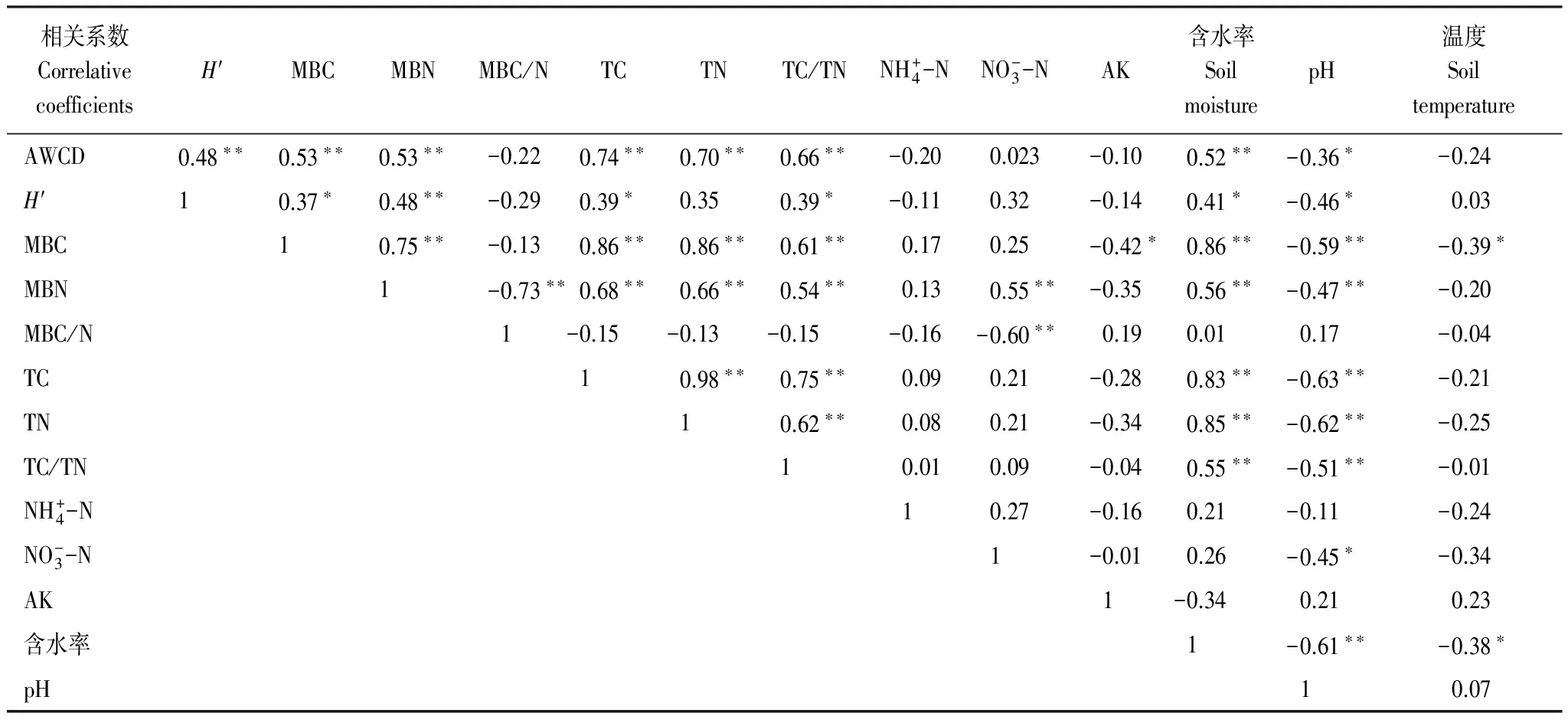
表8 土壤微生物量和代谢活性与土壤理化性质之间的相关关系
**表示在0.01 水平(双侧)上显著相关;*表示在0.05水平(双侧)上显著相关;AK:速效钾,Available K
4.2 林窗尺度对土壤微生物代谢活性的影响
结果表明,侧柏林土壤AWCD值低于其他类型的森林[1]。并且,林窗降低了土壤微生物的AWCD值,小林窗影响最小,3点的AWCD值随林窗尺度增大而减小,这可能是因林窗尺度增大,昼夜温差[37]和pH增大、落物量减少、养分流失加快[38],从而不利于微生物总量的增加。殷睿等发现,经过季节性冻融期,小林窗和林下土壤AN更高[39],说明小林窗更有利于微生物活性提高。也有研究表明热带雨林林窗显著降低了土壤呼吸速率[11],并且林下土壤呼吸排放量是林窗的2倍[11],说明林窗提高了土壤的固碳能力[40]。欧洲山毛榉林(Fagussylvatica)林窗加速了枯落物的分解,小林窗(220m2)作用更显著[14],说明小林窗微生物活性更高。
林窗总体上降低了土壤微生物对六类碳源的利用,酚类、聚合物类的利用程度较高,中林窗的微生物对碳水化合物和氨基酸类小分子碳源的利用最低,对聚合物类利用程度较高。主成分分析也表明,对PC1贡献较大的碳源是聚合物类和氨基酸类,说明侧柏林土壤微生物对大分子类物质利用较高,这与上述对MBC/MBN的讨论一致。而宁南山区和黄土丘陵人工林土壤微生物利用的主要碳源分别为羧酸类[1]和糖类[28],与本研究存在差异的原因有待进一步探究。吴庆贵也发现,在冬季时较大林窗(<290m2)抑制红桦(Betulaalbosinensis)和促进岷江冷杉(AbiesfaxonianaRehd.)凋落叶木质素的降解,在生长季相反,岷江冷杉凋落叶木质素富集速率为大>中>小林窗[41]。因此,林窗有望促进夏季土壤碳的固持和难降解物质的分解,提高森林生态系统应对全球气候变化的能力。
林窗总体上提高了土壤微生物代谢多样性水平,其与AWCD值随林窗尺度增大的变化总体上呈相反趋势。说明林窗形成后微生物总量虽减少,但可能由于环境异质性提高,微生物种类增多,特别是真菌,或是r-对策种,从而代谢多样性水平提高[42]。因此,林窗有望调控夏季土壤微生物群落结构,促进土壤生态系统稳定。
4.3 林窗位置对土壤微生物量碳氮和代谢活性的影响
关于土壤微生物对从林窗边缘到林下水平梯度的响应研究鲜见。本研究中,3种尺度林窗D3的土壤MBC皆小于D1,可能是光照增加对土壤微生物量起激发作用。从林窗边缘到林下,小林窗的MBC含量先降后升,大林窗趋势相反,中林窗一直上升,存在明显的尺度效应,是多种因素综合作用的结果,小林窗D2的光照增加不明显,且枯落物量、AN有所减少,所以MBC较低,大林窗D2光照较多[43],枯落物分解速率较快[44],昼夜温差较S1小,反而有利于微生物增殖,Fownes等认为氮增加对生物量分配的影响比光大[45],中林窗的光照量和昼夜温差适中,土壤MBC随枯落物量和AN增加而增加。从林窗边缘到林下,中、小林窗土壤的MBN含量先减后增,大林窗减少;大小林窗的土壤MBC/MBN基本先升后降,中林窗上升,说明林窗的影响至少达到林下D3的8m处。在林窗边缘到林下水平梯度上MBN、MBC/MBN复杂的变化也是光照、枯落物量、土壤pH和速效性养分等综合作用的结果,各个因子作用的影响机制有待进一步的研究,取样点的密度和范围应进一步加大。
从林窗边缘到林下,小林窗土壤微生物AWCD的变化趋势与土壤MBC相近,各尺度林窗土壤微生物代谢多样性的变化趋势与MBC相反。从林窗边缘到林下,中小林窗对聚合物的利用先降后升,大林窗则下降,说明中小林窗更有利于难降解物质的分解,林窗的影响存在明显的尺度和梯度效应。张艳也发现红椿凋落叶除纤维素外的其余难降解物质含量, 中小型林窗从林窗中心到边缘均显著低于林下[46]。从林窗边缘到林下,3个林窗的S指数基本呈下降趋势,其他指数因林窗尺度而异,总体在边缘点较高,可能是因为林窗边缘环境异质性较高和微生物种类较多。这种梯度效应是小气候和土壤理化性质对林窗的差异性响应共同作用的结果,具体影响机制有待进一步研究。有研究表明植物多样性水平也在林窗边缘最高,即林窗的“边缘效应”[47]。
4.4 合理人工林窗干扰强度的确定
人工林窗尺度和密度的确定是个复杂的问题,应结合研究地的气候、立地条件和林窗对森林生态功能的影响等综合考虑。本研究根据土壤养分和微生物代谢水平对林窗尺度和位置的响应,认为中林窗对侧柏人工林土壤生态系统生态功能的发挥和可持续发展最有利,不仅保证较小程度上降低土壤微生物量和代谢活性,也适当地提高了环境异质性和微生物代谢多样性水平。欧江等也认为中林窗有利于微生物量的提高[21],张艳等认为中小型林窗(100—900m2)更有利于凋落叶中难降解物质的降解[46],小林窗(50m2)更有利于土壤SOC积存和肥力提升[20]。而宋小艳等认为1225m2的林窗对土壤有机碳和活性有机碳的积累,以及团聚体结构的优化是比较适宜的[48]。在油松(Pinustabulaeformis)人工林中,D/H为1.0的大林窗更有利于阴坡油松种群可持续发育,阳坡不宜进行过大强度的间伐[49]。Zhu等对温带森林林窗的尺度作了规范,小林窗D/H为0.49—1.0,中林窗为1.0—2.0,大林窗为2.0—3.5[50],
因此本研究中的林窗属中小林窗范围,还应扩大林窗尺度进一步研究。
4.5 小结
徐州侧柏人工林中,林窗降低了土壤MBC、MBN含量和微生物代谢活性,提高了代谢功能多样性,具有明显的尺度和梯度效应,中尺度林窗(200m2)干扰有利于土壤固碳能力的提高。该研究可对进一步明晰林窗如何促进土壤碳固持和大分子物质降解,促进森林地上和地下生态系统结构的稳定和生态过程的调控,提高森林生态系统应对全球气候变化的能力有重要意义。
本文仅阐述了夏季时林窗尺度和位置对土壤微生量和代谢水平的影响,接下来将在季节变化的基础上进一步阐释林窗对微生物活性的影响,以及对微生物活性的根际效应的影响。今后应着重研究林窗如何调控土壤碳氮循环与固持、细根和根际圈动态等地下生态过程,明晰地下生态过程发生的生物学机制;同时,应进一步拓展研究的时空尺度,并加强地上与地下生态系统、生物与非生物因子、宏观与微观尺度等之间的整合研究。
[1] 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性. 生态学报, 2011, 31(18): 5225- 5234.
[2] 郑华, 欧阳志云, 方治国, 赵同谦. BIOLOG在土壤微生物群落功能多样性研究中的应用. 土壤学报, 2004, 41(3): 456- 461.
[3] 管云云, 费菲, 关庆伟, 陈斌. 林窗生态学研究进展. 林业科学, 2016, 52(4): 91- 99.
[4] Watt A S. Pattern and process in the plant community. Journal of Ecology, 1947, 35(1/2): 1- 22.
[5] Gray A N, Spies T A, Pabst R J. Canopy gaps affect long-term patterns of tree growth and mortality in mature and old-growth forests in the Pacific Northwest. Forest Ecology and Management, 2012, 281: 111- 120.
[6] 谭辉, 朱教君, 康宏樟, 胡理乐. 林窗干扰研究. 生态学杂志, 2007, 26(4): 587- 594.
[7] Stan A B, Daniels L D. Growth releases across a natural canopy gap-forest gradient in old-growth forests. Forest Ecology and Management, 2014, 313: 98- 103.
[8] 鲜骏仁, 胡庭兴, 王开运, 张远彬. 川西亚高山针叶林林窗特征的研究. 生态学杂志, 2004, 23(3): 6- 10.
[9] 刘庆, 吴彦, 吴宁. 玉龙雪山自然保护区丽江云杉林林窗特征研究. 应用生态学报, 2003, 14(6): 845- 848.
[10] 张希彪, 王瑞娟, 周天林, 上官周平. 黄土丘陵区油松天然次生林林窗特征与更新动态. 应用生态学报, 2008, 19(10): 2103- 2108.
[11] Saner P, Lim R, Burla B, Ong R C, Scherer-Lorenzen M, Hector A. Reduced soil respiration in gaps in logged lowland dipterocarp forests. Forest Ecology and Management, 2009, 258(9): 2007- 2012.
[12] Thiel A L, Perakis S S. Nitrogen dynamics across silvicultural canopy gaps in young forests of western Oregon. Forest Ecology and Management, 2009, 258(3): 273- 287.
[13] Muscolo A, Sidari M, Mercurio R. Influence of gap size on organic matter decomposition, microbial biomass and nutrient cycle in Calabrian pine (Pinuslaricio,Poiret) stands. Forest Ecology and Management, 2007, 242(2/3): 412- 418.
[14] Ritter E. Litter decomposition and nitrogen mineralization in newly formed gaps in a Danish beech (Fagussylvatica) forest. Soil Biology and Biochemistry, 2005, 37(7): 1237- 1247.
[15] 李晗, 吴福忠, 杨万勤, 徐李亚, 倪祥银, 何洁, 胡义. 亚高山森林林窗对凋落物分解过程中半纤维素动态的影响. 植物生态学报, 2015, 39(3): 229- 238.
[16] Jones R H, Mitchell R J, Stevens G N, Pecot S D. Controls of fine root dynamics across a gradient of gap sizes in a pine woodland. Oecologia, 2003, 134(1): 132- 143.
[17] Lin N, Bartsch N, Heinrichs S, Vor T. Long-term effects of canopy opening and liming on leaf litter production, and on leaf litter and fine-root decomposition in a European beech (FagussylvaticaL.) forest. Forest Ecology and Management, 2015, 338: 183- 190.
[18] 李志萍, 吴福忠, 杨万勤, 徐振锋, 苟小林, 熊莉, 殷睿, 黄莉. 川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征. 生态学报, 2015, 35(12): 3919- 3925.
[19] Arunachalam A, Arunachalam K. Influence of gap size and soil properties on microbial biomass in a subtropical humid forest of north-east India. Plant and Soil, 2000, 223(1/2): 187- 195.
[20] 周义贵, 郝凯婕, 李贤伟, 范川, 陈栎霖, 刘运科, 王谢. 林窗对米亚罗林区云杉低效林土壤有机碳和微生物生物量碳季节动态的影响. 应用生态学报, 2014, 25(9): 2469- 2476.
[21] 欧江, 张捷, 崔宁洁, 陈亚梅, 张健, 杨万勤, 刘洋. 采伐林窗对马尾松人工林土壤微生物生物量的初期影响. 自然资源学报, 2014, 29(12): 2036- 2047.
[22] Ritter E, Bjørnlund L. Nitrogen availability and nematode populations in soil and litter after gap formation in a semi-natural beech-dominated forest. Applied Soil Ecology, 2005, 28(2): 175- 189.
[23] Reinhart K O, Royo A A, Kageyama S A, Clay K. Canopy gaps decrease microbial densities and disease risk for a shade-intolerant tree species. Acta Oecologica, 2010, 36(6): 530- 536.
[24] 何振立. 土壤微生物量的测定方法: 现状和展望. 土壤学进展, 1994, 22(4): 36- 44.
[25] 周莉, 代力民, 谷会岩, 于大炮. 长白山阔叶红松林采伐迹地土壤养分含量动态研究. 应用生态学报, 2004, 15(10): 1771- 1775.
[26] Lagerlöf J, Adolfsson L, Börjesson G, Ehles K, Vinyoles G P, Sundh I. Land-use intensification and agroforestry in the Kenyan highland: impacts on soil microbial community composition and functional capacity. Applied Soil Ecology, 2014, 82: 93- 99.
[27] Lindstrom J E, Barry R P, Braddock J F. Microbial community analysis: a kinetic approach to constructing potential C source utilization patterns. Soil Biology and Biochemistry, 1998, 30(2): 231- 239.
[28] 胡婵娟, 傅伯杰, 刘国华, 靳甜甜, 刘宇. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性. 生态学报, 2009, 29(2): 727- 733.
[29] 王强, 戴九兰, 吴大千, 余悦, 申天琳, 王仁卿. 微生物生态研究中基于BIOLOG方法的数据分析. 生态学报, 2010, 30(3): 817- 823.
[30] Lauber C L, Hamady M, Knight R,etal. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology, 2009, 75(15): 5111- 5120.
[31] Bradley K, Drijber R A, Knops J. Increased N availability in grassland soils modifies their microbial communities and decreases the abundance of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry, 2006, 38(7): 1583- 1595.
[32] 赵玉涛, 韩士杰, 李雪峰, 胡艳玲. 模拟氮沉降增加对土壤微生物量的影响. 东北林业大学学报, 2009, 37(1): 49- 51.
[33] 卜丹蓉, 周丹燕, 葛之葳, 王国兵, 张文文, 彭赛, 阮宏华, 曹国华. 施用沼液对苏北沿海杨树人工林土壤活性有机碳的影响. 生态学杂志, 2015, 34(7): 1785- 1790.
[34] Sugihara S, Shibata M, Mvondo Ze A D, Araki S, Funakawa S. Effects of vegetation on soil microbial C, N, and P dynamics in a tropical forest and savanna of Central Africa. Applied Soil Ecology, 2015, 87: 91- 98.
[35] 王芳, 图力古尔. 土壤真菌多样性研究进展. 菌物研究, 2014, 12(3): 178- 186.
[36] 高天雷, 尹学明. 人造林窗对粗枝云杉人工林土壤微生物量的影响. 四川林业科技, 2014, 35(3): 27- 31.
[37] 朱教君, 谭辉, 李凤芹, 陈梅, 胡理乐. 辽东山区次生林3种大小林窗夏季近地面气温及土壤温度比较. 林业科学, 2009, 45(8): 161- 165.
[38] 刘少冲, 王敬华, 段文标, 陈立新, 王丽霞, 杜珊, 赵健慧. 小兴安岭阔叶红松混交林林隙特征. 生态学报, 2013, 33(17): 5234- 5244.
[39] 殷睿, 徐振锋, 吴福忠, 苟小林, 熊莉, 唐仕姗, 谢承瀚, 杨万勤. 川西高山森林林窗对季节性冻融期土壤氮动态的影响. 生态学杂志, 2014, 33(9): 2483- 2489.
[40] Ni X Y, Yang W Q, Tan B, He J, Xu L Y, Wu F Z. Accelerated foliar litter humification in forest gaps: dual feedbacks of carbon sequestration during winter and the growing season in an alpine forest. Geoderma, 2015, 241: 136- 144.
[41] 吴庆贵, 谭波, 杨万勤, 吴福忠, 何伟, 倪祥银. 亚高山森林林窗大小对凋落叶木质素降解的影响. 生态学报, 2016, 36(18): 5701- 5711.
[42] 曹成有, 姚金冬, 韩晓姝, 张颖. 科尔沁沙地小叶锦鸡儿固沙群落土壤微生物功能多样性. 应用生态学报, 2011, 22(9): 2309- 2315.
[43] Gálhidy L, Mihók B, Hagyó A, Rajkai K, Standovár T. Effects of gap size and associated changes in light and soil moisture on the understorey vegetation of a Hungarian beech forest. Plant Ecology, 2006, 183(1): 133- 145.
[44] 刘运科. 人造林窗下粗枝云杉细根分解与养分释放[D]. 雅安: 四川农业大学, 2012: 55.
[45] Fownes J H, Harrington R A. Seedling response to gaps: separating effects of light and nitrogen. Forest Ecology and Management, 2004, 203(1/3): 297- 310.
[46] 张艳, 张丹桔, 张健, 杨万勤, 邓长春, 李建平, 李勋, 唐仕姗, 张明锦. 马尾松人工林林窗大小对两种凋落叶难降解物质含量的影响. 植物生态学报, 2015, 39(8): 785- 796.
[47] 洪伟, 吴承桢, 林成来, 赖建明. 福建龙栖山森林群落林窗边缘效应研究. 林业科学, 2000, 36(2): 33- 38.
[48] 宋小艳, 张丹桔, 张健, 李建平, 邓长春, 邓超. 马尾松人工林林窗对土壤团聚体及有机碳分布的影响. 应用生态学报, 2014, 25(11): 3083- 3090.
[49] 韩文娟, 袁晓青, 张文辉. 油松人工林林窗对幼苗天然更新的影响. 应用生态学报, 2012, 23(11): 2940- 2948.
[50] Zhu J J, Zhang G Q, Wang G G, Yan Q L, Lu D L, Li X F, Zheng X. On the size of forest gaps: can their lower and upper limits be objectively defined? Agricultural and Forest Meteorology, 2015, 213: 64- 76.

