生物土壤结皮演替对土壤生态化学计量特征的影响
高丽倩,赵允格,,*,许明祥,,孙 会,杨巧云
1 中国科学院水利部水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100 2 西北农林科技大学水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室, 杨凌 712100 3 北方民族大学 生物科学与工程学院,银川 750021
生态化学计量学,是研究生物系统能量平衡和多重化学元素平衡的科学,以及元素平衡对生态交互作用影响的一种理论,是近年来新兴的一个生态学研究领域,是生态学与生物化学、土壤化学研究领域的新方向,也是研究土壤——植物相互作用与碳(C)、氮(N)、磷(P)循环的新思路[1- 2]。目前,生态化学计量学已经广泛应用于种群动态、养分利用效率、生态系统比较分析和森林演替与衰退及全球C、N、P生物地球化学循环等研究中,并取得了许多研究成果[2]。土壤作为生态系统养分循环的重要调节者而备受重视,因此生态化学计量学在土壤养分循环与限制作用研究中的应用也越来越受到关注[2- 4]。
生物土壤结皮(简称生物结皮)在干旱、半干旱生态系统中占有重要位置,其中的固氮蓝藻可以增加表层土壤的N输入[5-6],结皮生物固定的C可以增加表层土壤的有机质含量,保持土壤肥力[7-8]。因此,其对干旱半干旱地区的养分循环有着不可忽视的作用[7, 9]。据估计,每年由生物结皮输入土壤的N可达0.7—100 kg/hm2[6,10],对C的吸收约为3.9 Pg/a,相当于陆地植被净初级生产力的7%[11]。生物结皮可以活化P,使表层全P及速效P均显著增加[12-14]。因此,生物结皮的发育演替可能同时改变了土壤养分的化学计量特征,相关的研究却鲜见报道。而从生态化学计量特征的角度分析干旱半干旱地区生物结皮对土壤养分的贡献,可能更能揭示生物结皮在生态系统中对养分的供给功能。基于此,本研究以黄土丘陵区生态恢复初期(< 30 a)生物结皮为对象,研究该区生物结皮演替过程中C、N、P含量及其化学计量特征的变化,从土壤化学计量特征角度揭示生物结皮对干旱半干旱生态系统养分的贡献,以期为该区生态恢复和管理提供科学依据。
1 材料与方法
1.1 研究区概况
研究主要在陕西省延安市安塞县(109°18′E,36°51′N)进行。该县属于典型的黄土高原丘陵沟壑区,气候区划上属于暖温带半干旱季风气候。平均海拔1200 m,相对高差100—300 m,年均气温8.8℃,多年平均降水量505 mm。年日照2300—2400 h,≥10℃的积温为3282 ℃,干燥度指数K=1.48,无霜期157 d,降水年度分配不均,7—9月降水量占年降水量的60%左右,且多暴雨。
地带性土壤为黑垆土,由于严重的水土流失,黑垆土损失殆尽,土壤以黄土母质上发育来的黄绵土(钙质干润雏形土)为主。植被区划上,属于森林草原的南部边缘,地带性植被为暖温性灌草丛和草甸草原群落,主要物种有长芒草(Stipabungeana)、白羊草(Bothriochloaischaemun)、达乌里胡枝子(Lespedezadavurica)、铁杆蒿(Artemisiasacrorum)、茭蒿(Artemisiagiraldii)、茵陈蒿(Artemisiacapillaries)、黄刺玫(Rosaxanthina)、狼牙刺(Sophoraviciifolia)、沙棘(Hippophaerhamnoides)以及柠条(Caraganakorshinskii)等。
1.2 样品采集及测定项目
1.2.1 不同演替阶段生物结皮样品采集
以研究区退耕3—30 a的撂荒地为研究对象,结合生物结皮的盖度及生物量选取人为扰动少,生物结皮相对完整的退耕地作为研究样地,包括生物结皮的不同发育阶段(表1),共计56个样地。并以同区域坡耕地作为裸地对照。样地特征及物理属性参见文献[15]。每个样地用25样点法(25 cm×25 cm小样方)以样地形状按照梅花状或之字状布设10个样方调查生物结皮种类及盖度,记录样方中藓、地衣、藻、裸土、小石砾、高等植物、植物枯落物的出现频率,以各类物种在调查总点数的百分数计算其相应的覆盖度。同时记录采样区海拔、坡度、坡向、植被状况及土壤侵蚀状况等立地条件。每个样地选取5点分别采取生物结皮层及其下伏0—2 cm,2—5 cm和5—10 cm的土壤样品,同层混合作为一个分析样。土壤样品带回实验室风干,过1 mm和0.25 mm筛备用。同时用直径为9 cm的培养皿在每个土壤样品采集点附近采集原状生物结皮样品,风干遮光保存以测定生物结皮生物量。采样时,选取高等植被间的空地进行,避免植被根系影响。
1.2.2 测定项目及方法
土壤有机碳采用重铬酸钾外加热法测定。
全氮采用凯氏定氮法测定。
全磷采用高氯酸-硫酸消解钼锑抗比色法测定。
藓生物量测定:将风干遮光保存的藓结皮用水喷湿,使其脱离休眠状态,然后用打孔器取一定面积(0.95 cm2)的样品放入网筛中冲洗,收集网筛中藓植物放至称量瓶中,于85℃杀青30 min后,65℃烘干至恒重后称重,计算出单位面积藓植物生物量(g/dm2)。运用聚类分析方法将藓生物量划分为6个等级,代表生物结皮的发育阶段,见表1。
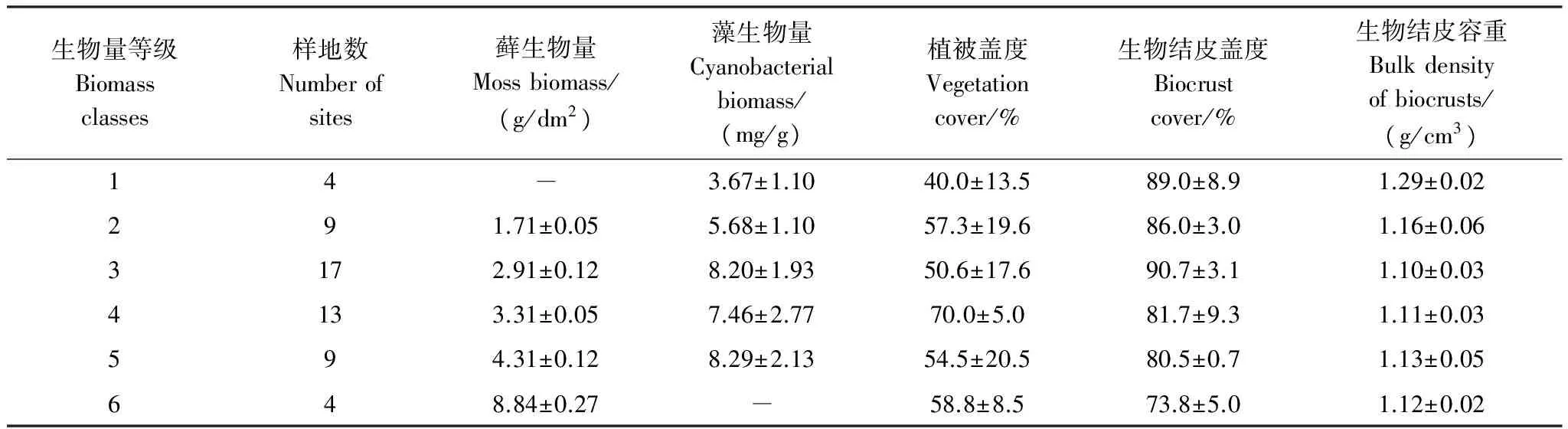
表1 生物结皮演替阶段生物量等级划分及概况
藻生物量测定[16]:在暗处用研钵研磨藻结皮,使藻体分散。取(2±0.01)g样品装入具塞刻度试管中,向试管中加入10 mL二甲基亚砜(DMSO),置于65℃恒温水浴锅中遮光萃取1 h,之后用滤纸过滤,取上清液于波长665 nm和750 nm处测吸光值,然后加5滴1 mol/L HCl酸化,10 min后置于波长665 nm和750 nm处再次测吸光值。藻类叶绿素a含量的计算公式为:
Chla=26.73×[(E665-E750)-(A665-A750)]×V/M
(1)
式中: Chla为测定的叶绿素a含量(mg/g);E665和E750分别为萃取液酸化前于波长665 nm和750 nm处的吸光值;A665和A750分别为萃取液酸化后于波长665 nm和750 nm处的吸光值;V为萃取液体积(mL);M为土样质量(g)。
土壤养分恢复指数(NRI)[17]:以坡耕地为对照,计算土壤C、N、P含量及其化学计量比在生物结皮不同演替阶段与坡耕地之间的差异,最后将各属性的差异求和平均,以定量描述生物结皮演替对土壤养分的恢复改良作用。土壤恢复指数的计算公式为:
(2)

1.3 数据处理
本研究中土壤C、N、P比值均采用元素质量比,运用SPSS 18.0对不同演替阶段生物结皮土壤C、N、P含量及其化学计量特征进行单因素方差分析和LSD多重比较。其中运用Kolmogorov-Smirnov test 检验数据的正态性, Levene′s test进行方差齐性检验。
2 结果分析
2.1 生物结皮演替过程中土壤C、N、P含量的变化
土壤有机C含量随着生物结皮的发育演替显著增加(图1)。生物结皮由初期阶段(生物量等级1)演替至较后期(生物量等级6)时,土壤有机C含量增加了9.4 g/kg,增幅为161%。其下层0—10 cm土壤有机C含量增幅较小,其中0—2 cm土壤有机C含量显著高于2—5 cm和5—10 cm土壤,2—5 cm和5—10 cm土壤无显著差异。随着生物结皮的发育演替,生物结皮层与其下层0—10 cm土壤有机C含量的差异显著增大。生物结皮演替、土层深度及其交互作用对土壤有机C的影响均表现为显著水平(P<0.05,表2),且土壤有机C含量在土层深度上的差异(偏η2=0.773)显著高于生物结皮演替及其交互作用。用土壤有机C的增加量(生物结皮层与其下层5—10 cm土壤有机C含量的差值,ΔC)进一步反映生物结皮的发育对土壤有机C的影响(图1),ΔC随着生物结皮的演替显著增加,演替后期约为初期的3.3倍。
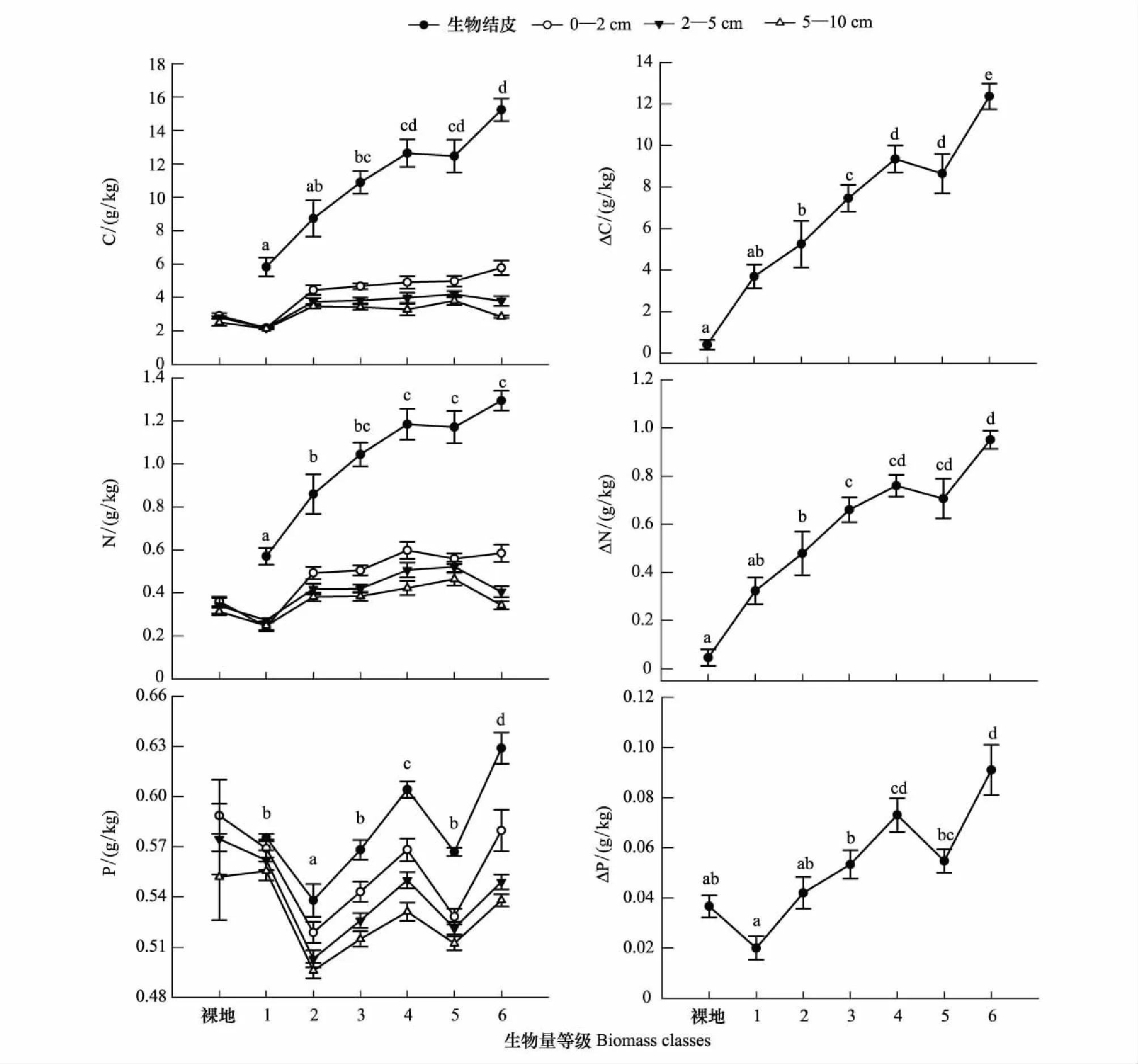
图1 生物结皮发育对土壤C、N、P含量的影响Fig.1 Influences of biocrust succession on the contents of organic C, total N and P
土壤全N含量随着生物结皮的演替呈显著上升趋势(图1)。生物结皮由演替初期发育至后期,土壤全N含量增加了0.7 g/kg,增幅为127%。其下层0—10 cm土壤全N含量变化较小,0—2 cm显著高于2—5 cm和5—10 cm土壤,2—5 cm和5—10 cm土壤无显著差异。与有机C含量类似,随着生物结皮的发育演替,生物结皮层与其下层0—10 cm土壤的全N含量差异显著增加。生物结皮演替、土层深度及其交互作用对土壤全N的影响均达显著水平(P<0.05,表2)。全N含量在土层深度上的差异(偏η2=0.740)显著高于生物结皮演替及其交互作用。同样用土壤全N增加量(生物结皮层与其下层5—10 cm土壤全N含量的差值,ΔN)进一步反映生物结皮的发育对土壤全N的影响(图1),ΔN随着生物结皮的演替显著增加,演替后期约为初期的1.9倍。
土壤全P含量随生物结皮的演替呈先降低后增加的趋势(图1)。生物结皮演替至第2阶段时,全P含量降低了9%,之后随着生物结皮的演替,全P含量呈现增加趋势,演替后期较初期增加了9%,较第2阶段增加了17%。生物结皮层全P含量显著高于其下层0—2 cm、2—5 cm和5—10 cm土壤,且随着土壤深度加深显著降低。生物结皮演替和土层深度对土壤全P的影响均表现为显著水平(P<0.05,表2),生物结皮演替的影响(偏η2=0.540)高于土层深度(偏η2=0.482),其交互作用对全P无显著影响。用土壤全P增加量(生物结皮层与其下层5—10 cm土壤全P含量的差值,ΔP)进一步反映生物结皮的发育对土壤全P的影响(图1),土壤全P在生物结皮演替前期无明显增加,在第2演替阶段以后ΔP显著增加,演替后期约为初期的2.7倍。
2.2 生物结皮演替对土壤生态化学计量特征的影响
土壤C/N随生物结皮的演替呈缓慢增加趋势(图2)。在生物结皮演替过程中土壤C/N的范围为10.0—11.8,较裸地(8.2)增加了22%—43%。生物结皮演替后期较初期C/N增加了16%。生物结皮C/N显著高于其下层0—2 cm、2—5 cm和5—10 cm土壤,其下层土壤(范围为8.0—9.9)无显著差异。生物结皮演替及土层深度对C/N的影响均达显著水平(P<0.05,表3)。土壤C/N在土壤层次上的差异(偏η2=0.323)高于生物结皮演替(偏η2=0.130),其交互作用对C/N无显著影响。
土壤C/P随生物结皮的演替显著增加,范围为10.1—24.3,较裸地(5.0)增加了1.0—3.9倍,至第三演替阶段后,无显著变化(图2)。生物结皮C/P显著高于其下层0—2 cm、2—5 cm和5—10 cm土壤,0—2 cm显著高于5—10 cm土壤,下层0—10 cm土壤C/P范围为3.9—10.0。随着生物结皮演替,生物结皮层与下层0—10 cm土壤C/P差异显著增加,下层0—2 cm、2—5 cm和5—10 cm土壤C/P在第二演替阶段之后分层更加明显。生物结皮演替、土层深度及其交互作用对C/P的影响均表现为显著水平(P<0.05,表3)。土壤C/P在土层深度上的差异(偏η2=0.749)显著高于生物结皮演替及其交互作用。
土壤N/P随生物结皮的演替显著增加,范围为1.0—2.1,较裸地(0.6)增加了0.6—2.5倍,至第三演替阶段后,N/P无显著变化(图2)。生物结皮N/P显著高于其下层0—2 cm、2—5 cm和5—10 cm土壤,0—2 cm显著高于5—10 cm土壤,下层0—10 cm土壤N/P范围为0.4—1.1。随着生物结皮演替,生物结皮层与下层0—10 cm土壤N/P的差异显著增加,下层0—2 cm、2—5 cm和5—10 cm土壤N/P在第二演替阶段之后分层更加明显。生物结皮演替及土层深度对N/P的影响均达显著水平(P<0.05,表3),土壤N/P在土壤层次上的差异(偏η2=0.694)高于生物结皮演替(偏η2=0.334),其交互作用对N/P无显著影响。

表2 生物结皮演替、土层深度及其交互作用对土壤C、N、P含量的影响
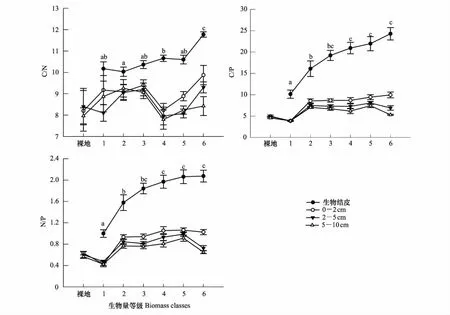
图2 生物结皮演替对土壤C、N、P生态化学计量特征的影响Fig.2 Effects of biocrust succession on soil C/N, C/P and N/P
2.3 生物结皮土壤生态化学计量特征影响因子
用冗余分析(RDA)对生物结皮土壤化学计量比与生物、地形和土壤因子之间的相关性进行了分析(图3)。结果显示,土壤化学计量特征与生物结皮生物量和盖度、地形及土壤因子显著相关(P=0.002),且第一轴和第二轴能够解释74.3%的变异(第一轴:73.9%,第二轴:0.5%)。土壤化学计量比与坡向、藓结皮生物量显著正相关(即阴坡>阳坡),与土壤容重显著负相关。

表3 生物结皮演替、土层深度及其交互作用对C、N、P化学计量比的影响

图3 生物结皮C、N、P化学计量比与生物、地形和土壤因子之间的关系排序图(解释量为74.3%,P=0.002)Fig.3 Redundancy analysis between the relative ecological stoichiometry characteristics and biocrust, topographic and soil factors (The first two axes explained 74.3% of the variance, P=0.002)MB:藓生物量 Moss biomass;Mcover:藓结皮盖度 Moss cover;Ccover:藻结皮盖度 Cyanobacterial cover;Chla:藻结皮生物量 Cyanobacterial biomass;Aspect:坡向 Slope aspect;Position:坡位 Slope position;Elev:海拔 Elevation;Grad:坡度 Gradient;BD:容重 Soil bulk density

图4 生物结皮演替对土壤养分恢复的影响Fig.4 Effects of biocrusts on the recovery of soil nutrients
2.4 生物结皮演替对土壤养分恢复的影响
土壤养分恢复指数(NRI)随着生物结皮演替显著增加(图4)。生物结皮演替初期土壤NRI为58%(以坡耕地为对照),演替后期为227%,较初期增加了291%。NRI在土壤层次上表现为生物结皮层 > 0—2 cm > 2—5 cm和5—10 cm土壤,其中2—5 cm和5—10 cm土壤无显著差异。生物结皮下层土壤养分在演替初期较坡耕地略有退化,NRI为-14%,至演替的第二阶段开始有所恢复,但是恢复程度较小。
3 讨论
3.1 生物结皮演替对土壤C、N、P含量及其化学计量特征的影响
生物结皮是干旱、半干旱生态系统重要的N源和C源,显著影响土壤有机C和全N含量[6-7,18]。生物结皮的固N和C量因地区和物种组成不同而存在差异。沙漠地区每年平均N输入量为6 kg/hm2[11],且以Collemaspp.和Nostocspp.为主的藻结皮固氮活性显著高于藓结皮[10]。处于半干旱地区的黄土丘陵区藻结皮年均固N量为13 kg/ hm2,而藓结皮年均固N量约为3 kg/hm2[5]。与固N不同,演替后期的藓结皮的固C能力显著高于早期藻结皮[12,18]。本研究也发现随着生物结皮的演替及藓的殖入,有机C和全N含量均显著增加。虽然藓结皮的固N能力较藻结皮低,但由于前期的N累积以及藓有机体的腐烂导致演替后期藓结皮土壤全N含量高于前期藻结皮。生物结皮对全P的影响与有机C和全N有所差异。在生物结皮演替过程中虽然全P含量呈现先降低后增加的趋势,但全P增加量(ΔP)随着生物结皮的演替呈现弱增加趋势,表明随着生物结皮的演替,其对全P的影响增加。徐杰等[19]也发现土壤P含量与苔藓植物生物量呈明显正相关(P<0.05)。张国秀等[14]在黄土丘陵区的研究也同样发现生物结皮的发育可以显著提高生物结皮层全P含量。土壤C、N、P化学计量特征在不同地区存在差异(表4)。这可能与不同地区土壤母质和气候条件不同有关。但是各地区均表现为演替后期藓结皮C、N、P化学计量比高于前期藻结皮,这与本研究结果一致。说明无论是何种气候和土壤母质,生物结皮对土壤化学计量特征的影响是毋庸置疑的,特别是在极地高寒地区,生物结皮土壤C/N、C/P和N/P可高达40.0、7500.0和187.5[20],但是其影响程度在不同地区可能存在差别。
通过对C、N、P化学计量比与生物、地形及土壤因子的分析(图3)表明,地形因子坡向对C、N、P化学计量特征的影响较大。这可能与不同坡向水热条件不同导致各元素分解矿化速率不同有关。研究发现阳坡的全P含量显著高于阴坡[14],C/P与N/P则较低[21]。不同的坡向生物结皮的演替阶段和生物组成也不同[22],阴坡藓结皮盖度及生物量均高于阳坡,这也进一步说明生物结皮不同演替阶段对土壤生态化学计量比的影响存在差异。其次,藓生物量与土壤C/N、C/P和N/P显著正相关,进一步说明生物结皮的演替对C、N、P化学计量比的影响较大。土壤容重与土壤生态化学计量比显著负相关,这可能是由于生物结皮层土壤容重随着生物结皮的发育显著降低(表1),同时土壤孔隙度增加[15],进而影响微生物活性[23],这也间接说明生物结皮演替对土壤化学计量特征的影响。

表4 不同地区生物结皮土壤化学计量特征
由于生物结皮的发育,有机C和全N含量在表层急剧增加,显著高于其下层0—10 cm土壤,此差异随着生物结皮的发育显著增大(图1)。而生物结皮对P的影响作用较有机C和全N小,其在土壤层次上表现出显著地分层现象(图1)。生物结皮演替、土壤深度及其交互作用对土壤C、N、P含量的影响也同样说明生物结皮的演替使其在垂直分布上显著地不同于下层土壤,特别是C和N含量由于生物结皮发育使其在土壤层次上的差异最大(表2和3),而对P的影响作用则较小,这可能与土壤P含量主要取决于土壤母质有关[24]。生物结皮对有机C和全N在土层深度上的影响较有限,仅可增加其下0—2 cm土壤有机C和全N含量,这可能与固C和固N生物对光的需求有关。土壤C、N、P化学计量特征的结果同样证明生物结皮的发育演替使生物结皮层与其下层土壤存在显著差异,且此差异随着生物结皮的演替显著增大(图2)。生物结皮演替、土壤深度及其交互作用对土壤化学计量特征的影响也说明生物结皮C、N、P化学计量特征在土壤层次上的差异显著高于生物结皮演替及其交互作用,特别C/P和N/P在生物结皮层与下层土壤间差异较大(表3)。因此,生物结皮作为干旱半干旱地区重要的地表覆被物,其与下层土壤的显著差异使其具有特殊的生态功能。
3.2 生物结皮对干旱半干旱地区土壤养分循环的影响
土壤C、N、P化学计量比是反映土壤内部C、N、P循环的主要指标,是确定土壤C、N、P平衡特征的一个重要参数,也可以作为C、N、P矿化作用和固持作用的评价指标[28-29]。土壤C/N是土壤质量的敏感指标,影响土壤中有机C和N的循环[30]。一般来讲,土壤C/N与有机质分解速率成反比关系[4]。本研究表明生物结皮土壤C/N的范围为10.0—11.8,显著高于该区域农耕地(8.2),但是与本区域森林区0—10 cm土壤(9.5—12.6)相近[21]。说明在生物结皮演替过程中土壤有机C处于累积状态,同时在演替过程中C/N均小于矿化和同化过程的平衡值(15.0),因此,生物结皮演替依然可以向土壤提供较多的有效N供维管束植物利用。
较低的C/P是P有效性高的一个指标[4]。本研究表明,生物结皮演替过程中土壤C/P均显著高于同区域农耕地,但变化幅度较大。生物结皮演替初期土壤C/P约为10.1,与同区域森林草原区接近(5.5—10.6)[21],随着生物结皮的发育,C/P显著增加,到演替中后期(4等级后)趋于稳定,且最大值约为24.3,高于同区域森林区(12.6)[21]。说明随着生物结皮的演替,特别是演替中后期P的有效性降低,甚至可能会与维管束植物竞争周围环境中的P来维持生长[31]。但也有研究发现生物结皮可以向周围维管束植物提供较多的有效P[32],这可能与生物结皮种类、土壤水分或是pH不同有关[33-34]。因此,生物结皮是否可以向周围环境提供有效P需要进一步研究。
土壤中的N、P是植物生长所必需的矿质营养元素和生态系统中最常见的限制性元素,二者之间具有重要的相互作用,因此将N/P作为衡量系统N、P养分限制的一个指标。本研究发现,生物结皮演替过程中,N/P显著增加,至演替中后期(4等级后)N/P趋于稳定。高等植被的恢复过程中同样存在C/P和N/P随植被演替方向逐渐增加的趋势[35]。生物结皮层N/P(1.0—2.1)显著高于同区域森林区0—10 cm土壤(1.07)[21]。同样说明随着生物结皮的演替和时间推移,在生态恢复初期生物结皮土壤可能会受到P的限制。由于生物结皮能够固定C和N的特殊性,其受元素限制的临界N/P需要进一步研究,这也同时可能解释生物结皮是与周围维管束植物竞争养分还是向其提供养分的矛盾,对生物结皮的人工恢复也有一定的指导意义。
3.3 生物结皮在干旱半干旱地区生态恢复中的作用
干旱半干旱地区高等植被分布稀疏,生态系统较脆弱。生物结皮分布于高等植物间隙呈连续分布状态,而且高等植被越稀疏,生物结皮覆盖度越高,可达70%以上[18],对干旱半干旱地区生态恢复及生态系统的稳定具有重要的作用。通过分析生物结皮演替对土壤养分恢复的影响发现,生物结皮的演替可以较大程度地加速表层土壤养分的恢复(图4),这与高等植被的恢复有助于土壤C、N、P等养分的累积类似[35]。但生物结皮下层土壤在演替初期有所退化,至第2阶段后有所恢复,恢复程度远低于生物结皮层,这与高等植物恢复初期土壤养分含量有所下降,之后增加的结果相似[23, 36]。由于生物结皮能够固定C和N,使其在发育初期即可累积土壤养分,促进生态系统的恢复。但生物结皮对土壤的恢复在土壤层次上的作用有限,仅可以促进其下2 cm土壤的恢复(图4)。随着时间延长,生物结皮在土壤层次上的作用是否会增加,且在不同的气候区影响程度是否一致仍需要进一步研究。但生物结皮的发育演替能够稳定地表,增加土壤养分,改善地表环境,进而促进生态系统的恢复。因此,其作为干旱半干旱地区主要的地表覆被物,是促进该区特别是干旱地区生态恢复并维系脆弱生态系统稳定的关键因子。
综合生物结皮对土壤C、N、P含量及其化学计量特征的影响可以发现,由于生物结皮的作用,土壤养分快速累积,同时加速表层土壤恢复,使生物结皮层与其下层土壤显著不同。因此生物结皮的发育演替对于后期生态恢复会产生何种影响,以及如何管理生物结皮覆盖的土壤需要进一步研究。此外,对土壤化学计量特征的研究可能是探索生物结皮对地球化学循环影响的一个可能的途径。
4 小结
研究通过对黄土丘陵区生物结皮演替对土壤C、N、P含量及其化学计量特征的影响,得出以下结果:
(1)随着生物结皮演替,生物结皮层土壤C、N、P含量显著增加,演替后期较初期分别增加了161%、127%和9%,均显著高于其下层0—10 cm土壤,该差异随着生物结皮的演替显著增加。
(2)生物结皮演替过程中,C/N较为稳定,变化范围为10.0—11.8;C/P和N/P随着生物结皮演替显著增加,演替后期分别是初期的2.4倍和2.1倍, 生物结皮层C、N、P化学计量比均显著高于其下层0—10 cm土壤,该差异随着生物结皮演替显著增加。
(3)生物结皮土壤C、N、P化学计量特征与坡向、藓生物量显著正相关,与土壤容重显著负相关。
(4)生物结皮演替加速表层土壤养分恢复,影响程度可至其下2 cm土层。
(5)通过对生物结皮土壤化学计量特征的研究可能能够揭示干旱半干旱地区生物结皮对土壤养分循环的贡献,对生态恢复及管理提供科学依据。
[1] Zhang L X, Bai Y F, Han X G. Application of N: P stoichiometry to ecology studies. Acta Botanica Sinica, 2003, 45(9): 1009- 1018.
[2] 曾德慧, 陈广生. 生态化学计量学: 复杂生命系统奥秘的探索. 植物生态学报, 2005, 29(6): 1007- 1019.
[3] Michaels A F. The ratios of life. Science, 2003, 300(5621): 906- 907.
[4] 王绍强, 于贵瑞. 生态系统碳氮磷元素的生态化学计量学特征. 生态学报, 2008, 28(8): 3937- 3947.
[5] Zhao Y G, Xu M X, Belnap J. Potential nitrogen fixation activity of different aged biological soil crusts from rehabilitated grasslands of the hilly Loess Plateau, China. Journal of Arid Environments, 2010, 74(10): 1186- 1191.
[6] Belnap J. Nitrogen fixation in biological soil crusts from southeast Utah, USA. Biology and Fertility of Soils, 2002, 35(2): 128- 135.
[7] Belnap J. Biological soil crusts in deserts: a short review of their role in soil fertility, stabilization, and water relations. Algological Studies, 2003, 109(109): 113- 126.
[8] Belnap J, Miller D M, Bedford D R, Phillips S L. Pedological and geological relationships with soil lichen and moss distribution in the eastern Mojave Desert, CA, USA. Journal of Arid Environments, 2014, 106: 45- 57.
[9] Chamizo S, Cantón Y, Miralles I, Domingo F. Biological soil crust development affects physicochemical characteristics of soil surface in semiarid ecosystems. Soil Biology & Biochemistry, 2012, 49: 96- 105.
[10] Barger N N, Weber B, Garcia-Pichel F, Zaady E, Belnap J. Patterns and controls on nitrogen cycling of biological soil crusts // Weber B, Büdel B, Belnap J, eds. Biological Soil Crusts: An Organizing Principle in Drylands. Switzerland: Springer International Publishing, 2016: 257- 285.
[11] Elbert W, Weber B, Burrows S, Steinkamp J, Büdel B, Andreae M O, Pöschl U. Contribution of cryptogamic covers to the global cycles of carbon and nitrogen. Nature Geoscience, 2012, 5(7): 459- 462.
[12] 赵允格, 许明祥, 王全九, 邵明安. 黄土丘陵区退耕地生物结皮对土壤理化性状的影响. 自然资源学报, 2006, 21(3): 441- 448.
[13] 赵允格, 许明祥, 王全九, 邵明安. 黄土丘陵区退耕地生物结皮理化性状初报. 应用生态学报, 2006, 17(8): 1429- 1434.
[14] 张国秀, 赵允格, 许明祥, 高丽倩. 黄土丘陵区生物结皮对土壤磷素有效性及碱性磷酸酶活性的影响. 植物营养与肥料学报, 2012, 18(3): 621- 628.
[15] 高丽倩, 赵允格, 秦宁强, 张国秀, 杨凯. 黄土丘陵区生物结皮对土壤物理属性的影响. 自然资源学报, 2012, 27(8): 1316- 1326.
[16] Castle S C, Morrison C D, Barger N N. Extraction of chlorophyll a from biological soil crusts: a comparison of solvents for spectrophotometric determination. Soil Biology & Biochemistry, 2011, 43(4): 853- 856.
[17] 董莉丽, 郑粉莉. 黄土丘陵沟壑区土地利用和植被类型对土壤质量的影响. 兰州大学学报: 自然科学版, 2010, 46(2): 39- 44.
[18] Belnap J, Lange O L. Biological Soil Crusts: Structure, Function, and Management. Berlin Heidelberg: Springer-Verlag, 2003.
[19] 徐杰, 白学良, 田桂泉, 黄洁, 张镝, 冯晓慧. 腾格里沙漠固定沙丘结皮层藓类植物的生态功能及与土壤环境因子的关系. 中国沙漠, 2005, 25(2): 234- 242.
[20] Breen K, Lévesque E. The influence of biological soil crusts on soil characteristics along a high arctic glacier foreland, Nunavut, Canada. Arctic, Antarctic, and Alpine Research, 2008, 40(2): 287- 297.
[21] 朱秋莲, 邢肖毅, 张宏, 安韶山. 黄土丘陵沟壑区不同植被区土壤生态化学计量特征. 生态学报, 2013, 33(15): 4674- 4682.
[22] Zhao Y G, Qin N Q, Weber B, Xu M X. Response of biological soil crusts to raindrop erosivity and underlying influences in the hilly Loess Plateau region, China. Biodiversity and Conservation, 2014, 23(7): 1669- 1686.
[23] Zhang C, Liu G B, Xue S, Wang G L. Soil bacterial community dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau. Soil Biology & Biochemistry, 2016, 97: 40- 49.
[24] 刘兴诏, 周国逸, 张德强, 刘世忠, 褚国伟, 闫俊华. 南亚热带森林不同演替阶段植物与土壤中N、P的化学计量特征. 植物生态学报, 2010, 34(1): 64- 71.
[25] Zhang B C, Zhou X B, Zhang Y M. Responses of microbial activities and soil physical-chemical properties to the successional process of biological soil crusts in the Gurbantunggut Desert, Xinjiang. Journal of Arid Land, 2015, 7(1): 101- 109.
[26] Zhao H L, Guo Y R, Zhou R L, Drake S. Biological soil crust and surface soil properties in different vegetation types of Horqin Sand Land, China. Catena, 2010, 82(2): 70- 76.
[27] 肖波, 赵允格, 许明祥, 邵明安. 陕北黄土区生物结皮条件下土壤养分的积累及流失风险. 应用生态学报, 2008, 19(5): 1019- 1026.
[28] Dise N B, Matzner E, Forsius M. Evaluation of organic horizon C: N ratio as an indicator of nitrate leaching in conifer forests across Europe. Environmental Pollution, 1998, 102(1): 453- 456.
[29] Gundersen P, Callesen I, de Vries W. Nitrate leaching in forest ecosystems is related to forest floor ratios. Environmental Pollution, 1998, 102(Suppl 1): 403- 407.
[30] 任书杰, 曹明奎, 陶波, 李克让. 陆地生态系统氮状态对碳循环的限制作用研究进展. 地理科学进展, 2006, 25(4): 58- 67.
[31] Harper K T, Belnap J. The influence of biological soil crusts on mineral uptake by associated vascular plants. Journal of Arid Environments, 2001, 47(3): 347- 357.
[32] 闫德仁. 沙漠生物结皮对维管植物养分吸收的影响. 干旱区资源与环境, 2009, 23(10): 177- 181.
[33] Zhao Y M, Zhu Q K, Li P, Zhao L L, Wang L L, Zheng X L, Ma H. Effects of artificially cultivated biological soil crusts on soil nutrients and biological activities in the Loess Plateau. Journal of Arid Land, 2014, 6(6): 742- 752.
[34] Wu Y W, Rao B Q, Wu P P, Liu Y D, Li G B, Li D H. Development of artificially induced biological soil crusts in fields and their effects on top soil. Plant and Soil, 2013, 370(1): 115- 124.
[35] 曾全超, 李鑫, 董扬红, 安韶山. 黄土高原延河流域不同植被类型下土壤生态化学计量学特征. 自然资源学报, 2016, 31(11): 1882- 1891.
[36] 赵晓单, 曾全超, 安韶山, 方瑛, 马任甜. 黄土高原不同封育年限草地土壤与植物根系的生态化学计量特征. 土壤学报, 2016, 53(6): 1541- 1551.

