内镜治疗胃食管反流病的创新发展
王 雯
(南京军区福州总医院消化内科,福建省福州市 350025)

王雯,女,南京军区福州总医院消化内科主任、主任医师,医学博士。从事消化内科及消化内镜的临床工作三十年,积累了丰富的救治消化内科危重病及疑难疾病的临床经验。
现为中华医学会消化内镜学分会委员、中国医师协会内镜医师分会常委、消化内镜专业委员会常委、胰腺病专业委员会委员、福建省消化内镜学分会主任委员、福建省消化病学分会副主任委员、中关村泛亚消化内镜技术产业技术创新战略联盟理事;中国消化内镜学院委员;中华医学会消化内镜学分会超声内镜学组委员,中华医学会消化内镜学分会胃疾病协作组委员,担任《中华消化内镜杂志》、《中华胰腺病杂志》、《中华胃食管反流病电子杂志》编委和《Eur J Gastroenterol Hepatol 》审稿专家。科研主攻方向为胃肠动力障碍性疾病及胃酸相关疾病,发表论文100余篇,其中SCI论文15篇,主编专著一部,以第一作者承担省部级重点课题7项,获国家专利授权7项。获得福建省科技进步一等奖、军队医疗成果二等奖、福建省科技进步二等奖等5项科技奖。为南京军区科技英才、军区优秀青年科技人才、第九届福建青年科技奖、福建运盛青年奖、福建省“百千万工程”人才、军区卫生专业学科带头人培养对象(122工程)和军区“334”高层次科技拔尖人才。
胃食管反流病(gastroesophageal reflux disease,GERD)是消化系统常见的疾病之一,在全世界均有较高的患病率,其在韩国、中国、欧洲的患病率分别为4.6%~10.7% 、12.5%~12.7%、8.8%~25.9%[1-4],在北美地区的患病率甚至高达18.1%~27.8%。因此,GERD的治疗一直受到人们的广泛关注。目前,GERD的治疗方法主要有药物、内镜微创治疗以及外科手术,通常以药物治疗为主。但由于GERD易复发,常需长期甚至终身治疗,不仅患者的依从性差、花费高,而且容易引起药物相关并发症,因此内镜下微创手术逐渐受到了人们的重视。
1 传统的GERD内镜治疗方法
传统的GERD内镜治疗方法主要有局部注射疗法,它主要是通过内镜下于胃食管交界处(EGJ)局部注射生物可溶性物质或者硬化剂,使得EGJ局部隆起,管腔内径减小,从而增加食管下括约肌(low esophageal sphincter,LES)静息压,最终达到治疗GERD的目的。临床上主要有Enteryx疗法、Gatekeeper疗法以及Durasphere疗法。
1.1 Enteryx法 Enteryx法是将由二甲基亚砜(DMS0)和X线造影剂钽(Ta)及8%的乙烯醇聚合物组成的可注射填充物,注入LES处的肌层或黏膜下层深部,通过增加LES处的压力和强度,从而达到治疗GERD的目的。但是,由于该项技术的安全性未得到保证,因此2005年FDA向全世界宣布停止使用Enteryx法治疗GERD。
1.2 Gatekeeper法(GK法) GK法通过将聚丙烯腈水凝胶注入LES处,形成人工LES屏障,从而使得LES处的压力增加, 胃食管交界处内径减小,实现抗反流效果。Fockens等[5]进行了一项长达6个月的前瞻性随机对照研究,结果发现,GK法治疗后GERD患者的反流、烧心症状均得到明显改善, 但与假手术组相比,二者间差异无统计学意义。并且研究中有4例出现严重并发症(2例食管穿孔、1例肺穿孔、1例严重胸痛)。由于该项技术可能发生严重的并发症,且临床疗效尚不确定, 因此目前临床上该项技术已经基本停用。
1.3 Durasphere法 Durasphere法主要是在LES四个象限的黏膜下层分别注射由碳粒子组成的生物相容可注射填充物,从而增加LES压力,达到治疗胃食管反流的目的。美国的一项单中心研究[6]对Durasphere治疗后的GERD患者进行了长达12个月的随访,结果发现Durasphere治疗后,其中70%的患者达到了完全停用PPI的效果,而PPI使用剂量减少一半以上的患者高达90%,且治疗前后GERD患者的DeMeester评分分别为44.5、26.5。整个研究过程未出现严重的食管炎、糜烂、溃疡等并发症。但是由于目前对该项技术的研究较少,因此其具体疗效仍待进一步的考察。
2 新型内镜下治疗在GERD中的应用
2.1 内镜下微量射频治疗 内镜下微量射频主要是由带有四根电极针的球囊装置特制的导管构成。首先通过普通电子胃镜进行常规检查,并明确齿状线位置,分别对齿状线、齿状线上方0.5 cm、齿状线上方1 cm、齿状线下方0.5 cm处进行微量射频治疗。导管置入治疗面时,首先将球囊充气20 mL,固定治疗部位,张开球囊自带的4根电极针插入至肌层,通电进行1 min的射频热能治疗,在温度监视器的作用下, 控制肌层低于85℃,当温度达到85℃时,射频发生器自动停止能量输入,同时在治疗过程中通过不断注入消毒水,以保证黏膜温度低于45℃。1 min治疗结束后,首先收回电极针,而后释放球囊,旋转45°后再次将球囊充气至20 mL,出针,再次行1 min的射频治疗。整个食管下端总共行32点位的射频治疗(初始位置治疗1次,旋转45°治疗1次,4个治疗层面)。结束了食管部位的治疗后,将放气的球囊深插至胃内,球囊充气25 mL,回撤导管,稍有阻力时出针通电治疗1 min,收针,推入胃内,旋转30°,回撤后再次出针治疗1 min;再次收针,推入胃内,旋转30°(与前次同一方向),回撤出针治疗1 min;而后收针,球囊充气22 mL,在贲门略高平面进行治疗,过程同上。贲门处总共进行24点位的射频治疗(初始位置治疗1次,左转30°和右转30°各治疗1次)。整个手术过程只需在镇静下完成。见图1。
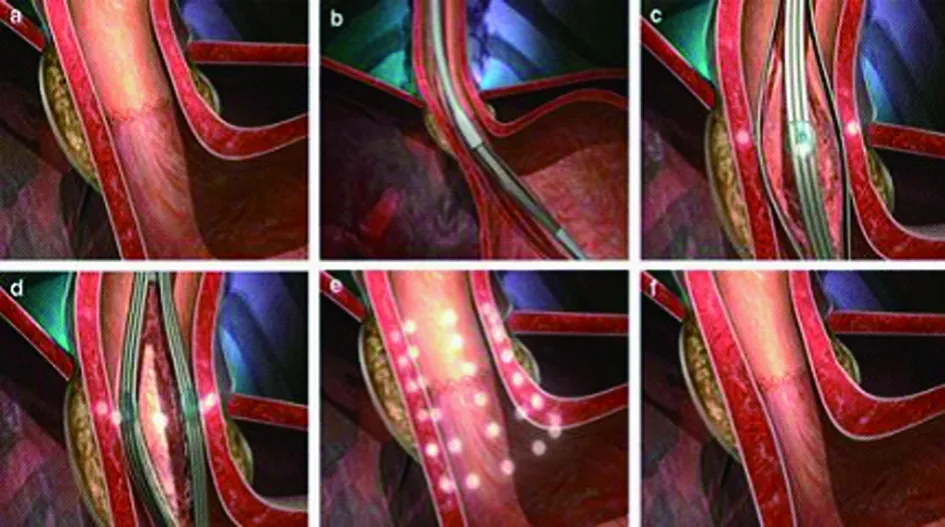
图1 微量射频示意图
食管下段及胃贲门处进行射频热能治疗后,不仅使得局部组织纤维化增厚,而且射频可破坏迷走神经节,阻断一过性食管下括约肌(LES)松弛,从而减少一过性LES松弛的发生次数及食管酸暴露,可以明显改善GERD症状。临床上主要应用美国Curon公司生产的射频治疗装置,即Stretta射频装置。
刘海峰等[7]对90例行微量射频治疗的GERD患者进行了治疗前、治疗后1年、治疗后5年三个时间点的随访,其中90例完成1年的随访,67例完成5年随访,比较射频前后的GERD-健康相关生活质量(GERD-HRQL)评分及烧心平均积分,结果发现:GERD-HRQL评分及烧心平均积分由治疗前的(25.6±9.0)、(3.3±1.3),分别降至治疗后1年时的(8.1±3.9)、(1.2±1.1),以及5年时的(8.7±3.4)、(1.3±1.0),均有统计学差异(P<0.05)。且治疗前仅有31.1%的患者对药物治疗感到满意,而治疗后1年、5年时,患者满意度分别升至86.7%、71.6%,满意度积分由治疗前的1.4分别升至4.0分(P<0.01)、3.8分(P<0.01)。国外一项纳入18项研究、共1 441名患者的Meta分析[8]中,根据射频治疗后随访时间的不同进行分组研究,结果显示9项研究纳入的525名患者行射频治疗24.1内战月时,GERD-HRQL评分由治疗前的(3.55±3.9)分降至(1.19±3.4)分(P<0.05);5项研究纳入的366名患者行射频治疗21.9个月时,药物治疗的满意度由治疗前的(1.43±4.1)分升至(4.07±3.1)分(P<0.05);9项研究纳入的433名患者行射频治疗19.8个月时,GERD-HRQL评分由治疗前的(26.11±27.2)分降至(9.25±23.7)分(P<0.05);7项研究纳入的267名患者行射频治疗13.1个月时,DeMeester评分由治疗前的(44.37±93)分降至(28.53±33.4)分(P<0.05)。
近年来,微量射频治疗被广泛运用于GERD 治疗,其安全性及有效性均得到研究证实。不仅创伤性较外科手术治疗大大减小,微量射频治疗同样解决了GERD患者长期服药的痛苦,极大程度地减轻了患者的医疗负担。对于微量射频疗法的并发症,研究显示[9]其并发症不仅少且较轻,多数是短暂胸痛、吞咽困难及插管时表面黏膜损伤,多为自限性的。而对于远端食管狭窄及神经组织崩解等可能引起的并发症至今未有研究报道[10-12]。因此, 临床上对于药物治疗效果不佳的GERD患者而言,微量射频无疑是一种新的选择。
2.2 经口无切口折叠术(transoral incisionless fundoplication,TIF) TIF术实际上是传统外科胃底折叠术的内镜微创形式,模拟外科抗反流手术进行胃食管折叠,临床上根据其装置的不同可分为Esophy X胃底折叠术和MUSE胃底折叠术。
2.1.1 Esophy X胃底折叠术 Esophy X装置是一个带有内镜插入孔道的管型装置,由控制手柄、管状复位器、可反折的铸模器、螺旋形牵引针以及穿刺针和加固器组成。内镜直视下选择2个以上位置将胃底钉合到食道下端,在EGJ上方2~3 cm形成胃食管抗反流瓣,从而增加LES的压力,改善反流症状。见图2。Esophy X在2007年获FDA批准用于内镜下治疗GERD。
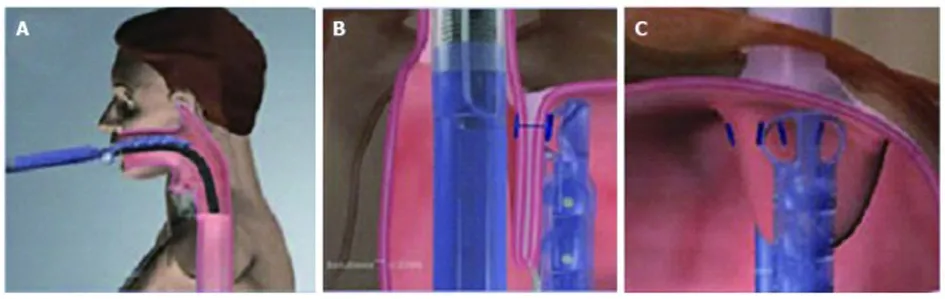
图2 Esophy X胃底折叠术示意图
Stefanidis等[13]对Esophy X装置完成的TIF的44名GERD患者进行了长达5年的随访,结果发现术后5年时,患者GERD-HRQL评分由术前的27分(2~45)降至术后的4分(0~26)(P<0.001) ,术后烧心及反流症状的缓解率分别达到57.1%、88.2%。甚至于,72.7%(32名)的患者术后可达到完全停用质子泵抑制剂(PPI)的效果。除此之外,诸多临床研究[14-16]都证明了Esophy X胃底折叠术对于GERD患者而言是一项安全、有效的微创手术,甚至可以与腹腔镜下胃底折叠术相媲美,是目前GERD内镜微创手术的热点之一。
2.2.2 MUSE胃底折叠术 MUSE装置由内镜摄像头、超声探头和缝合器组成,当内窥镜到达胃底时,通过反转镜身,将一部分胃底向上折叠,固定在食管末端。此时,摄像头被胃底遮住,定位工作转而交由超声探头完成。通过超声传感系统,对内窥镜顶端的钉槽与钉盒进行定位,确保钉盒中5枚4.8 mm的钛钉与钉槽处于同一水平线上时,发射钛钉,将胃底钉在食管末端,从而恢复His角和胃食管瓣阀,建立阻止胃食管反流的有效屏障(见图3)。它是2014年获FDA批准的GERD治疗新技术。
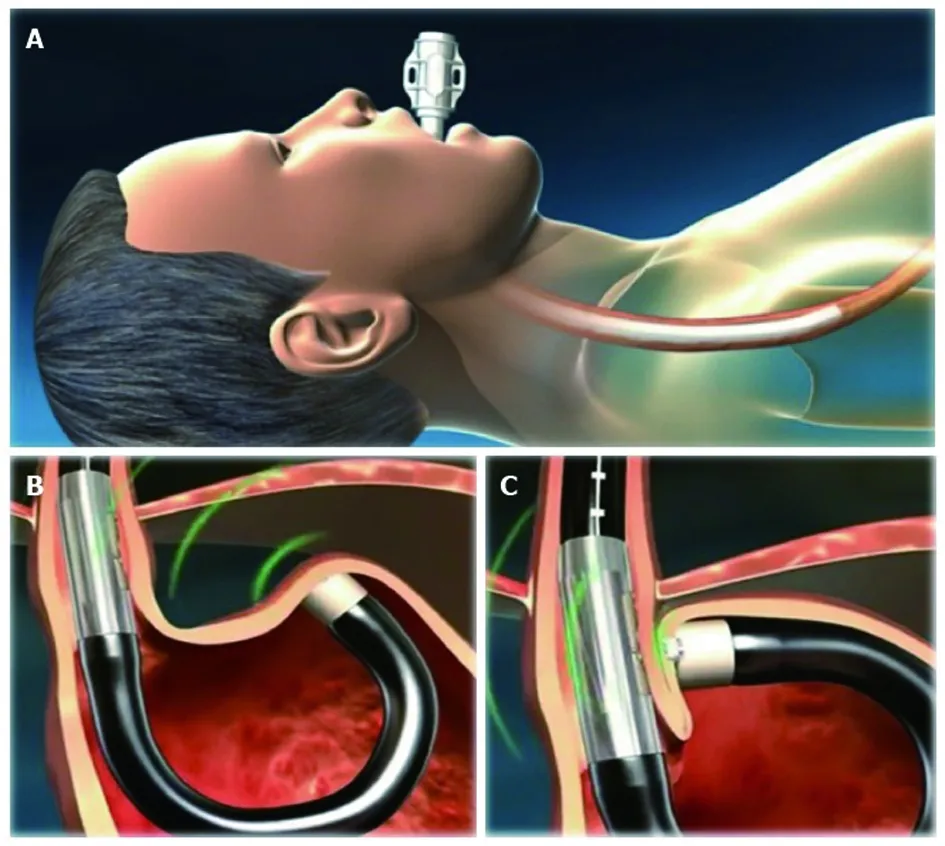
图3 MUSE胃底折叠术示意图
2017年3月,上海交通大学附属第一人民医院完成了国内首例MUSE装置下的TIF术治疗胃食管反流病。而此前,国外已有学者对该项技术进行了研究。Kim等[17]对37名MUSE装置下的TIF患者进行了长达4年的多中心、前瞻性研究。研究发现,TIF术后6个月、4年时,PPI停用率分别达到83.8%(31名)、67.6%(25名)。同时,HRQL评分也显著下降,并且,整个研究过程中并未出现任何严重的不良反应。Danalioglu等[18]将11名行MUSE装置下的TIF术与16名行腹腔镜抗反流术(LARS)的GERD患者进行了对比研究,结果发现:术后6个月时,LARS术后、TIF术后的患者GERD-HRQL评分分别由术前29.3分、24.8分降至术后4.1分、8.9分,分别下降了87%、64%(P>0.05)。从而得出结论,MUSE装置下的TIF术的短期疗效与LARS相当。
3 抗反流黏膜切除术(anti-reflux mucosecto my,ARMS)
2014年,日本学者报道了一篇使用传统的ESD技术行ARMS治疗10例GERD患者[19],其中2例行全周切除,另外8例则行新月形切除。结果发现,ARMS治疗后患者症状得到明显改善,烧心、反流平均积分分别由术前2.7分、2.5分降至术后0.3分、0.3分,差异均有统计学意义(P<0.05)。根据24h pH检测结果发现,pH<4的时间百分比由术前29.1%降至术后3.1%(P<0.05)。对于2例行全周切除的GERD患者而言,术后球囊扩张可以改善术后狭窄症状。研究纳入的所有患者术后均实现了停用PPI的效果。Inoue[20]对56例难治性GERD患者进行了ARMS,结果发现ARMS不适用于有较长食管裂孔疝的GERD患者。Ota等[21]同样证实了ARMS对GERD的治疗意义,该项研究对13例难治性GERD患者进行了传统ESD术,结果发现术后6个月时,92.3%(12例)患者GERD症状得到缓解。研究中的5例术后内镜下食管炎的表现得到明显改善,3例(23.1%)实现了完全停用PPI制剂,另外3例(23%)实现了PPI减量。虽然ARMS是一项很有前景的GERD内镜治疗技术,但目前仍需要大样本和长期的随访研究来进一步证实其疗效。
随着GERD患病率的不断增加,越来越多的患者受到反流的困扰,严重影响了生活质量。因此,安全、有效的内镜微创治疗受到了人们的广泛关注。随着新型内镜微创手术的不断创新与推广,目前临床上可选择的GERD内镜下微创治疗技术甚多,但由于部分治疗技术仍处于初步研究阶段,其对GERD的长短期疗效及安全性问题仍需要进一步证实,但是微创技术是医学发展的趋势,相信随着内镜设备、器械的进步,手术技术的创新和提高,微创手术治疗会越来越受到人们的关注,造福于广大的患者。
[1] 屈坤鹏,成院舟.我国部分地区胃食管反流病患病率的Meta分析[J].中华胃食管反流病电子杂志,2015,2(1):34-44.
[2] Chung H,Chon YE,Kim SU,et al. Noninvasive Prediction of Crosive Esophagitis Using a Controlled Attenuation Parameter(CAP)-Based Risk Estimation Model[J].Dig Dis Sci,2016,61(2):507-516.
[3] Kim KM,Cho YK,Bae SJ,et al. Prevalence of gastroesophagea1 reflux disease in Korea and associated health-care utilization: a national population-based study[J].J Gastroenterol Hepato1,2012,27(4):741-745.
[4] E1-Serag HB,Sweet S,Winchester CC,et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review[J].Gut,2014,63(6):871-880.
[5] Fockens P, Cohen L, Edmundowicz SA, et al.Prospective randomized contro11ed trial of an injectable esophagea1 prosthesis versus a sham procedure for endoscopic treatment of gastroesophagea1 reflux disease[J].Surg Endosc,2010,24(6):1387-1397.
[6] Ganz RA, Fa1lon E, Wittchow T, et al.A new injectable agent for the treatment of GERD: results of the Durasphere pilot trial[J].Gastrointest Endosc,2009,69(2):318-323.
[7] 刘海峰,屈亚威,陈晓光,等.微量射频技术治疗胃食管反流病5年随访研究[J].武警医学,2015,26(12):1193-1195,1198.
[8] Perry KA,Banerjee A,Melvin WS.Radiofrequency energy delivery to the lower esophagea1 sphincter reduces esophagea1 acid exposure and improves GERD symptoms: a systematic review and meta-analysis[J].Surg Laparosc Endosc Percutan Tech,2012,22(4):283-288.
[9] 曲宝戈,聂怀利.温控射频治疗胃食管反流病[J].中华物理医学与康复杂志,2005,27(4):251-252.
[10] Arts J, Bisschops R, Blondeau K, et al. A double-blind sham-controlled study of the effect of radiofrequency energy on symptoms and disten-sibility of the gastro-esophageal junction in GERD [J].Am J Gastroenterol,2012,107(2):222-230.
[11] DiBaise JK, Brand RE, Quigley EM. Endoluminal delivery of radiofrequency energy to the gastroesophageal junction in uncomplicated GERD: efficacy and potential mechanism of action [J].Am J Gastroenterol,2002,97(4):833-842.
[12] Noar M, Squires P, Noar E,et al. Long-term maintenance effect of radiofrequency energy delivery for refractory GERD: a decade later [J] .Surg Endosc,2014,28(8):2323-2333.
[13] Stefanidis G, Viazis N,Kotsikoros N, et al. Long-term benefit of transoral incisionless fundoplication using the esophyx device for the management of gastroesophageal reflux disease responsive to medical therapy [J].Dis Esophagus,2017,30(3):1-8.
[14] Testoni PA, Vailati C. Transoral incisionless fundoplication with EsophyX® for treatment of gastro-oesphageal reflux disease [J].Dig Liver Dis,2012,44(8):631-635.
[15] Petersen RP, Filippa L, Wassenaar EB, et al. Comprehensive evaluation of endoscopic fundoplication using the EsophyXTMdevice [J].Surg Endosc,2012,26(4):1021-1027.
[16] Repici A, Fumagalli U,Malesci A, et al. Endoluminal fundoplication (ELF) for GERD using EsophyX: a 12-month follow-up in a single-center experience [J].J Gastrointest Surg,2010,14(1):1-6.
[17] Kim HJ,Kwon CI,Kessler WR, et al. Long-term follow-up results of endoscopic treatment of gastroesophageal reflux disease with the MUSETMendoscopic stapling device [J].Surg Endosc,2016,30(8):3402-3408.
[18] Danalioglu A,Cipe G,Toydemir T,et al. Endoscopic stapling in comparison to laparoscopic fundoplication for the treatment of gastroesophageal reflux disease [J].Dig Endosc,2014,26(1):37-42.
[19] Inoue H, Ito H, Ikeda H, et al. Anti-reflux mucosectomy for gastroesophageal reflux disease in the absence of hiatus hernia: a pilot study [J].Ann Gastroenterol,2014,27(4):346-351.
[20] Inoue H. Minimally Invasive Treatment of Esophageal Benign Diseases[J].Kyobu Geka,2016,69(8):705-712.
[21] Ota K, Takeuchi T,Harada S,et al.A novel endoscopic submucosal dissection technique for proton pump inhibitor-refractory gastroesophageal reflux disease[J] .Scand J Gastroenterol,2014,49(12):1409-1413.

