淳安花猪5个功能基因的多态性研究
, ,,刘平,,,*
(1.杭州市农业科学研究院,浙江杭州 310024; 2.淳安县畜牧兽医局)
淳安县地处浙西,峰峦起伏,涧溪纵横,淳安花猪原产于浙江省淳安县境内的山区,在长期的民间选育过程中,逐渐形成了这一具有地方特色的优良猪种,其肉美味鲜,同时有性情温顺、产仔数多、耐粗饲等特性,是我国地方猪种“基因库”中的宝贵猪种资源。
据调查,近三十年来,淳安花猪在当地的饲养规模锐减,岌岌可危[1-4]。畜禽地方品种资源危机是当代全球性生物危机的重要组成部分。畜禽地方品种资源一旦遭到破坏,也就意味着历经亿万年进化和积累的许多优良基因的永远丢失。虽然我们还无法充分预测未来如何利用这些地方品种资源,但是拥有丰富的品种资源,人类就能够经受更大的挑战,获得更大的生存空间。畜禽地方品种资源是维持人类生存、维护生态安全和实现经济与社会可持续发展的战略性资源。因此,对淳安花猪遗传特性展开深入研究具有重要的现实意义。本试验通过研究ESR等5个功能基因在淳安花猪群体中的多态性,探讨其繁殖、生长、肉质等方面的遗传潜力,为进一步发掘其优良种质特性、开展保护利用提供科学依据。
1 材料与方法
1.1样品采集 淳安花猪耳组织样品23份(公5、母18)于浙江省淳安县主产区采集,将样品置于装有75%乙醇的离心管中,常温带回实验室,-20℃保存备用。
1.2基因组DNA提取 猪耳组织总DNA的提取参照《分子克隆实验指南》,应用常规的酚/氯仿法抽提。
1.3PCR引物设计与合成 参照GenBank所提供的基因序列设计引物,由上海生工生物工程技术服务有限公司合成。引物序列见表1。

表1 各基因引物信息
蛋白酶K、Tris饱和酚、琼脂糖购自华美生物工程公司;TaqDNA聚合酶、dNTP、限制性内切酶等购自上海生工生物工程技术服务有限公司(Sangon)。
1.4PCR反应体系与程序 PCR扩增反应体系组成:DNA模板100 ng,10×buffer 2.5 μL,25 mM镁离子2 μL,10 mM dNTP 0.5 μL,混合引物(上游引物和下游引物各为10 pmol/μL)0.5 μL,TaqDNA聚合酶1 U,加水至25 μL。
PCR反应程序:94℃预变性5 min;94℃变性45 s;54.6℃-64.8℃退火45 s;72℃延伸1 min;进行33-35个循环;最后72℃延伸10 min。
1.5PCR产物的酶切与判型 除FSHβ基因扩增产物直接电泳检测外,ESR、GH、MC4R、RYR1基因扩增产物分别用PvuⅡ、MSPI、TagI、Hha限制性内切酶进行酶切,酶切反应体系分别为:PCR产物(10 μL、8 μL、15 μL、10 μL、10 μL),内切酶(2 U、5 U、10 U、10 U、8 U),加10×Buffer(含BSA)、ddH2O至20 μL,37℃恒温水浴锅中消化2.5-5 h;用3.5%的琼脂糖凝胶电泳,采用DNA Ladder Markers作为分子量的标准对照,观察酶切结果,凝胶成像系统拍照,由带型判断基因型。
1.6数据统计与分析
1.6.1基因频率和基因型频率的计算
基因型频率=基因型个数/测定群体总数;
基因频率:
p是等位基因A的基因频率,q是等位基因B的基因频率,nAA、nAB和nBB分别是群体中基因型AA、AB和BB型的个体数。
1.6.2哈迪-温伯格平衡检验 哈迪-温伯格平衡检验公式如下:
Ei为理论值,Oi为实际观察值,n为等位基因数。
2 结果与分析
2.1ESR基因 PCR-RFLP电泳结果如图1所示。用PvuⅡ酶切后产生120 bp片段为AA型,65/55 bp片段为BB型,同时出现120/65/55 bp片段为AB型。
淳安花猪ESR基因型和基因频率结果见表2,淳安花猪只出现2个基因型。其中BB基因型频率为0.64,AB基因型为0.36。A、B等位基因频率分别为0.18和0.82。对该基因的遗传分布进行哈迪-温伯格平衡的x2适合性检验,可知ESR基因在淳安花猪群体中的分布符合哈迪-温伯格平衡(P>0.05)。
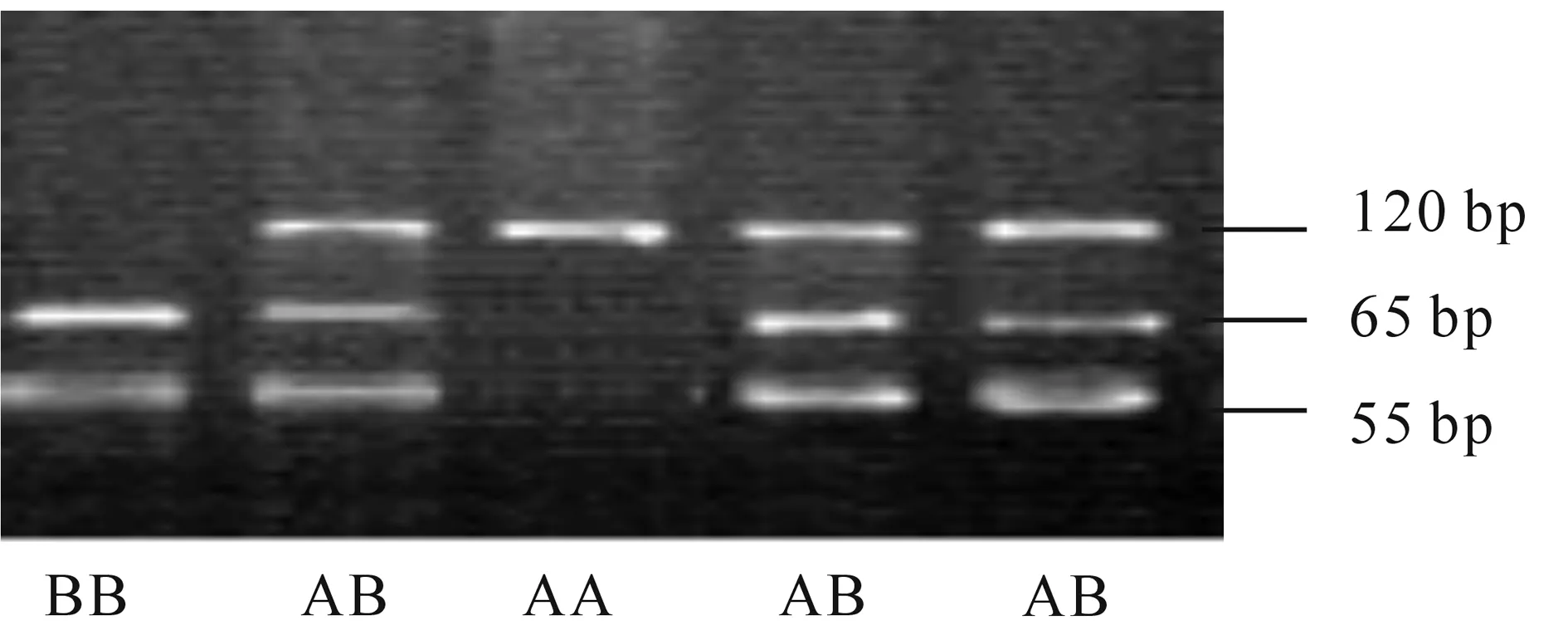
图1 ESR基因PCR-PvuⅡ-RFLP酶切结果
2.2FSHβ基因 由于存在基因插入,因此PCR就可以直接检测FSHβ基因的多态性,详见图2。只出现500 bp条带的为AA型,只出现200 bp条带的为BB型,同时出现500/200 bp条带的为AB型。
淳安花猪FSHβ基因分型检测结果见表2。淳安花猪FSHβ基因存在3个基因型,其中AB基因型频率最高为0.68,AA基因型次之为0.18,BB基因型最低为0.14。A、B等位基因频率分别为0.52和0.48。各基因型在淳安花猪群体中的分布符合哈迪-温伯格平衡(P>0.05)。

图2 FSHβ基因PCR酶切结果
2.3GH基因 PCR-RFLP电泳结果如图3所示。用MSPI酶切后产生284/222 bp片段为AA型,222/147/136 bp片段为BB型,同时出现284/222/147/136 bp片段为AB型。
淳安花猪GH基因型和基因频率结果见表2。淳安花猪只出现2个基因型,其中BB基因型频率为0.94,AB基因型为0.06。A、B等位基因频率分别为0.03和0.97。各基因型在淳安花猪群体中的分布符合哈迪-温伯格平衡(P>0.05)。

图3 GH基因PCR-MSPI-RFLP酶切结果
2.4MC4R基因 PCR-RFLP电泳结果如图4所示。用TagI酶切后产生156/70 bp片段为AA型,226 bp片段为BB型,同时出现226/156/70 bp片段为AB型。
淳安花猪MC4R基因型和基因频率结果见表2。淳安花猪MC4R基因只有一种基因型AA型。
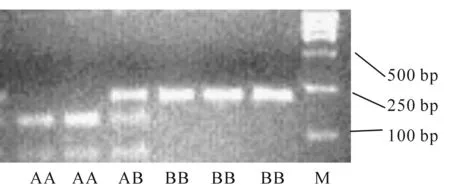
图4 MC4R基因PCR-TagI-RFLP酶切结果
2.5RYR1基因 PCR-RFLP电泳结果如图5所示。用Hha酶切后产生186 bp片段为AA型,126/60 bp片段为BB型,同时出现186/126/60 bp片段为AB型。
淳安花猪RYR1基因型和基因频率结果见表2。淳安花猪RYR1基因只有一种基因型BB型。

图5 RYR1基因PCR-Hha-RFLP酶切结果

基因样本数基因型AAABBB基因频率ABχ2值P值ESR220.000.36(8)0.64(14)0.180.822.660.10FSHβ220.18(4)0.68(15)0.14(3)0.520.482.950.09GH160.000.06(1)0.94(15)0.030.970.020.90MC4R231.00(23)0.000.001.000.00--RYR1190.000.001.00(19)0.001.00--
3 小结与讨论
3.1淳安花猪繁殖性能主效基因 猪的繁殖性状是一个重要的经济性状,繁殖性能的高低将直接影响到猪场生产效率和经济效益[5]。
一般认为,一个基因的效应(两种纯合基因型的基因型值之差)达到0.5~1.0表型标准差时,可将其看作主效基因。ESR基因对胚胎的生长发育具有重要作用,Short T等(1997)[6]研究发现,ESR基因的不同基因型与母猪头胎高窝产仔数相关。陈克飞等(2000)[7]研究认为,ESR基因的BB基因型母猪要比AA基因型母猪每胎多产活仔0.63~3.58头。FSHβ是垂体前叶分泌的糖蛋白,主要刺激卵泡生长发育,与促黄体素协同作用激发卵泡成熟并诱发排卵[8]。有报道显示,大多数地方猪种FSHβ大多是A等位基因占优[9-11]。
本试验结果表明,淳安花猪FSHβ也是A等位基因占优,与国内大多数报道的地方猪种研究结果一致。而淳安花猪ESR无AA基因型,BB基因型占优,提示淳安花猪具有较高的繁殖性能。
3.2淳安花猪生长性能相关基因MC4R为肽类物质,由下丘脑腹内侧核分泌,是黑皮质素受体家族的主要成员之一[12]。主要作用是通过与脑部分泌的天然内源配体α-促黑激素结合,从而达到抑制体重增加的效果[13]。这种机制深刻影响着动物的背膘厚、日增重和采食量等生长性状[14-15]。
陈敏等(2005)[16]研究发现,MC4R在地方猪种中以AA和AB基因型为主,AA基因型表现出更久的饲养期、更厚的背膘和更低的瘦肉率。GH是由垂体前叶中嗜酸性细胞合成和分泌的单链多肽激素,具有调节脂类、糖类和蛋白质代谢,促进生长等作用[17]。经荣斌等(2003)[18]认为,GH的等位基因A可能对瘦肉率呈正效应,对产仔数呈负效应。
本次试验,淳安花猪MC4R只有一种基因型AA,GH的B等位基因频率达0.97,提示淳安花猪瘦肉率较低,生长周期较长。
3.3淳安花猪肉质相关基因 猪应激综合征(PSS)是指猪在应激因子(如运输、转栏、高温、预防注射和配种等)的作用下诱发的一种综合征候[19]。这种猪往往以异常高的频率产生劣质的PSE肉,可给养猪生产带来很大的经济损失。RYR1基因又称氟烷基因,已证明为猪应激综合征发生的主效基因。有研究表明,RYR1与猪应激性及PSE肉密切相关[20-21]。
刘文举等(2008)[22]研究发现,外来猪种含应激敏感AA基因型,而地方猪种只有BB抗应激基因型。淳安花猪的研究分析结果与其基本一致,提示淳安花猪抗应激性较好。
[1] 章学东, 祝荣, 王初昌,等. 淳安花猪产区调研分析[J]. 杭州农业与科技,2009, (2): 17.
[2] 楼立峰, 章学东, 蔡和平,等. 淳安花猪亟待保护[J]. 杭州农业与科技,2006, (5): 25-25.
[3] 祝荣. 淳安花猪种质资源保护利用及特色文化建设[J]. 中国猪业,2012, 7(5): 23-24.
[4] 李庆海, 章学东, 范京辉,等. 淳安花猪的品质特性介绍[J]. 杭州农业与科技,2010, (5): 48.
[5] 曹果清. 猪 PRLR 基因和 FSHβ 亚基基因多态性研究 [D]: 山西农业大学,2004.
[6] Short T, Rothschild M, Southwood O. Effect of the estrogen receptor locus on reproduction and production traits in four commercial pig lines[J]. Journal of Animal Science,1997, 75(12): 3138-3142.
[7] 陈克飞, 李宁. 猪雌激素受体 (ESR) 基因对产仔数性状的影响[J]. 遗传学报,2000, 27(10): 853-857.
[8] Cooke D, Crowe M, Roche J. Gonadotrophin heterogeneity and its role in farm animal reproduction[J]. Animal Reproduction Science,1996, 41(2): 77-99.
[9] 谢飞, 吴晗, 滕尚辉,等. 应用 4 个繁殖性状候选基因对太湖猪群体遗传结构分析[J]. 畜牧与兽医,2008, 40(6): 23-26.
[10] 鲁绍雄, 胡晓湘, 连林生,等. 撤坝猪 ESR 和 FSH-β 基因多态性及其与产仔数的关联分析[J]. 云南农业大学学报: 自然科学版,2009, 24(3): 389-393.
[11] 冯富彦, 李新建, 吕刚,等. 豫南黑猪 FSHβ 亚基基因多态性研究[J]. 中国畜牧兽医,2010, (3): 145-148.
[12] Yeo G, Farooqi I, Challis B. The role of melanocortin signalling in the control of body weight: evidence from human and murine genetic models[J]. Qjm,2000, 93(1): 7-14.
[13] Sinha PS, Schiöth HB, Tatro JB. Roles of the melanocortin-4 receptor in antipyretic and hyperthermic actions of centrally administered α-MSH[J]. Brain research,2004, 1001(1): 150-158.
[14] Zhang C-L, Wang Y-H, Chen H. Association between variants in the 5′-untranslated region of the bovine MC4R gene and two growth traits in Nanyang cattle[J]. Molecular biology reports,2009, 36(7): 1839-1843.
[15] Jokubka R, Maak S, Kerziene S. Association of a melanocortin 4 receptor (MC4R) polymorphism with performance traits in Lithuanian White pigs[J]. Journal of Animal breeding and Genetics,2006, 123(1): 17-22.
[16] 陈敏, 王爱国, 李宁,等. 中国地方猪种 MC4R 基因频率的研究 (英文)[C]. 全国畜禽遗传资源保护与利用学术研讨会论文集,2005.
[17] Etherton TD, Bauman DE. Biology of somatotropin in growth and lactation of domestic animals[J]. Physiological reviews,1998, 78(3): 745-762.
[18] 经荣斌, 宋成义, 陶勇,等. 猪GH基因部分突变位点在不同品种中的分布[J]. 扬州大学学报: 农业与生命科学版,2003, 24(1): 30-33.
[19] 刘丑生. 甘肃黑猪合成系 RYR1 基因的 PCR-RFLP 检测试验[J]. 甘肃畜牧兽医,2002, 32(2): 24-25.
[20] Fujii J, Otsu K, Zorzato F. Identification of a mutation in porcine ryanodine receptor associated with malignant hyperthermia[J]. Science,1991, 253(5018): 448-451.
[21] 朱砺, 李学伟, 帅素蓉. 兰尼定受体基因在新荣昌猪中的分布及其对胴体和肉质性状的效应分析[J]. 中国畜牧杂志,2005, 41(4): 14-16.
[22] 刘文举, 何年华, 左本武,等. 监利猪和大监猪五个基因的多态性研究[J]. 养猪,2008, (3): 25-29.

