高考有机化学实验题解析
■广西南宁市邕宁高级中学
化学实验题是高考的重要题型,考生很容易失分,尤其是有机物制备性实验试题,陌生度高,信息量大,成为考生夺取高分的绊脚石。下面就剖析一下关于有机物制备性实验题的思路、考查点和解决方法。
一、制备的有机物为气体
如果制备的有机物为气体,则和一般气体的制备思路相同。如教材中乙烯、乙炔气体的制取。
1.一般思路:反应原理→气体发生装置→除杂装置→干燥装置→收集装置→尾气处理装置。
2.主要考查点:(1)装置的选择和装置接口的连接;(2)有关温度控制问题的考查,如乙烯制备时的温度为170℃,在140℃时会制得乙醚;(3)制得的气体中有哪些杂质气体,如何除去,对制备气体的检验或性质验证有哪些干扰,如制备的乙烯气体中含有SO2,乙炔中含有H2S、PH3;(4)气体性质的验证和试剂的选择;(5)产率的计算等。
二、制备的有机物为液体
这一类实验题要求我们清晰实验原理、实验过程、实验步骤,有些还要求我们了解实验过程中的几个阶段和作用。
1.实验仪器的识别和使用。如冷凝管、三种漏斗(过滤漏斗、长颈漏斗、分液漏斗)、两种常用烧瓶(圆底烧瓶、蒸馏烧瓶)等。
2.温度的控制。有机反应副反应一般较多,大多数需要控制一定的温度,具体有直接加热法、水浴加热法和油浴加热法(一般用高沸点的液态有机物)。
3.了解反应物、生成物的沸点和水溶性。如乙酸异戊酯的制备,第一次用冷凝管来冷凝回流反应物,使其充分反应,以提高反应物的转化率。第二次用冷凝管来冷凝得到乙酸异戊酯。
4.物质的分离与提纯。一般有:(1)利用水溶性除去易溶于水的杂质;(2)杂质若为羧酸,用NaHCO3饱和溶液除去;(3)杂质若为低级醇,采用CaCl2、MgCl2等可与低级醇反应生成结晶醇(配位化合物),难溶于有机物而除去;(4)生成物和杂质的沸点相差30℃以上,可采用蒸馏得到产物或除去杂质;(5)液态有机物的干燥,一般加入Na2SO4、Mg(NO3)2等作为吸水剂,采用蒸馏得到有机物。
三、例题剖析
题目:醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
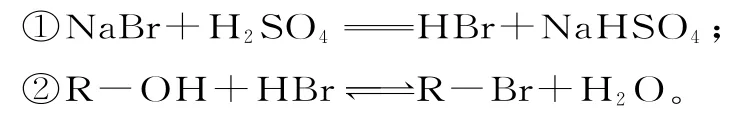
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据如表1所示。
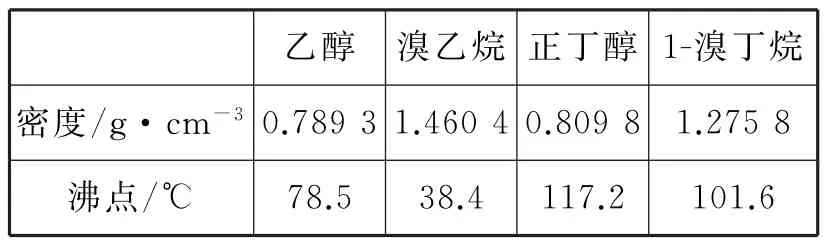
表1
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是____(填字母)。
a.圆底烧瓶 b.量筒
c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性____(填“大于”“等于”或“小于”)相应的醇;其原因是____。
(3)1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在____(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是____。(填字母)
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少H Br的挥发
d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____。(填字母)
a.NaI b.NaOH
c.NaHSO3d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是____。
解析:本题以新信息的形式考查1-溴丁烷的制备与提纯、实验问题分析等内容,只要将实验室溴乙烷制备与提纯以及相关实验问题分析迁移应用,就可顺利解答。
(1)在溴乙烷和1-溴丁烷的制备实验中,最不可能用到的实验仪器为布氏漏斗,因为其是用于过滤的仪器,既不能用作反应容器,也不能用于量取液体。
(2)溴代烃的水溶性小于相应的醇,因为醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键。
(3)根据题干表格数据:1-溴丁烷的密度大于水的密度,因此将1-溴丁烷的粗产品置于分液漏斗中加水,振荡后静置,产物1-溴丁烷应在下层。
(4)由于浓硫酸在稀释过程中放出大量的热且具有强氧化性,因此在制备操作过程中,加入的浓硫酸必须进行稀释,其目的是防止放热导致副产物烯或醚的生成并减小HBr的挥发,同时减少Br2的生成。
(5)除去溴代烷中的少量杂质Br2,应选用NaHSO3,二者可发生氧化还原反应而除去Br2,且不引入新的杂质。NaI能与Br2反应生成I2而引入新的杂质;NaOH不但能与Br2反应,同时也能与溴代烷反应;KCl与Br2不反应。
(6)根据平衡移动原理,蒸发产物,平衡向有利于溴乙烷的方向移动;在制备1-溴丁烷时不能采用此方法,原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸发,会有较多的正丁醇被蒸发。
答案:(1)d(2)小于醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键(3)下层(4)abc(5)c(6)平衡向生成溴乙烷的方向移动1-溴丁烷与正丁醇的沸点差较小

