钇-90微球放射栓塞治疗肝脏恶性肿瘤的不良反应和并发症
——钇-90微球放射栓塞系列回顾(五)
郑丽丽, 贾中芝, 王斯妮, 王维平
在钇-90(90Y)微球放射栓塞治疗肝脏恶性肿瘤的过程中,由于β射线对组织的破坏作用和微球对血流不同程度的阻塞作用,患者在接受90Y微球治疗后会出现不同程度的不良反应;同时,由于手术操作过程中的误判和意外,偶有并发症的发生。90Y微球治疗造成的不良反应和并发症均会给患者带来不同程度的不良体验,甚至机体上的损害。因此,为了更好地推广和开展90Y微球放射栓塞技术,临床医师应充分了解90Y治疗所伴随的不良反应,以及可能并发的严重后果。本文将重点介绍不良反应和并发症的常见临床表现和治疗原则。
1 不良反应
不良反应是指90Y微球治疗后出现的非特异性临床症状或实验室检查指标异常。其中,常见的临床症状包括乏力、厌食、恶心、呕吐、腹痛、以及发热[1-6](表1)。由于90Y微球治疗主要是近距离放射治疗对组织的破坏,而阻断血流的作用轻微[7],且90Y微球载体不具有毒性,因此上述症状大都轻微且能在数日内自愈[8],但少数患者的症状可持续长达4周[7]。实验室检查异常包括血清胆红素和转氨酶升高及外周血淋巴细胞和血小板计数降低。90Y微球治疗后约1/3患者出现实验室指标异常,但可无任何临床表现。临床上将90Y微球治疗后出现的常见而又非特异的一系列临床症状和实验室指标异常称为放射栓塞后综合征(post-radioembolization syndrome)。不良反应按照 Common Terminology Criteria for Adverse Events,Version 4.0, 即第 4 版CTCAE 评分标准分为 5 个等级(表 2、表 3)[9]。
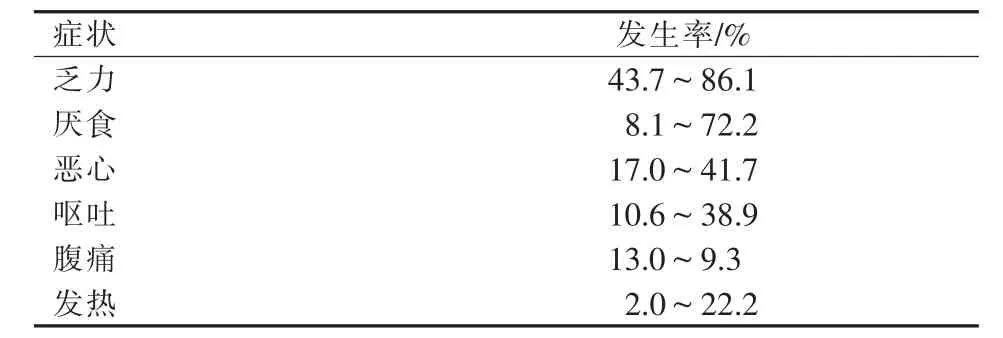
表1 与90Y微球治疗相关的不良反应及发生率

表2 不良反应的临床症状分级

表3 相关实验室检查指标异常的分级
2 并发症
并发症是指90Y微球治疗时发生非靶血管栓塞所引起的组织或器官的放射性损伤,通常为肝外组织或器官,如食管下段、胃肠道、肺,也可以为正常肝脏组织。表4总结了近10年90Y微球治疗肝恶性肿瘤大宗病例报道的并发症及其发生率。关于并发症的发生机制和具体预防措施已经在本系列综述的第3部分进行了详细的描述。我们将按照并发症的发生时间,按急性和慢性放射性损伤进行描述。
2.1 急性放射性损伤
急性放射性损伤通常发生在90Y微球治疗后4周内[10],损伤程度与进入非靶组织/器官微球所携带的放射性强度和被栓塞的非靶组织/器官对β射线的敏感程度有关。
2.1.1 放射性上消化道损伤 主要包括放射性食管炎、胃/十二指肠炎、溃疡及穿孔等,总体发生率低于4.8%[11]。由于90Y微球容易经胃右动脉、胃十二指肠动脉异位栓塞至幽门和十二指肠降部,放射性损伤大多发生在胃窦、幽门和十二指肠降部,而极少发生于食管下端和胃食管交界部位[12]。虽然放射性上消化道损伤的临床表现与不良反应较难区别,如恶心、呕吐、腹泻、上腹部疼痛等[13],但前者引起的症状更为严重,多表现为持续的顽固性上腹痛,个别患者在术中即可出现。若溃疡发生于食管下端贲门部,可有吞咽痛伴吞咽困难[12]。内镜检查可见黏膜充血、糜烂,并伴有渗出物,溃疡病灶直径于0.5~2.0 cm,也可呈弥漫性[14]。 活检发现微球颗粒可以确诊溃疡为90Y微球异位栓塞所致[13]。
2.1.2 放射性胆囊炎 大量90Y微球进入胆囊动脉可造成放射性胆囊炎,临床表现为右上腹疼痛、恶心、呕吐、发热[10],轻者仅在影像学检查上观察到胆囊壁增厚或囊周积液,严重者可出现胆囊穿孔或坏死[15]。放射性胆囊炎的临床表现与普通胆囊炎无明显区别,但近期有无接受90Y微球治疗和术中是否在胆囊动脉邻近的血管进行栓塞为重要线索。
2.1.3 放射性胆管损伤 胆管对动脉缺血非常敏感。肝动脉灌注90Y微球可能会引起动脉损伤进而造成胆管损伤。临床上,放射性胆管损伤可表现为胆管炎、胆管坏死和胆脂瘤。其中,放射性胆管炎因肝内胆管水肿引起胆道梗阻,继而发生黄疸,另外还有发热、右上腹疼痛等表现。90Y微球治疗前,患者接受过胆道手术或操作,如经皮胆管造影术、胆汁引流等,肝活检或肝移植等均易增加胆管损伤的风险[15]。
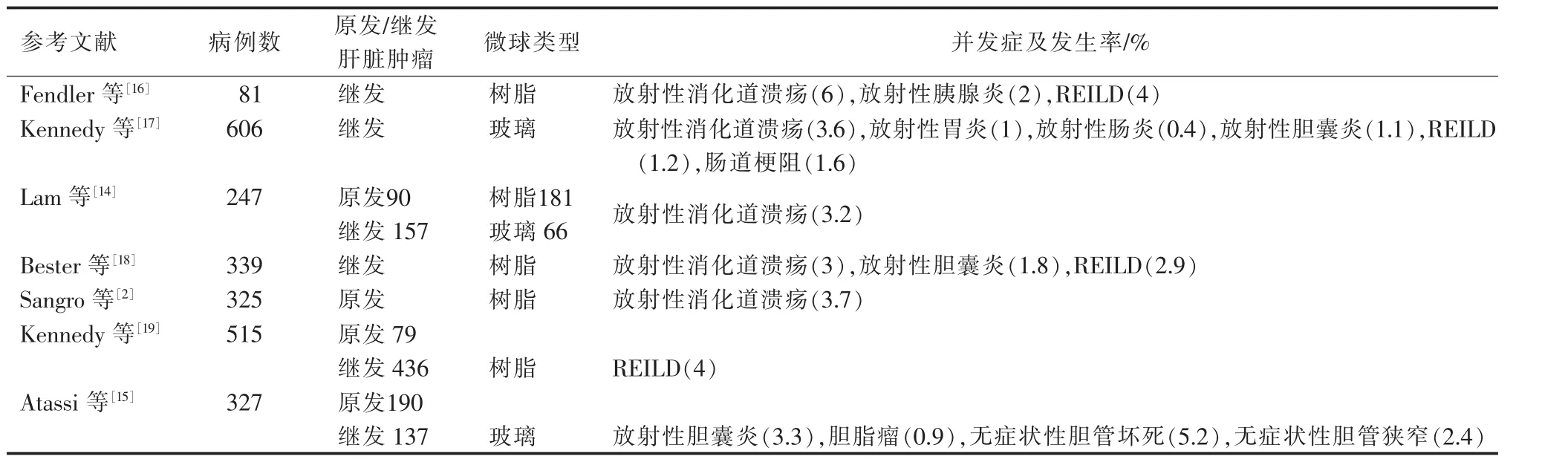
表4 90Y微球治疗肝恶性肿瘤导致的主要并发症总结
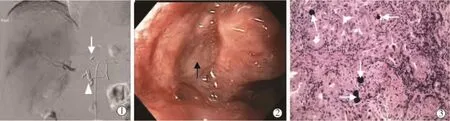
图1 1例原发性肝癌患者接受选择性肝右动脉90Y微球栓塞治疗
2.1.4 放射性肺炎 肝动-静脉分流可以使90Y微球绕过肝毛细血管床直接进入肺动脉系统,并最终栓塞在肺血管床,从而造成放射性肺炎。严重肝动-静脉分流可以用99mTc大颗粒白蛋白(99mTc-MAA)灌注肝动脉的方法进行胸腹扫描检测,由于此方法排除了高风险的患者,90Y微球所引起的放射性肺炎发生率已不到1%[20]。99mTc-MAA扫描的方法详见系列综述(二)。
当90Y微球异位栓塞在肺动脉时,可出现刺激性干咳,偶有呼吸困难,伴或不伴发热等,时间从术后立即到1个月左右[21]。发生放射性肺炎时,肺功能检查异常往往早于胸部X线表现。早期肺功能异常表现为轻微的限制性通气障碍。随着疾病进展,可出现少量胸腔积液和肺实变;CT检查可见双侧肺门对称性磨玻璃结节或模糊密度影,表现为“蝶翼征”(bat-wing sign)[21];组织学检查可有出血、间质水肿、纤维蛋白渗出等改变;支气管肺泡灌洗液中可见嗜酸性粒细胞和淋巴细胞增多[22]。
放射性肺炎可以根据临床症状和影像学表现分为 0~5级(表 5)[23]。目前文献报道的绝大多数90Y微球治疗导致的放射性肺炎为1级,个别为2或3级,极少数达到 5 级[20-22]。
2.1.5 放射性胰腺炎 放射性胰腺炎是极少见的并发症,文献报道仅 3 例[6,24-25]。 因胰腺血供复杂且管径细小,多数情况下术者无法确定造成90Y微球异位栓塞胰腺组织的原因。据文献报道,在肝固有动脉灌注90Y微球时,90Y微球可反流进入胰十二指肠上动脉,引起水肿型胰腺炎[24]。放射性胰腺炎一般在术后2周内发生,表现为上腹或脐周剧烈疼痛,实验室检查可有血清脂肪酶和淀粉酶水平升高[24]。如果在术后2 d内出现上腹痛,可使用韧致辐射单光子发射计算机断层显像(single-photon emission computed tomography,SPECT)确定胰腺组织是否有异位的90Y 微球[24]。
2.1.6 放射性皮炎 放射性皮炎是由于90Y微球通过镰状动脉异常沉积于前腹壁而引起的一种放射性皮肤损伤。据Baba等[26]报道,行腹腔或肝动脉造影的1 250例患者中仅2%存在镰状动脉,所以放射性皮炎在临床极少见。典型的临床症状为剑突下至脐部可见紫癜样皮疹[27],也可仅表现为脐周痛[28]。术后2 d内进行韧致辐射扫描可见腹壁及皮下脂肪区存在放射性活度。

表5 放射性肺炎程度分级
2.2 慢性放射性损伤
慢性放射性损伤是指90Y微球治疗4周后发生的并发症[10]。任何有临床表现的急性放射性损伤都有可能发展为慢性放射性损伤,但临床上大多数患者缺乏明确的急性放射性损伤的表现,并以缓慢而持续发展的症状和体征为特征。
2.2.1 放射性肝病 肝脏是对放射性照射较为敏感的器官之一。90Y治疗引起的放射性损伤主要是由于90Y微球意外进入非肿瘤供血的肝动脉分支进而对正常肝细胞产生电离辐射,这种由90Y栓塞治疗引起的肝功能损伤也称为放射栓塞性肝病(radioembolization induced liver disease,REILD)。 尽管发病率低(<4%)[19,29-30],REILD 仍是一种潜在严重的放射性损伤。与外照射所引起的放射性肝病相比较,90Y微球治疗引起的放射性肝病以胆红素水平升高为特征[31]。发生REILD时,患者在术后的1~3个月主要表现为乏力、恶心、腹胀和黄疸;术后4~6个月则以门脉高压为主要表现,如腹水、脾肿大、食管胃底静脉曲张等。实验室检查表现为血清胆红素、碱性磷酸酶、丙氨酸转氨酶和天冬氨酸转氨酶水平升高及白蛋白水平降低[29-30];组织学检查可发现肝脏组织纤维化和部分脂肪变性。有学者建议,若患者在90Y微球治疗后1~2个月时出现血清总胆红素≥50μmol/L并伴有腹水,同时,在临床排除肿瘤进展或胆道梗阻的情况下即可诊断REILD[32]。
术前肝功能不良会明显增加90Y微球治疗后出现的不良反应,因肝功能储备下降,尤其是胆红素水平>34μmol/L时对放射性损伤的敏感性增强。随着肝功能损伤级别的增加,患者接受90Y微球治疗后发生严重肝功能损伤的风险也随之增加,故Child-Pugh C级的患者(总分≥10分)不宜做90Y微球治疗。在继发性肝癌患者中,因未被肿瘤侵犯的肝组织依然可以保持各项肝功能指标正常,故肝功能检查并不能完全反映患者对放射性的敏感程度,而肿瘤负荷则成为较为客观的指标。通常,如肿瘤体积大于正常肝脏50%患者则需要谨慎使用90Y微球治疗[31]。 除此之外,术前 2 个月内接受过化疗[32],年龄<55岁以及体质量指数(BMI)<26.0等均是发生 REILD 的危险因素[30]。
Okuda分期用于评估不同分期患者的预后,但目前有学者用于评估患者对近距离放疗的耐受剂量[29]。文献结果显示,OkudaⅠ期的患者可耐受高达390 Gy的治疗剂量,而OkudaⅡ期的患者治疗剂量在超过196 Gy时,放射性肝病的发生风险将明显增加。有文献报道,2种微球都可以引起REILD,其本质上无区别,但玻璃微球在治疗中晚期肝癌患者后出现放射性肝病的发生率较高,占36.5%[33],可能是因为树脂微球主要用于继发性肝癌的患者,相对于原发性肝癌的患者,继发性肝癌患者的肝功能大多正常。
2.2.2 放射性肺纤维化 早期的急性放射性肺炎可进一步发展为肺纤维化、牵拉性支气管扩张,甚至出现自发性气胸及肺部感染[22]。临床表现从刺激性干咳发展到呼吸费力伴胸部紧束感,甚至呼吸衰竭;胸部CT可观察到胸腔积液、肺不张,“蝶翼征”较急性放射性肺炎更明显[22]。
2.2.3 幽门/十二指肠狭窄、梗阻 个别患者会出现慢性肠道梗阻的症状,往往以上腹部疼痛为首发症状,随后可以伴随恶心、呕吐和厌食。临床症状大多轻微[34],但可持续数月之久,并可能进一步发展为完全梗阻。内镜检查可见病灶处有明显瘢痕,胃窦部内壁增厚伴幽门/十二指肠狭窄或者梗阻[2,14,34-35]。长期未愈的患者可表现为水、电解质紊乱及酸碱平衡失调[36]。
2.2.4 放射性血细胞减少 放射性血细胞减少包括淋巴细胞减少、血小板减少和红细胞减少。由于淋巴组织对射线敏感,90Y微球放射栓塞治疗后,大部分患者的淋巴细胞计数可减少25%以上[37],且该现象可持续1年之久,但并未增加这些患者机会性感染的几率[3,37]。个别患者若术后出现不能解释的血红蛋白降低(≤90 g/L)[38],则需要除外放射性胃十二指肠溃疡引起的失血性贫血,内镜检查及活体组织病理检查可以帮助进行确认。
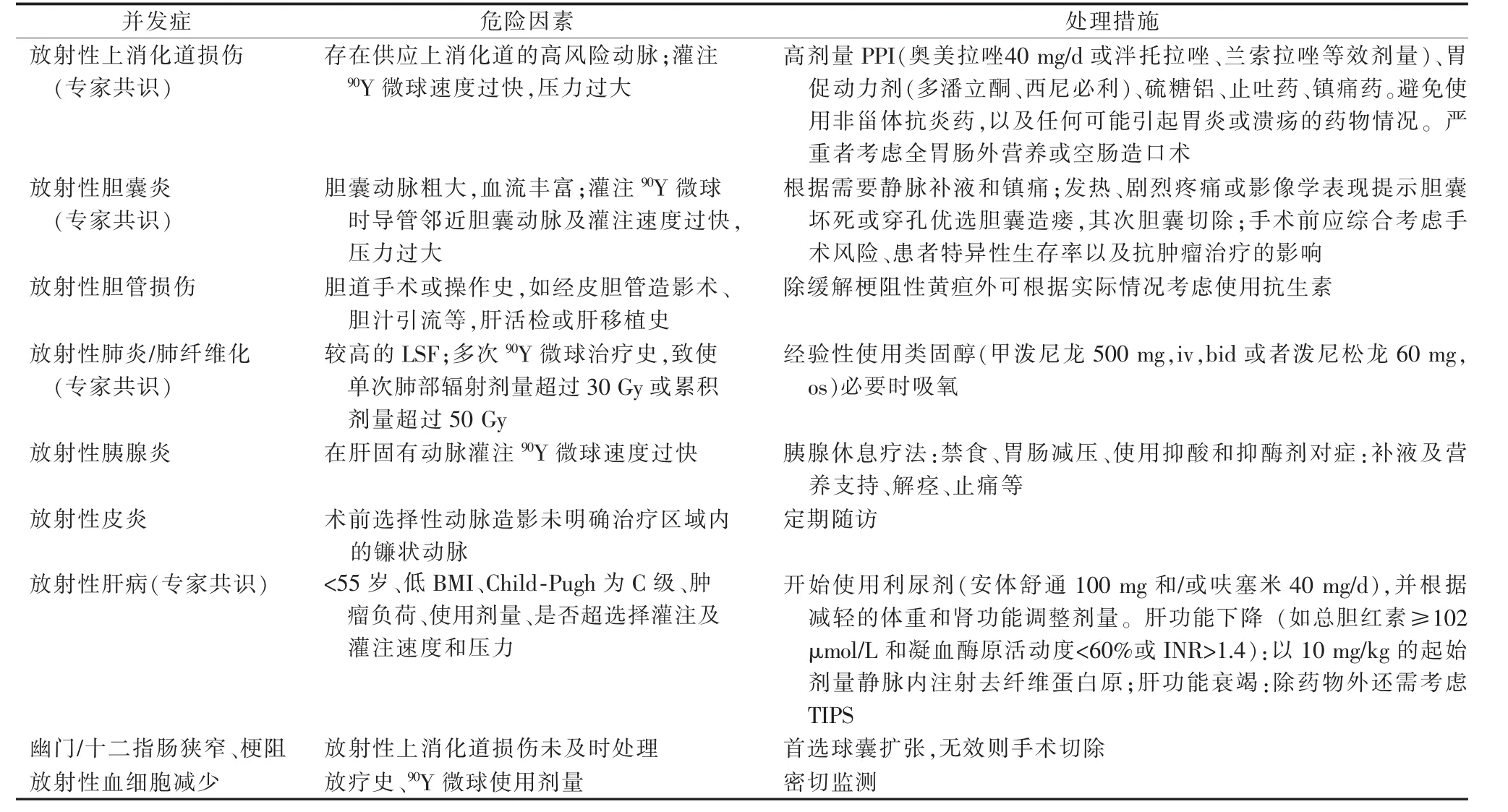
表6 90Y微球并发症处理措施
3 不良反应及并发症的处理原则
不良反应的特点是非特异性,因而治疗措施主要为对症处理[1,3-4,10]。 对于并发症的处理,Sangro等[39]总结了专家共识中对于急慢性放射性损伤发生的危险因素和处理措施(表6)。
4 结论
90Y微球放射栓塞治疗可导致相应的不良反应和并发症,正确鉴别不良反应与并发症非常重要,前者仅需对症处理,后者需要早期发现并积极治疗。出现并发症时,急性损伤以放射性上消化道损伤多见,慢性损伤以放射性肝病多见,临床医师应熟悉90Y微球治疗相关不良反应和并发症的临床表现,可帮助及时发现并进行相应的治疗,为开展90Y微球治疗肝脏恶性肿瘤提供安全保障。
在本文修改过程中得到了天津市第一中心医院谢双双医师和浙江大学医学院附属邵逸夫医院赵添医师的宝贵意见,谨此表示衷心感谢!
[1] Kennedy AS, Coldwell D, Nutting C, et al.Resin90Y-microsphere brachytherapy for unresectable colorectal liver metastases: modern USA experience[J].Int JRadiat Oncol Biol Phys, 2006, 65: 412-425.
[2] Sangro B,Carpanese L,Cianni R,et al.Survival after yttrium-90 resin microsphere radioembolization of hepatocellular carcinoma across Barcelona clinic liver cancer stages:a European evaluation[J].Hepatology, 2011, 54: 868-878.
[3] Salem R, Lewandowski RJ, Atassi B, et al.Treatment of unresectablehepatocellular carcinomawith useof90Ymicrospheres(TheraSphere): safety, tumor response, and survival[J].JVasc Interv Radiol, 2005, 16: 1627-1639.
[4] Murthy R, Xiong H, Nunez R, et al.Yttrium 90 resin microspheres for the treatment of unresectable colorectal hepatic metastases after failure of multiple chemotherapy regimens:preliminary results[J].JVasc Interv Radiol, 2005, 16: 937-945.
[5] Jia Z,Paz-Fumagalli R,Frey G,et al.Resin-based yttrium-90 microspheres for unresectable and failed first-line chemotherapy intrahepatic cholangiocarcinoma: preliminary results[J].JCancer Res Clin Oncol, 2017, 143: 481-489.
[6] Jia Z, Paz-Fumagalli R, Frey G, et al.Single-institution experience of radioembolization with yttrium-90 microspheres for unresectable metastatic neuroendocrine liver tumors[J].J Gastroenterol Hepatol, 2017, 32: 1617-1623.
[7] Strigari L,Sciuto R,Rea S,et al.Efficacy and toxicity related to treatment of hepatocellular carcinoma with90Y-SIR spheres:radiobiologic considerations[J].JNucl Med, 2010, 51: 1377-1385.
[8] Kuo JC, Tazbirkova A, Allen R, et al.Serious hepatic complications of selective internal radiation therapy with yttrium-90 microsphere radioembolization for unresectable liver tumors[J].Asia Pac JClin Oncol, 2014, 10: 266-272.
[9] NCI.Common Terminology Criteria for Adverse Events (CTCAE)version 4.0.(2009)[EB/OL].Available from: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
[10] Slauson DO, Hahn FF, Benjamin SA, et al.Inflammatory sequences in acute pulmonary radiation injury[J].Am JPathol,1976,82:549-572.
[11] Szyszko T, Al-Nahhas A, Tait P, et al.Management and prevention of adverse effects related to treatment of liver tumours with90Y microspheres[J].Nucl Med Commun, 2007, 28: 21-24.
[12] Konda A,Savin MA,Cappell MS,et al.Radiation microsphereinduced GI ulcers after selective internal radiation therapy for hepatic tumors: an underrecognized clinicalentity[J].Gastrointest Endosc,2009,70:561-567.
[13] Mallach S,Ramp U,Erhardt A,et al.An uncommon cause of gastro-duodenal ulceration[J].World J Gastroenterol, 2008,14:2593-2595.
[14] Lam MG, Banerjee S, Louie JD, et al.Root cause analysis of gastroduodenal ulceration after yttrium-90 radioembolization[J].Cardiovasc Intervent Radiol, 2013, 36: 1536-1547.
[15] Atassi B,Bangash AK,Lewandowski RJ,et al.Biliary sequelae following radioembolization with yttrium-90 microspheres[J].J Vasc Interv Radiol, 2008, 19: 691-697.
[16] FendlerWP,Lechner H,Todica A,et al.Safety,efficacy,and prognostic factors after radioembolization of hepatic metastases from breast cancer:a large single-center experience in 81 patients[J].JNucl Med, 2016, 57: 517-523.
[17] Kennedy AS,Ball D,Cohen SJ,et al.Multicenter evaluation of the safety and efficacy of radioembolization in patients with unresectable colorectal livermetastases selected as candidates for90Y resin microspheres[J].JGastrointest Oncol, 2015, 6: 134-142.
[18] Bester L,Meteling B,Pocock N,et al.Radioembolization versus standard care of hepatic metastases:comparative retrospective cohort study of survival outcomes and adverse events in salvage patients[J].JVasc Interv Radiol, 2012, 23: 96-105.
[19] Kennedy AS, McNeillie P, Dezarn WA, et al.Treatment parameters and outcome in 680 treatments of internal radiation with resin90Y-microspheres for unresectable hepatic tumors[J].Int JRadiat Oncol Biol Phys, 2009, 74: 1494-1500.
[20] Salem R, Parikh P, Atassi B, et al.Incidence of radiation pneumonitis after hepatic intra-arterial radiotherapy with yttrium-90 microspheres assuming uniform lung distribution [J].Am J Clin Oncol, 2008, 31: 431-438.
[21]Leung TW,Lau WY,Ho SK,et al.Radiation pneumonitis after selective internal radiation treatmentwith intraarterial 90 yttriummicrospheres for inoperable hepatic tumors[J].Int JRadiat Oncol Biol Phys, 1995, 33: 919-924.
[22]Wright CL,Werner JD,Tran JM,et al.Radiation pneumonitis following yttrium-90 radioembolization:case report and literature review[J].JVasc Interv Radiol, 2012, 23: 669-674.
[23] Roach M 3rd,Gandara DR,Yuo HS,etal.Radiation pneumonitis following combined modality therapy for lung cancer:analysis of prognostic factors[J].JClin Oncol, 1995, 13: 2606-2612.
[24] Hoffmann RT, Jakobs TF, Kubisch CH, et al.Radiofrequency ablation after selective internal radiation therapy with yttrium90 microspheres inmetastatic liver disease: is it feasible?[J].Eur J Radiol, 2010, 74: 199-205.
[25] Peterson JL,Vallow LA,Johnson DW,et al.Complications after90Ymicrosphere radioembolization forunresectablehepatic tumors:an evaluation of112 patients[J].Brachytherapy, 2013, 12: 573-579.
[26] Baba Y, Miyazono N, Ueno K, et al.Hepatic falciform artery:angiographic findings in 25 patients[J].Acta Radiol, 2000, 41:329-333.
[27]Leong QM,Lai HK,Lo RG,et al.Radiation dermatitis following radioembolization for hepatocellular carcinoma: a case for prophylactic embolization of a patent falciform artery[J].JVasc Interv Radiol, 2009, 20: 833-836.
[28]Bhalani SM,Lewandowski RJ.Radioembolization complicated by nontarget embolization to the falciform artery[J].Semin Intervent Radiol, 2011, 28: 234-239.
[29] Young JY,Rhee TK,Atassi B,et al.Radiation dose limits and liver toxicities resulting frommultiple yttrium-90 radioembolization treatments for hepatocellular carcinoma[J].JVasc Interv Radiol,2007,18:1375-1382.
[30] Sangro B, Gil-Alzugaray B, Rodriguez J, et al.Liver disease induced by radioembolization of liver tumors:description and possible risk factors[J].Cancer, 2008, 112: 1538-1546.
[31] Riaz A,Awais R,Salem R.Side effects of yttrium-90 radioembolization[J].Front Oncol, 2014, 4: 198.
[32]Gil-Alzugaray B,Chopitea A,InarrairaeguiM,et al.Prognostic factors and prevention of radioembolization-induced liver disease[J].Hepatology, 2013, 57: 1078-1087.
[33] Mazzaferro V,Sposito C,Bhoori S,et al.Yttrium-90 radioembolization for intermediate-advanced hepatocellular carcinoma:a phase 2 study[J].Hepatology, 2013, 57: 1826-1837.
[34]Moreno-Luna LE,Yang JD,Sanchez W,et al.Efficacy and safety of transarterial radioembolization versus chemoembolization in patientswith hepatocellular carcinoma[J].Cardiovasc Intervent Radiol, 2013, 36: 714-723.
[35] Rodriguez-Lago I, Carretero C, Herraiz M, et al.Long-term follow-up study of gastroduodenal lesions after radioembolization of hepatic tumors[J].World J Gastroenterol, 2013, 19: 2935-2940.
[36] Padia SA,LewandowskiRJ,Johnson GE,etal.Radioembolization of hepatic malignancies: background, quality improvement guidelines, and future directions[J].J Vasc Interv Radiol,2017, 28:1-15.
[37] Carr BI.Hepatic arterial 90 yttrium glass microspheres(TheraSphere) for unresectable hepatocellular carcinoma: interim safety and survival data on 65 patients[J].Liver Transpl, 2004,10(2 Suppl 1): S107-S110.
[38] Otte A,Herrmann R,Heppeler A,etal.Yttrium-90 DOTATOC:first clinical results[J].Eur J Nucl Med, 1999, 26: 1439-1447.
[39] Sangro B, Martinez-Urbistondo D, Bester L, et al.Prevention and treatment of complications of selective internal radiation therapy: expert guidance and systematic review[J].Hepatology,2017,66:969-982.

