CT引导下肺部肿瘤同轴穿刺活检联合微波消融治疗的临床应用
刘晶晶, 吴志远, 黄 蔚, 丁晓毅, 王忠敏
肺恶性肿瘤是目前全球发病率和死亡率最高的恶性肿瘤之一,严重威胁着人们健康和生命,近年来其发病率和死亡率均有逐年上升的趋势。虽然目前外科手术仍是肺恶性肿瘤首选的治疗方法,但临床上仅15%患者就诊时符合手术适应证[1]。对于因心肺功能障碍及其他并发症不能耐受或不愿行手术治疗和已经失去手术机会的晚期患者,以微波消融(MWA)为代表的非手术性局部热消融治疗成为重要的治疗手段。研究显示,经皮穿刺MWA治疗肺部肿瘤的临床疗效可靠[2-4]。然而,对于肺部肿瘤行同轴穿刺活检联合MWA治疗的相关研究资料及数据较少。本研究对上海交通大学医学院附属瑞金医院近年来收治的肺部恶性肿瘤(原发性或转移性)患者进行CT引导下对肺部肿瘤同轴穿刺活检联合MWA治疗,现将结果报道如下。
1 材料与方法
1..1 材料
1.1.1 一般资料 收集2014年8月至2016年6月在我院放射介入科住院的20例患者,其中男14例,女6例;年龄41~77岁,中位年龄为64.5岁;经胸部CT发现肺部23个占位性病变。根据患者病史及相关影像学表现,原发性肺癌9例,转移性肺癌11例(原发灶经手术或穿刺病理已证实);共消融23个病灶,对单个病灶进行消融的为22例,对2~3个病灶进行消融的为2例;肿瘤直径为0.80~2.40 cm,平均直径为1.39 cm。所有入组患者在治疗前均病情稳定,且均无出血倾向及凝血功能异常。其中,临床分期为Ⅳ的患者(无论原发性还是转移性)均未做过术后辅助化疗,表1。
1.1.2 仪器设备 采用南京维京九洲(Vison)公司生产的MTC-3C型MWA治疗仪,微波频率为(2 450±50)MHz,输出功率为5~120W(逐步可调)及18 G微波消融针(Vison公司)。采用GE公司生产的Light Speed 16层螺旋CT作为影像引导设备。使用17 G套管针和18 G活检枪(上海美创医疗器械有限公司)。

表1 患者一般情况
1.2 方法
1.2.1 术前准备 术前常规行胸部增强CT扫描评估肿瘤位置、数目和大小。术前检查血常规、肝肾功能、电解质和心电图,术前禁食6 h,术前晚8点起使用芬太尼透皮贴剂2.5mg贴于胸壁(避免手术区域),术前30min注射哌替啶50mg和地西泮10mg,患者及家属均签署CT引导下行同轴穿刺活检联合MWA治疗知情同意书。
1.2.2 操作方法 患者取仰卧位或俯卧位,外接心电监护,同时建立静脉通道。根据术前增强CT图像选择最佳的穿刺层面,避开大血管及肋骨、肩胛骨等邻近的骨骼,选择距肿瘤中心最近的点为胸壁皮肤穿刺点,设计最适合的进针方向、进针角度及穿刺深度。常规消毒铺巾,2%利多卡因5ml局部浸润麻醉。穿刺选用分段进针法,根据患者肺部病灶所在的位置,使引导针针尖位于距离病灶最近的胸壁组织内,选择相应进针深度,再行CT扫描以确定进针方向和角度是否正确,如有偏差,适当调整引导针方向后再进针。在确认针尖位于病灶后,同轴置入活检枪,根据病灶大小的不同选择不同长度的标本,取材长度不超过活检路径上的病灶厚度,一般所取标本的长度为1~2 cm,取材1~2次。穿刺活检标本均用4%甲醛液固定,送细胞学、组织病理学和免疫组织化学检查。
然后通过引导针将MWA电极针置于病灶内,再次行CT扫描确定针尖位置无误后,连接MWA治疗仪及水循环冷却仪。根据病灶大小设定相应的功率(60~80W)和消融时间(3~10 min),微波频率2 450 MHz。消融范围应超过肿瘤边缘0.5~1.0mm。治疗结束后嘱患者屏气,缓慢退出消融针并行针道消融,以达到止血和防止肿瘤沿针道播散的目的。术后立即行CT扫描,观察有无气胸、血气胸等并发症。
1.2.3 疗效评价及并发症 在治疗后1、3、6个月连续复查胸部增强CT并观察病灶变化。对于CT引导下同轴穿刺活检及MWA治疗肺部肿瘤的疗效判断,主要依据胸部增强CT检查:①MWA治疗后1个月复查胸部增强CT,与治疗前CT片进行对比观察肿瘤是否强化。肿瘤坏死评价标准:完全消融,指肿瘤100%无强化;部分消融,指肿瘤无强化区≥50%;③无消融,指肿瘤无强化区<50%。②MWA治疗后3、6个月复查胸部增强CT,根据改良实体瘤的疗效评价标准(mRECIST 标准)进行评估[5]: CR,指所有靶病灶的任何肿瘤内动脉增强消失;PR,指以基线靶病灶直径总和为参考,靶病灶变量(动脉期直径总和)比治疗前缩小≥30%;SD,指既不符合PR也不符合PD;PD,指以基线靶病灶直径总和为参考,靶病灶变量(动脉期直径总和)比治疗前增大≥30%。治疗有效率(RR)=(CR例数+PR例数)/总例数×100%。对于治疗后1个月内出现的症状被视为治疗相关并发症。
1.2.4 随访 随访时间截至2016年10月,随访4~26个月,中位随访时间20个月,随访率为100%。总生存率(OS)被定义为从进行CT引导下同轴穿刺活检联合MWA治疗的日期开始,至死亡之日止或最后一次随访的时间。无进展生存时间(PFS)定义为从患者接受肺部肿瘤同轴穿刺活检联合MWA治疗至出现进展或死亡的时间。
1.3 统计学方法
所有统计分析均使用SPSS17.0统计软件包。用Kaplan-Meier法进行OS和PFS的计算。
2 结果
2.1 治疗情况及疗效
20例患者共23个病灶行CT引导下同轴穿刺活检术,结合患者病史及相关影像学资料,经CT引导下穿刺活检病理证实原发性肺癌9例(原位癌4例,肺鳞癌1例,肺腺癌3例,肺肉瘤样癌1例),转移性肺癌11例(肠腺癌肺转移6例,食管癌肺转移2例,肾癌肺转移1例,嗜铬细胞瘤肺转移1例,恶性神经鞘瘤肺转移1例),术后穿刺病理示原发性和继发性肺恶性肿瘤总体阳性率为83.3%。
入组的患者均顺利完成手术,消融时间为1~10min,平均4.5min。治疗后即刻行CT扫描,所有消融灶表现为阴影增大,多数病灶边缘模糊,部分病灶出现空泡样改变。治疗1个月后行胸部增强CT检查,消融后的病灶大小仍较原肿瘤大,增强扫描示中心无强化,外周见强化,外缘仍不清晰。20个病灶无强化,3个病灶仅部分周边强化,大部分病灶内出现空泡样改变。3~6个月后复查胸部增强CT检查,大部分病灶有不同程度缩小,增强扫描整个消融灶区域无强化(图1)。评价疗效:获CR 15例,病灶内部和周边均无强化,随时间延长病灶变为空泡及纤维瘢痕;获PR 2例,SD 1例,PD 2例,RR为85%。
2.2 并发症及处理
在行MWA过程中,18例患者出现局部疼痛和热感,均可耐受,治疗后局部无不适感。术后立即行CT检查,1例患者显示为血气胸,随即转至胸外科行胸腔闭式引流,1个月后患者各项指标恢复正常,复查CT显示血气胸消失。1例患者术后出现急性渗出性胸膜炎,伴中等量胸腔积液,随即转至呼吸科行胸腔穿刺引流置管术,并予以抗感染治疗,2周后患者病情平稳,各项指标恢复正常,1个月后复查X线胸片显示炎症吸收。1例患者术后随即出现极少量气胸,1个月后复查胸部CT,显示气胸消失。2例患者于治疗后2~7 d出现发热,体温37.6~38.3℃,持续3~5 d,经抗炎及退热等对症处理后均恢复正常。治疗后1个月内无患者死亡。所有患者无一例发生针道转移。
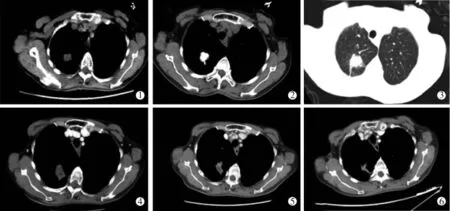
图1 直肠恶性肿瘤肺转移患者治疗前后图像
2.3 随访情况
随访至截止日期,17例患者存活,1年局部控制率为65%,中位PFS为15.5个月(95%CI 16.6~23.4),3例患者死亡,此3例患者均为转移性肺癌,且均死于原发肿瘤的进展(1例死于肠癌进展,1例死于食管癌进展,1例死于肝癌进展)。1和2年生存率分别为90%和85%(图2)。对于病情未的得到完全缓解的患者,我们根据其影像学表现,进行治疗干预,2例PR的患者进行再次MWA术,SD和PD的例患者予以125I粒子植入术以局部控制病灶。
3 讨论
随着影像学技术的飞速发展,现今,肺部结节的检出率得到明显提高。但肺部结节的性质,单靠临床检查、影像学和实验室检查常常无法明确诊断,而且大部分肺部结节的治疗需要建立在病理学诊断基础上,尤其是化疗或靶向治疗。不同类型的肺部恶性肿瘤其治疗方案和预后均有很大差别。过去主要通过手术获得病理诊断[6],但手术存在创伤大、费用高、并发症多、患者住院周期长等缺点。CT引导下经皮肺病灶穿刺活检术对肺外周复杂性疾病的诊断存在优势[7]。这虽然是一种安全可靠的方法,但因其为有创性检查,其主要并发症为气胸及局部肺出血[8-10]。据报道,常规应用切割针活检时,气胸和肺出血的发生率可高达43%和33%[11],明显高于本研究使用同轴穿刺活检术气胸和肺出血的发生率5%(P<0.05)。所以在穿刺活检过程中应用同轴穿刺的方法来降低并发症,有着重要的临床意义。本研究中,应用CT引导同轴穿刺活检可有效获取组织标本,穿刺取材成功率为83.3%。Stattaus等[12]报道95.9%CT引导同轴穿刺活检病例可获得明确的病理诊断,成功率明显高于超声引导穿刺活检和细针抽吸穿刺活检。对于肺部肿瘤,该技术具有较高的安全性,而且敏感性和特异性均较高[13]。
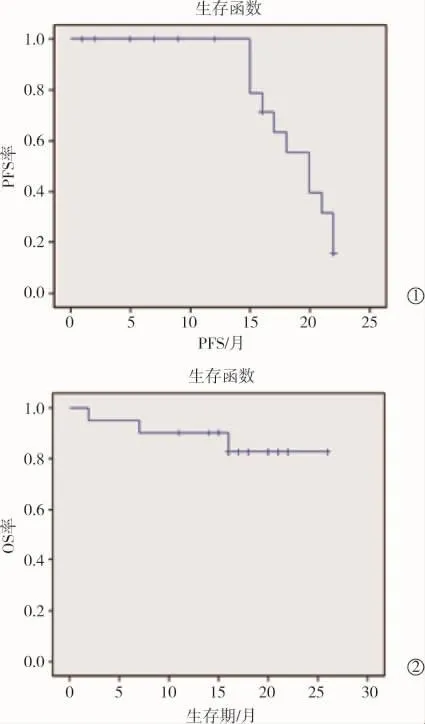
图2 患者生存曲线图
Lu等[14]对69例肺部恶性肿瘤患者进行非同轴穿刺MWA治疗,结果显示其1年和2年的生存率分别为66.7%和44.9%,显著低于本研究中使用同轴穿刺活检联合MWA术1年和2年的生存率90%和85%(P<0.05)。同样,在另一项研究中,对329例肺恶性肿瘤患者行射频消融(RFA)术,其1年和2年的生存率分别为68.2%和35.3%[15],显著低于本研究中使用同轴穿刺活检联合MWA术1年和2年的生存率90%和85%(P<0.05)。此外,对于充气的肺组织,RFA存在一定的“绝缘效应”,而MWA却没有这一局限,因此能够更好地发挥热效应[16]。使用同轴穿刺活检联合MWA术治疗肺部恶性肿瘤不但降低了穿刺并发症,而且提高了患者1年和2年的生存率,其治疗肺恶性肿瘤的效果是显著的。截止至随访日期,本研究中3例死者均因原发肿瘤进展死亡。1例因结肠癌进展,导致肠梗阻、电解质紊乱死亡;1例因食管癌进展,长期无法进食导致恶液质死亡;1例因肝癌进展,导致肝肾综合征、大量腹水伴细菌性腹膜炎、感染性休克死亡。
相对于单纯MWA技术,CT引导同轴穿刺活检联合MWA法更适于肺部组织的诊断及治疗。据报道,对于肺内病变,多层螺旋CT引导下经皮同轴穿刺术活检阳性率可达94.9%,特异度高达100%[17]。该方法活检诊断准确率高,是一种安全的经皮肺活检方法。此种方法的引导针较为轻巧,便于操作,并可减少因穿刺针本身重量所产生的针尖偏移,从而提高穿刺精确度。通过引导针的同轴定位单次穿刺,可在小范围内调整角度多次取材,减少了胸膜穿破次数,降低了病灶周围肺小血管及支气管分支受损的概率,从而大大降低了穿刺的并发症。部分需要采取俯卧位且位置处于较深部的病灶,由于需采用后入路进针法,进针时需通过背部较厚的肌群,如采用非同轴穿刺针,背部肌群的腱膜会明显降低切割针的切割速度,影响标本的取材量[18]。而同轴穿刺法由于有引导针的保护,可消除穿刺路径上坚韧组织对切割针的阻碍,从而提高取材质量,提高活检阳性率。同样,采用同轴穿刺行MWA,可在小范围内多次调整角度,减少穿刺的次数以及CT扫描的次数,缩短手术时间,并减少并发症的发生。在本研究中,结合患者相关病史、影像学资料等情况,术后穿刺病理显示原发性和继发性肺恶性肿瘤总体阳性率为83.3%。这可能主要与如下因素有关:部分病灶体积较小(最小直径为0.6 cm),部分病灶距离胸腔大血管较近。为进一步减少出血和气胸的发生的风险,因此,对于消融的病灶,我们只进行一次活检。
对肺部病灶行CT引导同轴穿刺活检及MWA具有微创、阳性率高、疗效好、并发症少的优点。本研究中仅1例患者出现血气胸,1例患者出现急性渗出性胸膜炎,经保守治疗后均恢复良好。然而,CT引导同轴穿刺活检及消融技术仍存在一定的风险,需严格把握适应证和禁忌证。穿刺时,应尽可能避开胸腔大血管,最大限度减少出血和损伤。进针时应在CT引导下分段进行,根据病灶所在的位置,使引导针针尖位于距离病灶最近的胸壁组织内,选择相应进针深度,再行CT扫描以确定进针方向和角度是否正确,如有偏差,应及时纠正。仰卧位前入路进针时,应缓慢进针,避开重要血管,注意防止气胸的发生。在行多发性病灶穿刺时,应尽量选择较大的病灶,取材时选择病灶周边的实质成分,避开病灶中央可能坏死或液化的组织。对于穿刺活检阴性的患者,但临床高度怀疑原发或继发恶性肿瘤,应重复穿刺活检。本研究中有2例患者病理诊断为良性病变,其在之后的随访中被证实为恶性肿瘤。因此,对于临床上高度怀疑为原发或继发恶性肿瘤的患者,若其穿刺病理结果为良性,应再次进行穿刺活检,以避免因取材过少而导致的漏诊或误诊,从而延误病情。
研究表明,一般直径不超过3.0 cm的病灶才能达到完全消融灶。如病灶的体积较大或形态不规则,则可能导致瘤体周边消融不完全,易出现肿瘤的复发或转移。因此,可采取多次进针的方法,直至覆盖整个病灶。但如果病灶过大或由于其他因素影响不能使消融作用完全理盖肿瘤时,可导致消融不全或局部复发,正确选择消融部位使之完全消融是提高疗效的关键。由于血液循环的散热作用,对于一些靠近大血管的病灶,MWA的效果可能欠佳。
疼痛和发热是MWA治疗最常见的并发症。疼痛一般为轻到中度,常规术前一晚使用芬太尼透皮贴剂2.5mg、术前30min使用哌替啶50mg肌注预防性止痛,大多患者可耐受。部分位于胸膜附近的病灶疼痛程度可能较高,一般选择全麻方式来避免此类疼痛。治疗后可出现轻至中度发热,可能为肿瘤的无菌性坏死所致的吸收热,常规术后3 d使用左氧氟沙星预防感染,必要时使用新癀片或吲哚美辛栓半粒纳肛等对症治疗。部分患者会出现少量气胸,均在1~2周后自行吸收。本研究中仅1例出现血气胸、1例出现急性渗出性胸膜炎,予以及时胸腔引流及对症处理后均恢复良好。提示同轴穿刺活检及MWA存在一定的并发症,需严格掌握适应证和禁忌证,术后须立即行CT扫描并密切监测生命体征变化,如发现并发症需及时处理。本研究中,术后1个月内无患者死亡且所有患者无一例发生针道转移,说明CT引导下同轴穿刺活检联合MWA治疗具有安全性高、并发症少的优势。
综上所述,CT引导下同轴穿刺活检联合MWA治疗肺部肿瘤具有创伤小、活检阳性率高、安全性高、疗效好等优点,是不能耐受手术或不愿意行外科手术治疗的肺部恶性肿瘤患者的最优选择之一。可对病灶进行原位有效的灭活,有效减轻肿瘤负荷,提高治疗效果,提高患者的生活质量并延长生存时间,是目前应用前景较好的一种介入治疗方式。
[1] Yan TD,Black D,Bannon PG, et al.Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer[J].JClin Oncol, 2009,27:2553-2562.
[2] Ko WC, Lee YF, Chen YC, et al.CT-guided percutaneous microwave ablation of pulmonary malignant tumors[J].J Thorac Dis, 2016, 8(Suppl 9): S659-S665.
[3] Healey TT,March BT,Baird G,et al.Microwave ablation for lung neoplasms: a retrospective analysis of long-term results[J].JVasc Interv Radiol, 2017, 28: 206-211.
[4] Men M,Ye X,Fan W,et al.Short-term outcomes and safety of computed tomography-guided percutaneousmicrowave ablation of solitary adrenal metastasis from lung cancer:a multicenter retrospective study[J].Korean JRadiol, 2016, 17: 864-873.
[5] Lencioni R,Montal R,Torres F, et al.Objective response by mRECIST as a predictor and potential surrogate end-point of overall survival in advanced HCC[J].J Hepatol, 2017, 66:1166-1172.
[6] Chew C,Reid R,O'dwyer PJ.Value of biopsy in the assessment of a retroperitonealmass[J].Surgeon, 2006, 4: 79-81.
[7] 王 琤,张党博.CT引导经皮肺穿刺活检的临床评价[J].国际呼吸杂志,2014,34:594-596.
[8] Beslic S, Zukic F, Milisic S.Percutaneous transthoracic CT guided biopsies of lung lesions:fine needle aspiration biopsy versus core biopsy[J].Radiol Oncol, 2012, 46: 19-22.
[9] Wu CC,Maher MM,Shepard JA.Complications of CT-guided percutaneous needle biopsy of the chest: prevention and management[J].AJRAm JRoentgenol, 2011, 196: W678-W682.
[10]Yao X,Gomes MM,Tsao MS,et al.Fine-needle aspiration biopsy versus core-needle biopsy in diagnosing lung cancer:a systematic review[J].Curr Oncol, 2012, 19: e16-e27.
[11]周 超,沈美珠,俞江月.经皮肺穿刺活检和经支气管活检对不同周围型肺病诊断价值评价[J].国际呼吸杂志,2011,31:109-112.
[12] Stattaus J, Kalkmann J, Kuehl H, et al.Diagnostic yield of computed tomography-guided coaxial core biopsy of undetermined masses in the free retroperitoneal space:single-center experience[J].Cardiovasc Intervent Radiol, 2008, 31: 919-925.
[13] Schulze R,Seebacher G,Enderes B,et al.Complications in CT-guided,semi-automatic coaxialcorebiopsyofpotentiallymalignant pulmonary lesions[J].Rofo, 2015, 187: 697-702.
[14] Lu Q,CaoW,Huang L,etal.CT-guided percutaneousmicrowave ablation of pulmonary malignancies: Results in 69 cases[J].World JSurg Oncol, 2012, 10: 80.
[15]卢 强,李小飞,韩 勇,等.射频消融治疗329例肺部恶性肿瘤临床安全及疗效的研究[J].中国肺癌杂志,2011,14:865-869.
[16] Sidoff L, Dupuy DE.Clinical experienceswithmicrowave thermal ablation of lung malignancies[J].Int J Hyperthermia, 2017,33:25-33.
[17]贾宁阳,刘士远,李文涛,等.多层CT引导下经皮同轴穿刺活检技术的临床应用[J].介入放射学杂志,2008,17:200-203.
[18]黄 蔚,陈克敏,吴志远,等.CT引导同轴穿刺活检在腹膜后淋巴结病变诊断中的应用[J].介入放射学杂志,2010,19: 792-794.

