废水中硝基苯降解菌的分离鉴定及特性研究
刘小琳 康巧梅
(福建师范大学闽南科技学院 福建泉州 362332)
引言
硝基苯是制造苯胺的主要原材料,广泛应用于化工、染料和医药工业,且在很长一段时间内不会被替代,而工业生产过程中排放的硝基苯对环境和人体健康产生很大威胁,被各国列入优先处理的污染物[1,2]。据统计全世界约有1万吨/年的硝基苯排入环境中[3],导致环境承受严重负担,为了降低硝基苯带来的影响,需要采取有效措施降低硝基苯污染带来的危害。目前对硝基苯废水的处理大多采用吸附、氧化、沉淀及辐照等物理化学方法,易引起二次污染[4,5]。而相对于物理化学方法,微生物降解具有成本低、效率高、不易产生二次污染等特点[6,7]。采用微生物降解方式,可以有效修复环境,确保水资源和土壤资源能够得到循环利用,提高自然环境的自净能力,维持自然环境可持续发展[8]。但由于工业废水的污染物浓度和种类有很大差异,培养筛选出对硝基苯化合物有高效、通用的降解菌群,使之应用于废水处理具有重要的意义。本实验从三家化工厂排污口的污泥中分离得到以对硝基苯作为单一碳源[9]的高效降解菌,并对其降解特性和种属关系进行研究和探索,为降解工业废水中的硝基苯研究提供参考依据。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
样本分别取自福建省三家化工厂排污口污泥;大肠杆菌Escherichia coli DH5α由实验室保存;PMD18-T载体购自Takara生物公司。
1.1.2 主要培养基和试剂
无机盐培养基:NaCl1.00g/L,(NH4)2SO41.00g/L,K2HPO41.50g/L,KH2PO40.50g/L,MgSO40.15g/L,KNO31.00 g/L,pH7.0;富集培养基:在无机盐培养基中添加50mg/L的硝基苯作为唯一碳源;LB培养基;UNIQ-10柱式DNA胶回收试剂盒、氨苄青霉素。
1.2 实验方法
1.2.1 降解菌的筛选
分别称取不同地区排污口污泥2.0g加入50ml无菌蒸馏水,充分震荡20min,取5ml上清液,加入100ml的富集培养基中,于28℃,180rpm/min的振荡培养箱中培养3d,待培养基浑浊后,取菌悬液 5 ml加入100ml富集培养基培养,重复转接5次,进行稀释,取100 uL涂布于富集培养基固体平板上,28℃培养3d。挑取单菌落接种于富集培养基中,于28℃,180 r/min摇床培养1d,检测降解效果。
检测方法:取 5ml培养液,3000 rpm/min,离心20min,取上清液2 ml,用萘乙二胺偶氮光度法测定[10],同时绘制空白实验和标准曲线。
1.2.2 菌种M3形态学鉴定
挑取M3单菌落将其接种至2ml富集培养基中,28℃,180rpm/min培养1d,取100ul菌液涂布于富集平板培养基,28℃培养1d,观察菌落形态。
1.2.3 菌种分子鉴定
1.2.3.1 总DNA提取[11]
取菌液1.5ml,置于1.5mlEP管,12000rmp,离心5min。弃上清,收集菌体。晾干,加入500uL的DNA抽提液,旋涡混匀1-2min,在55℃下保温1h;加入500uL的酚/氯仿(1:1),混匀 3-6min,溶液呈现乳白色,12000rpm,离心 10min,4℃;取上清液,加入 5μL Rnase,37℃,保温 20-30min;再加入等体积的氯仿;离心取上清,加入1/10的NaAc(3mol/LpH5.2)和2倍体积的无水乙醇,-20℃沉淀30min以上,离心弃上清;再加入75%的乙醇1ml,悬浮沉淀;离心弃上清,每管中再加入25μL的ddH2O,在-20℃下保存。
1.2.3.2 16s扩增
用16s通用引物(上游引物:5'-CAGAGTTTGATCCTGGCT-3',下游引物:5'-AGGAGGTGATCCAGCCGCA-3)进行扩增。所有PCR反应均在50μL标准反应体系中进行,其中含有10×PCR缓冲液5 μL,模板DNA、上游引物、下游引物各1μL,dNTP4 μL,Taq 聚合酶 0.5μL,加 ddH2O 至 50ul,于PCR仪上按94℃变性5min,94℃ 30 s,55℃ 30 s,72℃2 min,重复以上步骤共30个循环,最后72℃延伸10 min。
1.2.3.3 PCR产物回收、连接与转化
采用切胶纯化法,按柱式DNA胶回收试剂盒说明进行。回收获得的DNA产物与PMD18-T vector在16℃下进行隔夜连接。将连接产物转入感受态细胞EcoliDH5α进行培养。
1.2.3.4 菌落PCR验证
挑取转化子接种于含氨苄(100mg/L)5ml培养基中,37℃恒温振荡过夜培养;用同16S rDNA基因PCR的反应体系和条件,用16s上下游引物,进行扩增验证。
1.2.3.5 测序、比对及进化树构建
上海生工进行测序,并且对测序结果进行序列拼接、比对和进化树分析。
1.2.4 菌种M3降解特性的研究
将分离纯化得到的M3菌种接于100ml添加有50mg/L硝基苯的无机盐培养基中,分别改变温度、pH值和转速,培养24h后测定硝基苯的降解率,研究温度、pH和转速对硝基苯降解率的影响。
2 结果与分析
2.1 降解菌降解能力的测定
经分离纯化,在固体平板上得到8株有降解能力的菌种,编号M1到M8。然后,将8株菌接种于添加有硝基苯的液体无机盐培养基(硝基苯初始浓度为25mg/l),经48h培养后,测定降解率。结果见图1所示,8株菌种均能降解硝基苯,其中M8对硝基苯的降解率最低,仅为12.53%,M3对硝基苯的降解率最高,达56.94%,因此初步认定M3为高效降解菌种。
2.2 M3菌落形态的观察
菌种M3于28℃,培养24h,其菌落形态为卵圆形,颜色微黄,表面湿润,如图2所示。
2.3 M3基因组DNA的提取
菌种M3的基因组提取结果如图3所示,DNA条带位于23.1k左右。

图2 菌落形态

图3 基因组DNA提取
2.4 16SrDNA序列克隆及系统发生树构建
2.4.1 16SrDNA序列克隆
以总DNA为模板,16S通用引物进行PCR扩增获得16s基因序列,如图4所示,PCR扩增产物在1200bp和1400bp之间。
2.4.2 16SrDNA测序结果
由上海生工测序,获得16srDNA序列,序列长度为1331bp,如图5所示。
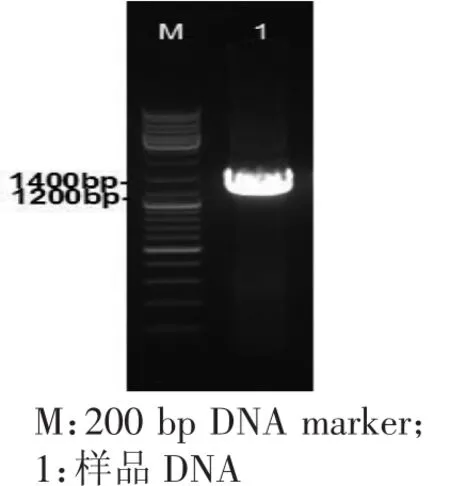
图4 16SrDNA序列克隆

图5 16SrDNA序列
2.4.3 进化树的构建
测序后将菌株16SrDNA的基因序列与Genebank上的基因序列进行相似性分析,由进化关系图6可知,该菌株属于假单胞菌属,与编号NR043533、GQ254277、KU131279.1的菌株亲缘关系最近。

图6 进化树分析
2.4.4 菌种M3的降解特性
2.4.4.1 温度对M3降解率的影响
如图7所示,在20℃—40℃范围内,随着温度的升高,降解率先升后降,在30℃降解率最高。由此可知,M3降解硝基苯的最佳温度为30℃。
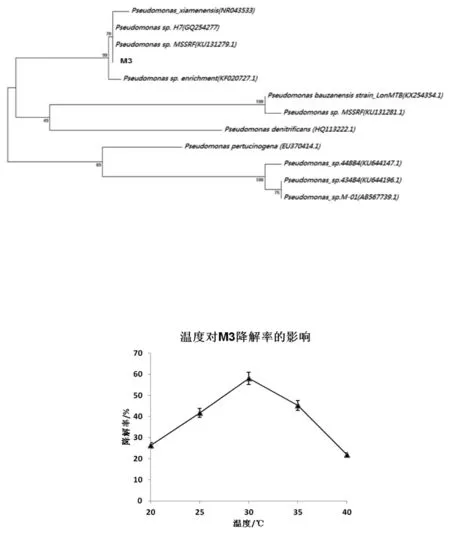
图7 温度对M3降解率的影响
2.4.4.2 pH值对M3降解率的影响
如图8所示,随pH值的升高,M3的降解率呈上升趋势,在pH为7的条件下,M3表现出最好的降解效率,随后降解率呈下降趋势。由此可知,M3降解硝基苯的最佳pH为7.0。
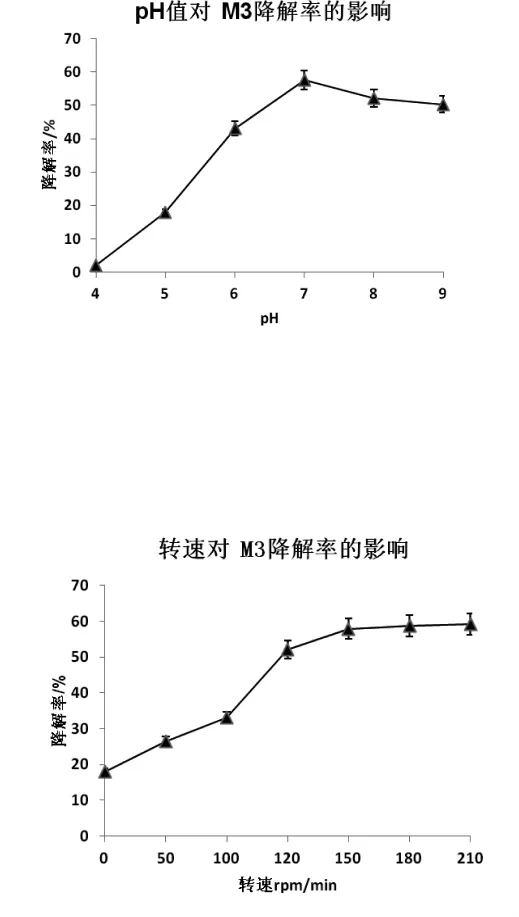
图8 pH对M3降解率的影响
2.4.4.3 转速对M3降解率的影响
如图9所示,随着转速的提高,M3的降解率逐渐提高,但转速高于150rpm/min时,降解效率不再显著增加,趋于稳定。由此可知,M3降解硝基苯的最佳培养转速为150rpm/min。

图9 转速对M3降解率的影响
结语
从化工厂污泥中分离得到8株具有降解硝基苯能力的菌种。其中菌种M3降解率最高,降解率为56.94%,对其进行形态学和16SrDNA分析,初步鉴定其为假单胞菌属。降解特性研究结果表明,M3在30℃、pH7.0、转速高于150rpm/min的条件下具有高的降解效率。
[1]ScottAN,N'GuessanAL,NymanMC.Effectivetreatmentof PAH contaminated Superfund site soil with the peroxy-acid process.[J].JournalofHazardousMaterials,2007,146(3):652-660.
[2]李易,陆锐,沈锦优,等.废水中硝基芳香化合物检测方法研究进展[J].环境化学,2016,35(7):1474-1485.
[3]左小梅.超声波—光芬顿联合降解硝基苯的研究[D].浙江工业大学,2014.
[4]康雅凝,李华楠,徐冰冰,等.酸活化赤泥催化臭氧氧化降解水中硝基苯的效能研究 [J].环境科学,2013,34(5):1790-1796.
[5]俸志荣,焦纬洲,刘有智,等.铁碳微电解处理含硝基苯废水[J].化工学报,2015,66(3):1150-1155.
[6]吴凤礼,彭彦峰,徐毅诚,等.代谢工程改造微生物生产芳香族化合物的研究进展 [J].生物加工过程,2017,15(5).
[7]鲁正伟,伍永钢,杨周生.基于微生物电解池的废水生物处理技术研究进展[J].工业水处理,2016,36(6):1-6.
[8]韩建治,吴兴国.环境生物技术在环境污染治理中的应用研究[J].低碳世界,2017(6):20-21.
[9]黄兴如,张彩文,张瑞杰,等.多环芳烃降解菌的筛选、鉴定及降解特性[J].微生物学通报,2016,43(5):965-973.
[10]蚁焕钿,张圆,何瀚涛.还原-偶氮光度法测定水中硝基苯类方法改进[J].福建分析测试,2013,22(5):42-44.
[11]Vesty A,Biswas K,Taylor M W,et al.Evaluating the Impact of DNA Extraction Method on the Representation of Human Oral Bacterial and Fungal Communities[J].Plos One,2017,12(1):e0169877.

