新疆赤霞珠葡萄皮渣中多酚类物质质量分数及其复合抗氧化剂研究
李婉平,吕晓彤,李若兰,鞠延仑,马娜娜,房玉林,2
(1.西北农林科技大学 葡萄酒学院,陕西杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌 712100)
葡萄多酚类物质是一种天然抗氧化剂,在抗肿瘤、抗癌、预防心血管疾病、延缓机体衰老等方面有重要作用,同时具有很强的生物活性和药理活性,美国及欧洲的一些国家在葡萄多酚类物质的开发与推广方面已有显著成果[1]。
葡萄中具有生物活性的多酚物质,主要分布在葡萄皮和籽等部位中,在枝条、卷须和叶片中也有少量分布[2]。多酚物质在流行病方面具有降血脂、抗过敏、抗菌,预防心脏病、高血压等功效[3-4];在食品加工领域,葡萄皮渣中抗氧化成分在肉制品和食用油中可以有效推迟氧化[5];在日化化工方面,单宁是重要的化工原料经常被用在印染、皮革工业、制作墨水等方面[6]。然而在葡萄酒的加工过程中,会产生大量的葡萄皮、葡萄籽和葡萄梗等废弃物,鲜果中有20%~30%的比重将成为葡萄工业废弃物。这些葡萄废弃物大部分用于制作肥料、饲料或成为烧材,限制了废弃物的利用价值,也会对环境产生不利影响。因此,对葡萄皮渣中多酚类物质提取及合理开发利用至关重要,目前尚未有报道研究葡萄皮渣多酚与其他抗氧化剂的协同增效作用。本试验主要研究葡萄皮渣中的多酚类物质质量分数,并研究其复合抗氧化剂的抑菌作用,结果将为葡萄皮渣多酚类物质的应用研究提供参考。
1 材料与方法
1.1 材 料
1.1.1 植物材料 试材取自新疆和硕芳香庄园,酒精发酵结束后的赤霞珠葡萄皮渣,用蒸馏水清洗干净后-40 ℃保存,待用。
1.1.2 试验菌株 供试大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphyloccocusaureus)及沙门氏杆菌(Salmonellatyphi)均由西北农林科技大学食品学院馈赠。
1.1.3 主要试剂与设备 DPPH,购自美国Sigma公司;维生素C、柠檬酸、三氯乙酸、水杨酸、铁氰化钾、硫酸亚铁、三氯化铁、焦亚硫酸钠,均购自天津市博迪化工有限公司;香兰素,购自广州金华大化学试剂有限公司;所有试剂均为分析纯级。ME-1型大孔吸附树脂。LB琼脂细菌培养基,复合抗氧化剂样品溶液。
SORVAIL RC-5C-PLUS型高速冷冻台式离心机,购自美国Kendro公司;UV-1700紫外分光光度计,购自日本岛津公司;薄膜旋转蒸发仪,购自上海申生科有限公司;立式压力蒸汽灭菌器,购自上海申安医疗器械厂。
1.2 方 法
1.2.1 酚类物质提取 葡萄皮渣酚类物质提取的方法参照刘芸等[7]和叶新红等[8]的方法。
1.2.2 葡萄皮渣多酚测定 葡萄皮渣的总酚质量分数测定采用福林-肖卡法[9];葡萄皮渣中总类黄酮质量分数的测定参考Peinado等[10]的方法;葡萄皮渣的总黄烷醇质量分数测定采用p-DMACA-盐酸法[11];葡萄皮渣的单宁质量分数测定使用福林-丹尼斯(Folin-Denis)法[12]。原花青素测定参照Godoy等[13]的方法,绘制标准曲线后,取稀释2倍的葡萄皮渣提取液0.5 mL于10 mL 离心管中,加入1.5 mL浓盐酸,3 mL体积分数为4%的香草醛甲醇溶液,混匀,20 ℃水浴15 min,以纯水为对照,在500 nm 处测定吸光值。结果用儿茶素表示(mg·g-1)。
1.2.3 复合抗氧化剂复配研究 葡萄多酚的制备参考王丽媛等[14]和李华等[15]的方法,稍作改动。试验选取ME-1树脂完成分离纯化过程[16]。树脂装柱于2.6 cm×30 cm的柱内。以2 mL·min-1的流速进行浓缩液上样,每次上样17 BV,用65 BV的蒸馏水除去残留在树脂上的杂质后,用体积分数75%的乙醇溶液开始动态洗脱,大约用5 BV洗脱剂,低压浓缩处理洗脱得到的多酚物质,再将浓缩液冷却到室温后平铺于培养皿内,浓缩液厚度不得高于1 cm,保鲜膜密封培养皿后置于-20 ℃冰箱中,经48 h冷冻后进行真空冷冻干燥,最终获得葡萄多酚的干燥物。
铁氰化钾还原力参照韩林等[17]的方法测定,羟自由基清除力参照郎娜等[18]的方法测定,DPPH清除力参照Phoency等[19]的方法测定。
1.2.4 复合抗氧化剂抑菌性检测 移液枪头灭菌后分别吸取菌悬液0.1 mL,转入平板内后用无菌的三角玻璃刮铲均匀涂布。用灭菌镊子夹取高压蒸汽灭菌且将于150 ℃烘干处理后的牛津杯,放在均匀涂布的培养皿中,3个菌种分别做3个平行。十字对称方式在培养皿内放4个牛津杯,无菌枪头分别吸取质量浓度为2.0、2.5、3.0 mg·mL-1的复合抗氧化剂溶液200 μL于牛津杯中,用体积分数为0.85%无菌生理盐水作对照。将制备好的培养皿置于37 ℃的恒温培养箱内24 h,取出观察抑菌情况并拍照。重复3次,最终直径取3次抑菌圈直径平均值。
所有数据使用 Mircrosoft Excel 2003 和 SPSS 17.0 进行图表绘制与数据分析。
2 结果与分析
2.1 葡萄皮渣多酚质量分数
由表1可见,葡萄皮渣中含有丰富的酚类物质,其中总酚质量分数最高(7.113 6 mg·g-1),单宁质量分数最低(0.068 97 mg·g-1)。研究表明酚类物质在医学、日用化工、食品等领域有广泛应用。合理地提取利用葡萄皮渣中的酚类物质,不仅可以减少葡萄酒产业的废弃物,而且可以增加葡萄产业的附加值,开发利用前景广阔。

表1 葡萄皮渣中多酚质量分数Table 1 Polyphenols of grape pomace
注:结果以3次重复试验的“平均值±标准差”表示。
Note:Values represent “means±SD” of three replications.
2.2 复合抗氧化剂配比研究
2.2.1 增效剂的筛选 葡萄多酚的抗氧化性非常强,若将葡萄多酚与一些抗氧化剂如维生素C和维生素E,或柠檬酸、酒石酸等增效剂进行复配使用会有显著的增效协同效果。研究选择维生素E、柠檬酸和维生素C,质量浓度分别为0.1、0.5、1.0、3.0、5.0 mg·mL-1,进行抗氧化性试验并选择出合适的复配剂与葡萄多酚复配。
由图1-A可看出,随抗氧化剂质量浓度的增加,维生素C的铁氰化钾还原力不断上升,并且显著高于柠檬酸和维生素E的还原力。维生素E铁氰化钾还原力随质量浓度的增大而增大,当质量浓度达到3.0 mg·mL-1时,铁氰化钾还原能力达到峰值,之后逐渐下降。相比之下,柠檬酸的铁氰化钾还原力始终较弱。
图1-B显示,随着抗氧化剂质量浓度的增加,维生素C引起的DPPH·清除率不断上升,并显著高于柠檬酸和维生素E,柠檬酸DPPH·清除率随质量浓度的增大而增大,在质量浓度为1.0 mg·mL-1时达到峰值,之后逐渐下降,但始终略高于维生素E,相比之下,维生素E的DPPH·清除率几乎可以忽略。
由图1-C可看出,随3种抗氧化剂质量浓度增加,对应的羟自由基清除率相差较小,羟自由基清除率随着维生素C和柠檬酸的质量浓度的增大而增大,在维生素E质量浓度达到3.0 mg·mL-1时,羟自由基清除率达到峰值,之后有逐渐下降的趋势。
由以上分析可得,维生素C的抗氧化能力在3种增效剂中最强,虽然维生素E和柠檬酸的抗氧化能力相差较小,但考虑到维生素E属油溶性物质而不溶于水,不利于试验操作,故最终选择维生素C、柠檬酸以及葡萄多酚3种抗氧化物质进行复合研究。
2.2.2 葡萄多酚抗氧化性浓度的确定 为研究葡萄多酚抗氧化性最佳质量浓度,在不同多酚浓度下测定抗氧化能力。
如图2-A,随着葡萄多酚质量浓度增加,羟自由基清除率呈明显的先增后减趋势,当葡萄多酚质量浓度为0.05 mg·mL-1时羟自由基清除率达到最高值91.74%,DPPH·清除率起初随葡萄多酚质量浓度的加大而增长迅速,之后多酚质量浓度为0.07~0.15 mg·mL-1时DPPH·清除率增长变得缓慢。
如图2-B,随着葡萄多酚质量浓度的增加,葡萄多酚的还原力持续增大,当质量浓度超过0.10 mg·mL-1时,增长速度变得缓慢。综上,可选择葡萄多酚进行单因素试验,质量浓度为0.04~0.10 mg·mL-1。

图1 3种抗氧化剂的抗氧化能力Fig.1 Antioxidant capacity of three antioxidants
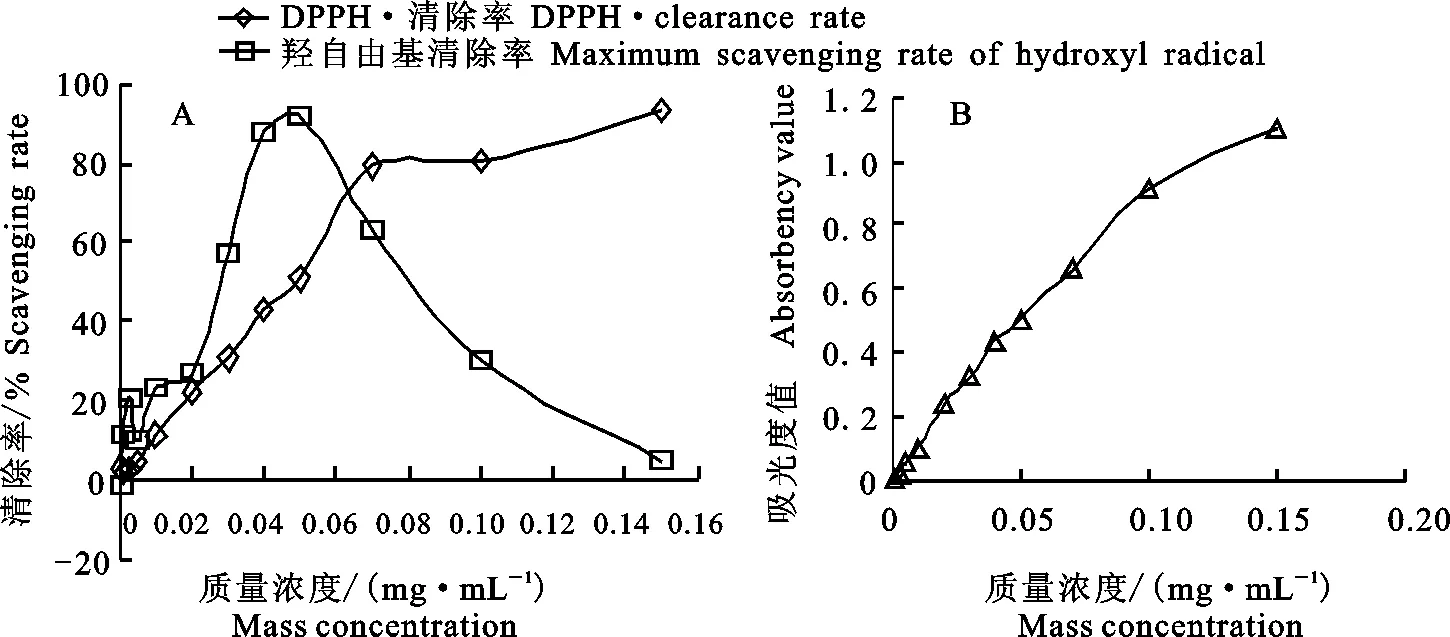
图2 葡萄多酚抗氧化能力Fig.2 Antioxidant capacity of grape polyphenol
2.2.3 葡萄多酚与其他增效剂配比单因素试验 (1)维生素C质量分数的确定:将不同质量分数的维生素C与质量分数分别为0.10%、0.006%的柠檬酸和葡萄多酚进行复配,100 mL容量瓶定容。维生素C的质量分数依次为0.005%、0.01%、0.02%、0.04%、0.06%、0.08%、0.10%、0.20%。结果如图3。
如图3-A,复合抗氧化剂的铁氰化钾还原力随着维生素C质量分数的增加先增加后降低,当质量分数从0.005%增加到0.10%时,复合抗氧化剂还原力随着质量分数的增加而增加,0.10%时达到最大值。
如图3-B,复合抗氧化剂DPPH·清除率随着维生素C质量分数的增加先增加后趋于平衡,当质量分数为0.10%时,复配液的DPPH·清除率相对较高,达到93.66%,接着DPPH·清除率变化趋于平稳。
如图3-C,复合抗氧化剂羟自由基清除率随着维生素C质量分数的增加而增加,质量分数从0.005%增加到0.10%时,清除能力变化比较大,当维生素C质量分数为0.1%时,开始趋于平缓。
综合测定结果,使用质量分数为0.1%的维生素C时复合抗氧化剂具有的抗氧化效果最佳。虽然3种不同抗氧化剂之间存在增效协同作用,但并不与抗氧化剂质量分数呈正相关[20],本试验选择质量分数为0.1%的维生素C为最佳单因素。
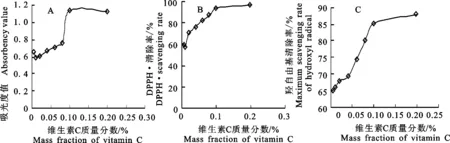
图3 维生素C的抗氧化能力Fig.3 Antioxidant capacity of vitamin C
(2) 柠檬酸质量分数的确定:将不同质量分数的柠檬酸与质量分数为0.10%的维生素C和0.006%的葡萄多酚进行复配,在100 mL容量瓶中定容后进行抗氧化性测定。柠檬酸的质量分数依次为0.01%、0.03%、0.05%、0.07%、0.10%、0.30%、0.50%。结果如图4。
图4-A表示不同质量分数柠檬酸对复合抗氧化剂铁氰化钾还原力的影响。由图4-A可见,复合抗氧剂铁氰化钾还原力随着柠檬酸质量分数的增加先增大后减小,柠檬酸质量分数为0.05%,0.07%,0.1%时还原力趋于平衡,其中质量分数为0.07%的还原力略高于0.05%和0.1%的,但相差不大,接着随柠檬酸质量分数增加,还原力开始下降。
图4-B表示不同质量分数柠檬酸对复合抗氧化剂DPPH·清除率的影响。由图可知,复合抗氧化剂DPPH·清除率随着柠檬酸质量分数的增加先增大后减小,柠檬酸质量分数为0.05%时,DPPH·清除率达到最大94.74%,接着随着柠檬酸质量分数的增加而减少。
图4-C表示不同质量分数柠檬酸对抗氧化剂羟自由基清除率的影响。由图可见,柠檬酸质量分数为0.05%时,复合抗氧化的羟自由基清除率最大,接着随着柠檬酸质量分数的增加先减小后有增大的趋势,但是根据添加剂最大摄入量问题,首先考虑在质量分数比较小的情况下,清除能力比较大的质量分数为好。
综合以上测定结果,使用质量分数为0.05%柠檬酸时复合抗氧化剂具有的抗氧化效果最佳。本试验确定质量分数为0.05%的柠檬酸为最佳单因素质量分数。
(3)葡萄多酚质量分数的确定:将不同质量分数的葡萄多酚与质量分数为0.1%的维生素C和0.05%的柠檬酸进行复配,在100 mL容量瓶中定容后进行抗氧化性测定。葡萄多酚的质量分数依次为0.001%、0.002%、0.004%、0.006%、0.008%、0.010%、0.013%、0.015%。结果如图5。
图5-A表示不同质量分数葡萄多酚对复合抗氧化剂铁氰化钾还原力的影响。由图可知,复合抗氧化剂铁氰化钾还原力随着葡萄多酚质量分数的增加而增加,在质量分数为0.002%~0.013%时,铁氰化钾还原力增长比较缓慢,当质量分数达到0.015%时有大幅增长。
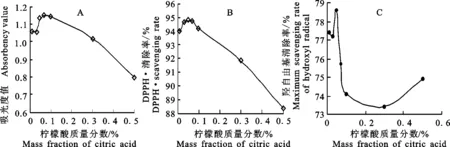
图4 柠檬酸的抗氧化能力Fig.4 Antioxidant capacity of citric acid
图5-B表示不同质量分数葡萄多酚对复合抗氧化剂DPPH·清除率的影响。由图可知,复合抗氧化剂DPPH·清除率随着葡萄多酚质量分数的增加先增加后减小,在质量分数为0.002%、0.004%时,清除能力比较高,接着随着质量分数的增加清除能力开始下降。
图5-C表示不同质量分数葡萄多酚对抗氧化剂羟自由基清除率的影响。由图可见,复合抗氧化剂羟自由基清除率随着葡萄多酚质量分数的增加先增大后减小,当葡萄多酚质量分数为0.004%时,复合抗氧化剂的清除能力达到最大,接着随着葡萄多酚质量分数的增加开始减小。
综合以上测定结果得出,葡萄多酚质量分数为0.004%时复合抗氧化剂的抗氧化能力最强,故试验确定葡萄多酚质量分数为0.004%为最佳单因素质量分数。
2.2.4 复合抗氧化剂配比优化正交试验 葡萄多酚与其他抗氧化剂、增效剂进行复配后所具有的抗氧化性并不只是几种物质抗氧化性的简单叠加,各种物质共同存在时具有协同增效作用,也能够加强抗氧化性[21]。所以必须将不同抗氧化剂之间的交互作用考虑到优化正交试验中。本试验需要考虑3个2水平因素和3个交互作用,故采用L8(27)正交设计试验方案进行。因素水平见表2。方差分析见表3~5。
为了避免极差分析法不能区分数据波动是由试验误差还是试验条件改变引起的,以及无法精确的估计各因素对试验结果的影响大小的缺陷,可采用方差分析得到最优配比组合。

图5 葡萄多酚质量分数的抗氧化能力Fig.5 Antioxidant capacity of grape polyphenol

因素Factorsw(维生素C)(A)/%VitaminC(A)w(葡萄多酚)(B)/%Grapepolyphenols(B)w(柠檬酸)(C)/%Citricacid(C)10.120.0050.0620.100.0040.05

表3 铁氰化钾还原力方差分析Table 3 Analysis of variance of potassium ferricyanide feduction
注:*表示差异显著(P<0.05),下同。
Note:* represent significant differences(P<0.05),the same below.

表4 DPPH·清除率方差分析Table 4 Analysis of variance of DPPH· scavenging activity
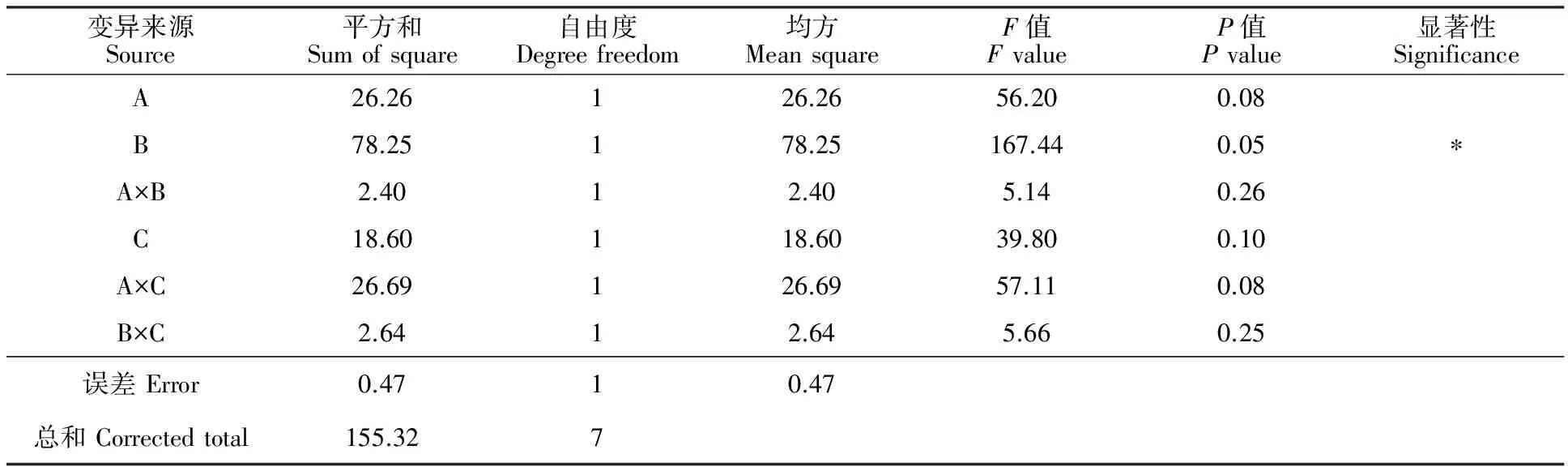
表5 羟自由基清除率方差分析Table 5 Analysis of variance of hydroxyl radical scavenging activity
综合以上3个方差分析表,影响复合抗氧化剂抗氧化性因素的主次顺序为B>A>C,即葡萄多酚对抗氧化强度影响最大,其次为维生素C,柠檬酸影响较小,结合极差分析得出,B2为B因素最优水平,A2为A因素最优水平,C因素2个水平都可以,根据极差分析可选择C2为优水平。故最佳组合最终确定为B2A2C2。
2.3 复合抗氧化剂抗氧化性的研究
2.3.1 复合抗氧化剂的抑菌作用 复合抗氧化剂对3种细菌抑菌圈直径的影响如图6所示。随着复合抗氧化剂质量分数的增加,对3种细菌的抑制效果也在增加,当复合抗氧化剂质量浓度为2.0~2.5 mg·mL-1时,对3种致病菌的抑制作用由大到小依次是沙门氏杆菌、金黄色葡萄球菌、大肠杆菌;当复合抗氧化剂质量浓度大于2.5 mg·mL-1时,复合抗氧化剂对沙门氏杆菌的抑制作用增长缓慢,逐渐弱于金黄色葡萄球菌和大肠杆菌受到的抑制作用。
2.3.2 复合抗氧化剂与葡萄多酚抑菌作用比较 图7显示,配制质量浓度均为3 mg·mL-1的复合抗氧化剂和葡萄多酚溶液,比较两者的抑菌效果,由图看出,葡萄多酚和复合抗氧化剂对3种

图6 复合抗氧化剂对3种细菌抑菌圈直径的影响Fig.6 Effect of antibacterial diameter of multipleantioxidants on three bacteria
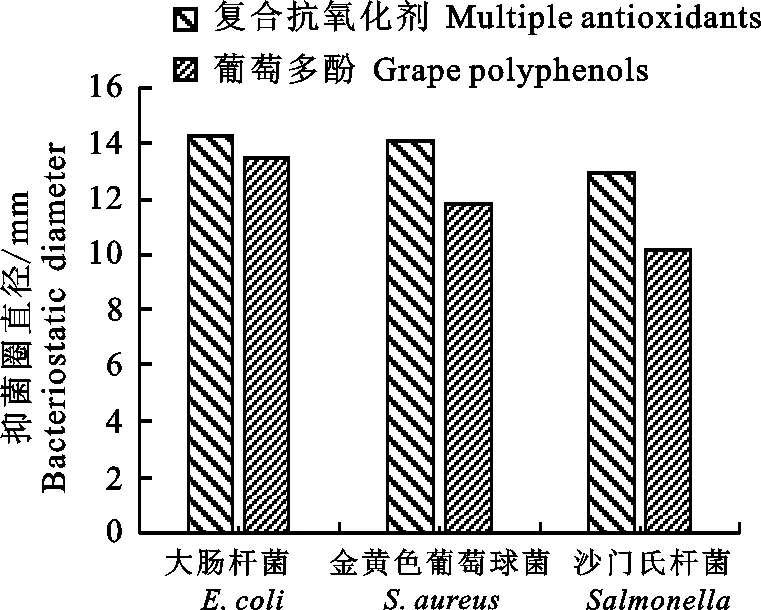
图7 葡萄多酚与复合抗氧化剂的抑菌效果对比Fig.7 Antimicrobial efficacies comparison of multipleantioxidants and grape polyphenols
致病菌的抑制效果都很显著,葡萄多酚与复合抗氧化剂的抑制强度一致,但单一葡萄多酚的抑制效果弱于复合抗氧化剂。
3 讨论与结论
多酚物质由于具有特殊的化学结构而具有一定的生物活性,并且在抗氧化、抗肿瘤、抗突变、抗癌变等方面具有很显著的效果,作为一种食品添加剂被广泛应用在食品及医药领域[22]。在植物多酚中葡萄多酚的抗氧化能力表现的最强[23], 葡萄中多酚类物质是植物多酚类物质的一种,广泛存在于葡萄果汁、葡萄皮渣和葡萄籽中。中国是葡萄生产大国,葡萄种植面积达几十万公顷,其中40%以上用于酿酒,其中葡萄皮渣和枝条浪费严重。葡萄多酚在葡萄皮渣和葡萄籽中质量分数很高,红葡萄皮渣中葡萄多酚质量分数可以达到25%~50%,对葡萄皮渣的利用在不断深入[24]。本试验本着对葡萄废弃物的高附加值利用的原则进行研究,试验测出葡萄皮渣中总酚、总黄烷醇、总类黄酮、原花青素、单宁的质量分数分别为7.113 6、1.650 2、1.288 5、0.825 3、0.068 97 mg·g-1。葡萄皮渣中多酚质量分数较高,具有很广阔的开发利用前景。皮渣可作为提取酒石酸、葡萄籽油、膳食纤维等的原料,有关葡萄皮渣的综合利用有待进一步研究。
近年对葡萄多酚的研究很多,对于抗氧化能力的测定方法也有很多种,一般选择2种以上抗氧化方法对物质进行抗氧化能力评价。一般根据氢原子转移和电子转移的不同可将抗氧化方法分为2大类:根据氢原子转移机制的方法包括羟自由基清除率、脂质过氧化法等;根据电子转移机制的方法包括DPPH·清除力、铁离子还原力、ABTS清除力等方法[25]。但是一般脂质过氧化法反应时间比较长,因此不常被采用。在进行抗氧化检测时,使用一种方法往往代表性不强,不能很全面地反应物质的抗氧化能力。本试验采用DPPH·清除率、羟自由基清除率和铁氰化钾还原力3种方法对抗氧化性进行检测。
很多研究发现单一活性成分的抗养化性比复合抗氧化剂的抗氧化性低,一些抗氧化剂经过复合后能够有很高的抗氧化性并且这些复合抗氧化剂的抗氧化性并不是几种抗氧化剂直接单纯的相加,而是比相加抗氧化性强。一般认为多种抗氧化剂之间的协同作用原理可分为2种:一种可能是由于抗化剂对各个氧系统的位置;另一种为多种抗氧剂的不同作用机制之间存在明显的互补作用,通过这种作用来消除自由基和单态氧,隔活性氧和它的特意作用部位,使氧化酶或者促氧化活性改变,并且维持和提供还原剂的水平,参与损伤分子的修复或者替代,进而起到协同作用。抗氧化物与维生素、有机酸之间的协同作用已经有很多报道,其中与维生素C、维生素E之间的协同作用研究最多。严奉伟等[26]利用菜籽多酚与维生素C进行复配后将其加入到棉籽油中,发现其在棉籽油中的协同增效非常明显。抗氧化物与有机酸也有很好的协同增效作用[27]。本试验通过葡萄多酚与维生素、柠檬酸进行复配得出抗氧化性更强的复合抗氧化剂,复合抗氧化剂的最佳配比即质量分数为0.1%维生素C、质量分数为0.004%葡萄多酚及质量分数为0.05%柠檬酸,也发现复合抗氧化剂对金黄色葡萄球菌、大肠杆菌、沙门氏杆菌均有抑制作用,并且随着复合抗氧化剂质量分数的增加,对3种细菌的抑菌强度不断增大,对金黄色葡萄球菌和大肠杆菌的抑制作用越来越强,对沙门氏杆菌的抑制作用的强度变得较为缓慢;在质量分数相同的条件下,复合抗氧化剂对3种细菌的抑制作用均高于葡萄多酚。葡萄多酚的复配研究为葡萄废弃物中多酚类物质的开发利用提供理论依据,为葡萄多酚的抗氧化性被更好地应用到医药、日化、保健等领域提供理论基础,与葡萄多酚复配相关的其他问题有待进一步研究。
Reference:
[1] KANNER J,FRANKEL E,GRANIT R,etal.Natural antioxidants in grapes and wines[J].JournalofAgriculturalandFoodChemistry,1994,42(1):64-69.
[2] 周 俊,石雪晖,秦 丹,等,湖南刺葡萄酿酒试验研究[J].中外葡萄与葡萄酒,2008(3):14-16,20.
ZHOU J,SHI X H,QIN D,etal.Study on the wine making with grapes of V.davidii Foex in Hunan[J].Sino-OverseasGrapevine&Wine,2008(3):14-16,20.
[3] GORINSTEIN S,CASPI A,LIBMAN I,etal.Red grapefruit positively influences serum triglyceride level in patients suffering from coronary atherosclerosis:Studies in vitro and in humans [J].JournalofAgriculturalandFoodChemistry,2006,54(5):1887-1892.
[4] JEONG Y S,HONG J H,CHO K H.Grape skin extract reduces adipogenesis and lipogenesis-related gene expression in 3T3-L1 adipocytes through the peroxisome proliferator-activated receptor-gamma signaling pathway[J].NutritionResearch,2012,32(7):514-521.
[5] SNCHEZ-ALONSO I,JIMNEZ-ESCRIG A,SAURA-CALIXTO F,etal.Antioxidant protection of white grape pomace on restructured fish products during frozen storage[J].Lwt-FoodScienceandTechnology,2008,41(1):42,50.
[6] 张秀玲,祝义伟,孙佳平.酿酒后的葡萄渣的综合利用[J].食品工业科技,2008,29(7):284-285,288.
ZHANG X L,ZHU Y W,SUN J P.Comprehensive utilization of pomace after grape brewing[J].ScienceandTechnologyofFoodIndustry,2008,29(7):284-285,288.
[7] 刘 芸,仇农学,杨玺玉.葡萄皮渣提取物总酚含量及体外抗氧化活性、抑菌活性[J].食品科学,2011,32(1):5-9.
LIU Y,QIU N X,YANG X Y.Assessment of total phenolic content and in vitro antioxidant and antimicrobial activities of ethanol extract from grape residue left after making wine[J].FoodScience,2011,32(1):5-9.
[8] 叶新红,李永春,胡彩香,等.不同处理对葡萄皮中多酚类化合物溶出效果的研究[J].新疆农业科学,2009,46(4):877-880.
YE X H,LI Y CH,HU C X.etal.Study on the dissolution effect of different treatment on polyphenols from skin of grape[J].XinjiangAgriculturalSciences,2009,46(4):877-880.
[9] JAYAPRAKASHA G K,SINGH R P,SAKARIAH K K.Antioxidant activity of grape seed (VitisviniferaL.) extracts on peroxidation models in vitro[J].FoodChemistry,2001,73(3):285-290.
[10] PEINADO J,DE LERMA N L,MORENO J,etal.Antioxidant activity of different phenolics fractions isolated in must from Pedro Ximenez grapes at different stages of the off-vine drying process[J].FoodChemistry,2009,114(3):1050-1055.
[11] LI Y G,TANNER G,LARKIN P.The DMACA-HCl protocol and the threshold proanthocyanidin content for bloat safety in forage legumes[J].JournaloftheScienceofFoodandAgriculture,1996,70(1):89-101.
[12] 王 华.葡萄与葡萄酒实验技术操作规范[M].西安:西安地图出版社,1999.
WANG H.Technical Specification for Grape and Wine Experimentation[M].Xi’an:Xi’an Map Publishing House,1999.
[13] GODOY S,MARLENE R,KATHERINA F.Influence of the structure and composition of the País grape proanthocyanidins on the inhibition of angiotensin I-converting enzyme (ACE)[J].FoodChemistry,2012,134(1):346-350.
[14] 王丽媛,苗利利,仇农学.苹果渣中高纯度多酚物质的制备及体外抗氧化活性评价[J].农产品加工(学刊),2009,3(3):29-33.
WANG L Y,MIAO L L,QIU N X.Purification and invitro antioxidative effects of polyphenols in apple pomace[J].AcademicPeriodicalofFarmProductsProcessing,2009,3(3):29-33 .
[15] 李 华,王蔚新,袁春龙.葡萄籽多酚提取物的提取工艺研究[J].食品研究与开发,2005,26(6):69-72.
LI H,WANG W X,YUAN CH L.Research on extract technology of grape seed polyphenol extract[J].FoodResearchandDevelopment,2005,26(6):69-72.
[16] 高 园,房玉林,张 昂,等.葡萄枝条中多酚类物质的超声波辅助提取[J].西北农林科技大学学报(自然科学版),2009,37(9):77-82.
GAO Y ,FANG Y L,ZHANG A,etal.Study on the extraction of polyphenol from grapevine branch by ultrasonic adjunct extraction method [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2009,37(9):77-82.
[17] 韩 林,黄玉林,张海德,等.槟榔籽中抗氧化成分的提取及活性研究[J].食品与发酵工业,2009,35(9):157-163.
HAN L,HUANG Y L,ZHANG H D,etal.Study on the extraction of antioxidant components from betelnut seed and evaluation of their activitie[J].FoodandFermentationIndustries,2009,35(9):157-163.
[18] 郎 娜,罗红霞.黄花菜中黄酮类物质抗氧化性的研究[J].食品研究与开发,2007,28(3):74-77.
LANG N,LUO H X.Study for the activity of flavonoid in hemerocallia fulva[J].FoodResearchandDevelopment,2007,28(3):74-77.
[19] PHOENCY L,KEN Y L,SHIN L,etal.Phytochemicals and antioxidant properties of solvent extracts from Japonica rice bran[J].FoodChemistry,2009,117(3):538-544.
[20] 阮 征,邓泽元,严奉伟,等.菜籽多酚和Vc在化学模拟体系中清除超氧阴离子和羟自由基的能力[J].核农学报,2007,21(6):602-605.
RUAN ZH,DENG Z Y,YAN F W,etal.Hydroxyl radical and superoxide radical scavenging activities of polyphenol from rape seed and vitamin C in modified chemical systems[J].JournalofNuclearAgriculturalSciences,2007,21(6):602-605.
[21] 王 莹.茶多酚的抗氧化和抑菌活性及其增效剂[J].生物学杂志,2007,24(5):54-56.
WANG Y.The anti-oxidation and anti-microbial activities of tea polyphenols and its in creased reagents[J].JournalofBiology,2007,24(5):54-56.
[22] 郭新竹,宁正祥.天然酚类化合物及其保健作用[J].食品工业,2002,23(3):28-29.
GUO X ZH,NING ZH X.The antioxidation of natural polyphenol and its health care function[J].TheFoodIndustry,2002,23(3):28-29.
[23] 吕丽爽,曹 栋.脱脂葡萄籽中低聚原花青素的提取[J].无锡轻工大学学报,2001,20(2):208-210.
LÜ L SH,CAO D.Separation of oligomeric proanthocyanidins from defatted grape seeds[J].JournalofWuxiUniversityofLightIndustry,2001,20(2):208-210 .
[24] 吕振岳,王庆华.白藜芦醇的研究进展[J].食品研究与开发,2003,24(1):25-26.
LÜ ZH Y,WANG Q H.Advances in study on resveratrol[J].FoodResearchandDevelopment,2003,24(1):25-26.
[25] 王晓宇.葡萄酒抗氧化活性及其检测方法的研究[D].陕西杨凌:西北农林科技大学,2008.
WANG X Y.Study on the antioxidant activity and methods of detection in wine[D].Yangling Shaanxi:Northwest A&F University,2008.
[26] 严奉伟,吴媛瑾,张 欣.菜籽多酚与VC在棉籽油中的抗氧化效果与协同增效作用[J].食品研究与开发,2009,30(8):11-14.
YAN F W,WU Y J,ZHANG X.Antioxidantive and synergistic effects of rapeseed polyphenol and vitamin C on cottonseed oil[J].FoodResearchandDevelopment,2009,30(8):11-14.
[27] 罗伟强.胡椒提取物抗氧化性能的研究[J].粮油加工与食品机械,2002(4):36-37.
LUO W Q.Studies of the pepper extract antioxidant properties[J].MachineryforCerealsOilandFoodProcessing,2002(4):36-37.

