血清胃蛋白酶原联合胃泌素-17对胃癌筛查的价值研究
胡鹏 ,朱长才,汪薇 ,黄萍
(1.武汉科技大学医学院,武汉 湖北 430081;2.武汉市红十字会医院检验科,武汉 湖北 430015;3.解放军武汉总医院检验科,武汉 湖北 430070)
胃癌是常见消化道恶性肿瘤,病死率占恶性肿瘤第3位[1]。早期胃癌患者经合理治疗后5年生存率>90%[2],但胃癌进展期患者经治疗后的5年生存率只有约30%[3],所以胃癌的早期诊断对患者的治疗尤为关键。目前我国早期胃癌的平均检出率<10%[4],由于胃癌早期多无明显特征性临床表现,所以多数胃癌确诊时已为进展期。目前临床公认的诊断胃癌的金标准为胃镜联合病理学检查,但由于其属侵入性检查且费用较高,会给患者带来生理和心理上的压力,难以用于大面积筛查。因此血清学肿瘤标志物:胃蛋白酶原Ⅰ(pepsinogenⅠ,PGⅠ)、胃蛋白酶原Ⅱ(pepsinogenⅡ,PGⅡ)、胃蛋白酶原Ⅰ/Ⅱ比值(pepsinogen ratio,PGR)、胃泌素-17(gast rin-17,G-17)成为胃癌筛查的研究热点。本研究就上述各项指标进行回顾性分析,现报道如下。
1 资料与方法
1.1 临床材料 收集武汉市红十字会2016年1月~2017年1月患者资料87例,临床资料见表1。

表1 患者临床资料
1.2 排除及入选标准 无严重心脑血管疾病等胃镜检查禁忌证;近1个月未使用抗生素、抑酸剂、非甾体抗炎药、胃黏膜保护剂。排除合并全身其他系统及器官恶性肿瘤、排除严重肝肾功能不全。所有病例均经由胃镜及活检病理组织学检查确诊,分为3组:胃癌组、良性胃病组(包含浅表胃炎、十二指肠溃疡等良性胃病)、正常对照组。
1.3 方法
1.3.1 胃镜检查 按固定部位活检组织2~5块做病理组织学诊断,标本要求达到黏膜肌层。
1.3.2 血清PGⅠ、PGⅡ、PGR(PGⅠ/PGⅡ)、G-17测定 清晨空腹采集受试者静脉血3ml,迅速分离血清后于-20℃冰箱中冷冻待测。PGⅠ、PGⅡ、G-17均采用芬兰Biohit公司酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒,严格按照说明书操作。使用CHROMATE酶标仪对检测结果进行定量分析。PGR为PGⅠ与PGⅡ的比值。
1.4 灵敏度、特异度、准确度计算方法 灵敏度=真阳性数/筛检人数×100%;特异度=真阴性数/筛检人数×100%;准确率=(真阳性数+真阴性数)/筛检人数×100%。
1.5 统计学方法 采用SPSS 19.0软件进行数据统计、分析。以Kolmogorov-Smirnov检验测定变量的分布。计量资料呈偏态分布,用中位数(M)和四分位数(P25~P75)表示。两组间比较采用Mann-Whitney U检验。采用受试者工作曲线(receriver operating characteristics,ROC)计算每个变量的曲线下面积(area under the curve,AUC)、诊断临界值、诊断敏感度和特异度。P<0.05为差异有统计学意义。
2 结果
2.1 3组之间血清PGⅠ、PGⅡ、PGR、G-17水平比较 胃癌组PGⅠ、PGR、G-17与良性胃病组、正常对照组比较,差异有统计学意义(P<0.05);而胃癌组PGⅡ与良性胃病组、正常对照组比较,差异无统计学意义,见表2。

表2 胃癌组、良性胃病组、正常对照组血清PGⅠ、PGⅡ、PGR、G-17水平比较M(P25~P75)
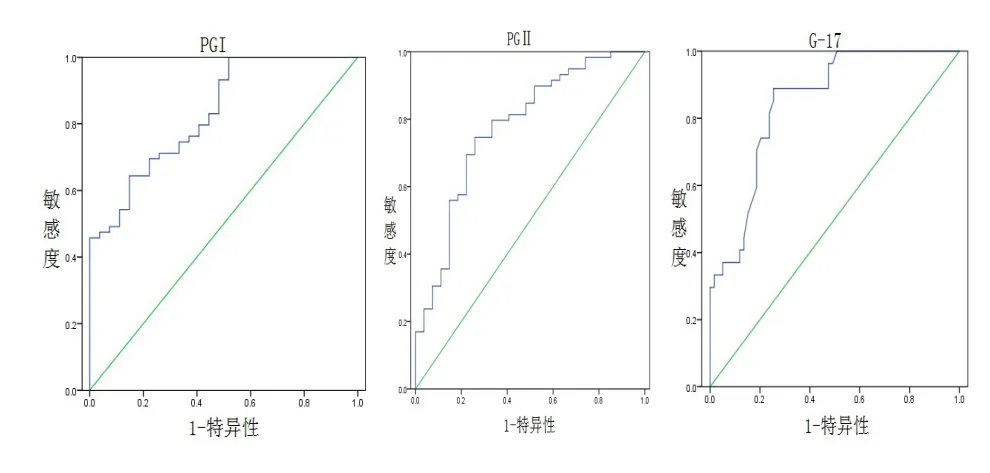
图1 血清PGⅠ、PGR、G-17 ROC曲线
2.2 血清PGⅠ、PGR、G-17在胃癌中的诊断价值评估 因胃癌组PGⅡ与良性胃病组、正常对照组比较差异无统计学意义,所以将PGⅠ、PGR、G-17水平做ROC曲线。ROC曲线显示PGⅠ诊断胃癌的曲线下面积为(0.831±0.045),最佳临界值为86.95μg/L、敏感度为0.644、特异性为0.852;PGR曲线下面积为(0.776±0.055),最佳临界值为5.80、敏感度为0.746、特异性为 0.741;G-17曲线下面积为(0.847±0.041),最佳临界值为8.15 pmol/L、敏感度为0.889、特异性为0.746,见表2,表3。
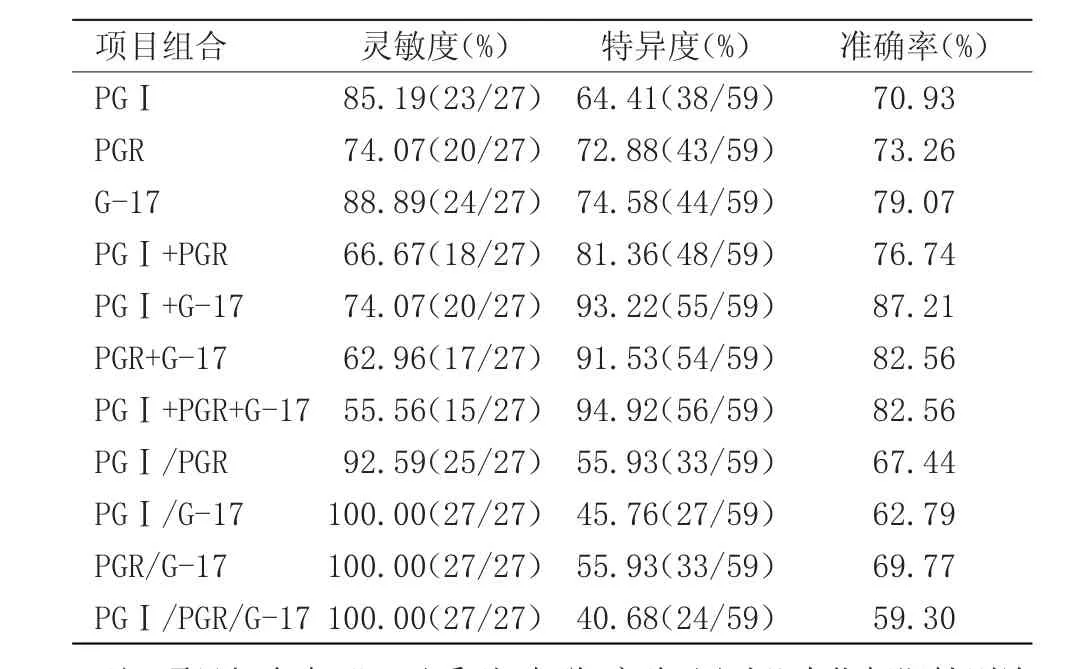
表3 血清PGⅠ、PGR、G-17单项及联检对肝癌的诊断价值比较
3 讨论
胃蛋白酶原(pepsinogen,PG)是胃蛋白酶的前体,根据免疫原性将其分成PGⅠ和PGⅡ两种亚型。PGⅠ主要由胃底的主细胞和颈黏液细胞分泌,PGⅡ除此之外还由贲门腺、胃窦幽门腺和十二指肠Brunner腺分泌。PG大部分进入胃腔,在酸性胃液作用下活化成胃蛋白酶,仅约1%透过胃黏膜毛细血管进入血液循环。血清PGⅠ、PGⅡ、PGR是胃黏膜状态的指标,对胃黏膜的损伤较敏感[5],可反映胃黏膜腺体和细胞的数量,也间接反映胃黏膜不同部位的分泌功能和病变严重程度,是筛查胃癌的参考指标[6-7]。
G-17主要由胃窦部G细胞合成和分泌,它通过激活ECL细胞刺激胃酸分泌,从而释放组织胺并刺激胃肠道上皮细胞增殖。随着研究的进一步深入,G-17被发现与胃癌的浸润及转移密切相关[8-9],同时G-17的水平升高还与胃底和胃体癌的形成与发展有关。研究还指出萎缩性胃炎伴随的高胃泌素状态对胃黏膜癌变有促进作用[10]。
本研究结果显示,胃癌组相对良性胃病组、正常对照组,PGⅠ、PGR明显降低(P<0.05),G-17明显升高(P<0.05),同时通过ROC曲线分析,PGⅠ、PGR、G-17曲线下面积分别为0.831、0.776、0.847,证实了以上各项指标在胃癌筛查方面的有效作用。同时,本研究提出了本院最佳诊断临界值分别为:PGⅠ86.95μg/L、PGR 5.80、G17 8.15 pmol/L。依据最佳临界值,单项指标中G-17的特异度和特异度最高为88.89%和74.58%。
每一种血清学标志物在诊断上均有其自身的价值,也会有一定的局限性。多种血清标志物的联合检测可相互弥补单一检测的不足,从而提高胃癌筛查的效能。本研究探讨了PGⅠ、PGR、G-17之间联合检测对胃癌筛查的筛查价值。串联实验可以提高特异性,PGⅠ+PGR+G-17检测后特异度高达94.92%,故可认为三项联合检测是一个有效的用于判断胃癌病情的血清学指标。PGⅠ、PGR、G-17联合平行实验中PGⅠ/G-17、PGR/G-17、PGⅠ/PGR/G-17灵敏度可高达100%,可作为排除胃癌或者筛查胃癌较好的组合标志物。
总体而言,本研究表明PGⅠ、PGR、G-17是胃癌筛查的有效血清学标志物,联合检测对胃癌检测的诊断有较高价值,可作为胃镜病理学检查的有效补充,是可疑患者、健康体检的有效筛查或排除胃癌的检测项目。但为排除在研究方法、试剂使用、患者个体差异情况及区域群体差异[11-13]等情况,仍需要进一步临床大数据佐证。
[1] Wong RK,Jang R,Dar ling G.Postoperative chemoradio-therapy vs.preoperative chemoradiotherapy for local ly ad-vanced(operable)gast ric cancer:Clarifying the role and technique of radiotherapy[J].J Gast rointest Oncol,2015,6(1):89-107.
[2] Isobe Y,Nashimoto A,Akazawa K,et al.Gast ric cancer t reatment in Japan:2008 annual repor t of the JGCA na-tionwide regist ry[J].Gast ric Cancer,2011,14(4):301-316.
[3] Ajani JA,Bent rem DJ,Besh S,et al.Gast ric cancer,ver-sion 2.2013: Featured updates to the NCCN Guidelines[J].J Nat l Compr Canc Netw,2013,11(5):531-546.
[4] 中华医学会消化内镜学分会.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)[J].中华消化杂志,2014,34(7):433-448.
[5] 陈美珍,张民乐,岑国祯.血清胃蛋白酶原含量测定在胃疾病中的应用价值[J].当代医学,2012,18(33):34-35.
[6] 张卫东,孙晓,牛爱军.血清胃蛋白酶原检测在胃部疾病应用价值[J].医学检验与临床,2013,24(4):12-14.
[7] 黄语嫣,陈卫昌,高楠,等.血清胃蛋白酶原I、Ⅱ在胃癌及癌前病变诊断中的价值[J].中华内科杂志,2013,52(4):332-333.
[8] Kim YM,Kim IM,Nam TJ.Capsosiphon fulvescens glycoprotein reduces AGS gast ric cancer cel l mingration by downregulating t ransforming groth factor-β 1 and integrin expression[J].Int J Oncol,2013,43(4):1059-1065.
[9] Misha P, Senthivnayagam S, Rangasamy V, et al.Mixedlineage kinase-3/JNKL axispromotes migration of humangast ric cancer cel ls fol lowing gastrin stimulation[J].Molen docrinol,2010,24(3):598-607.
[10]Kikuchi R,Abe Y,Ii jima k,et al.Low serum levels of pepsinogen and gastrin 17 are predictive of extensive gas-t ric at rophy with high-risk of ear ly gast ric cancer[J].To-hoku J Exp Med,2011,223(1):35-44.
[11]李海英,左灿,王艳兰,等.长沙地区健康成年居民胃蛋白酶原参考范围的建立[J].国际检验医学杂志,2014,35(12):1575-1579.
[12]程清.血清胃蛋白酶原对胃癌早期诊断的意义[J].现代检验医学杂志,2013,28(1):67-69.
[13]孙涛,袁媛,李兆申.早期胃癌非创伤性检查进展与现状[J].中国实用内科杂志,2014,34(4):421-427.

