微波消融结合椎板减压内固定术治疗脊柱转移瘤
李鹏飞,刘剑锋
(内蒙古自治区人民医院脊柱外科,内蒙古 呼和浩特 010017)
脊柱是恶性肿瘤最常见的转移部位,特别是对于乳腺癌、肺癌、前列腺癌、胃肠道肿瘤、甲状腺癌患者[1]。在恶性肿瘤死亡患者解剖研究中发现,90%的病例有脊柱转移,多达20%的患者脊柱出现的临床症状是恶性肿瘤的第一个表现。在脊柱转移瘤患者中10%的有临床症状患者可以进行外科治疗[2],在脊柱转移瘤中,70%的位置是在胸椎或胸腰段,20%发生在腰椎和骶椎,颈椎的发生率较低[3]。自2013年3月至2015年5月,我院脊柱外科开展了20例微波消融结合椎板减压内固定治疗脊柱转移瘤手术,现报告如下。
1 资料与方法
李鹏飞,刘剑锋.微波消融结合椎板减压内固定术治疗脊柱转移瘤[J].实用骨科杂志,2018,24(2):159-162.
1.1 一般资料 2013年3月至2015年5月,内蒙古自治区人民医院脊柱外科开展微波消融治疗脊柱转移瘤20例,其中男12例,女8例;年龄43~72岁,平均62.5岁。其中原发肿瘤肺癌2例,肝癌1例,肾癌6例,结肠癌2例,食道癌1例,甲状腺癌4例,前列腺癌4例。转移节段为转移单发、孤立,其中T42例,T61例,T71例,T82例,T102例,T113例,L14例,L22例,L32例,L41例。术前给予全身骨扫描、脊柱MRI、正电子发射计算机断层显像(positron emission tomography-computer tomography,PET-CT)进行诊断,使用Tomita评分进行脊柱肿瘤评估,2~3分4例,4~5分9例,6~7分7例。神经功能使用Frinkle评分,E级8例,D级7例,C级5例。所有患者均行微波消融结合椎板减压内固定,其中11例患者行原发肿瘤切除术,2例肾癌及2例结肠癌患者为同期腹腔镜下切除原发肿瘤。
1.2 手术方法 全麻平稳后,患者俯卧于手术床上,术区碘酒消毒、铺巾,取病椎上下2~3节段,暴露,切开皮肤、皮下组织,将两侧竖脊肌由棘突、椎板、关节突上分离,上下2~3节段椎弓根置入椎弓根钉,病椎上下范围用顺铂盐水纱布保护创面。病椎去除棘突、全椎板及相邻椎体部分棘突及椎板,充分暴露脊髓,给予病椎双侧椎弓根锥钻孔,必要时丝锥扩大。安装微波针及测温针,一侧椎弓根置入微波针到椎体1/3处,一侧椎弓根置入测温针,另一根测温针由脊髓侧方置入椎管前缘,后纵韧带后方,消融针开始做功后,不断使用冰盐水给予脊髓降温,消融功率50 W,中心温度80~100℃,术中监测椎管内温度为42℃,椎体前缘温度不超过50℃,单点合并消融时间不少于10 min。每次消融达到控制温度后停止操作,待组织冷却后继续消融,双侧椎弓根交替给予微波消融。待消融完毕后,安装连接棒,留置引流,缝合韧带、皮下组织及皮肤,皮下给予罗哌卡因局部浸润结合镇痛泵镇痛。
1.3 术后处理 术后卧床3~5 d,待创口引流量少于50 mL/24 h后,拔除引流管,佩戴支具下床活动,佩戴支具3~6个月。待术后7~12 d创口稳定后,转入肿瘤内科治疗原发肿瘤,术后3、6、12、18个月门诊复查X线片、CT或MRI。
1.4 统计学分析 使用SPSS 13.0软件进行统计学分析,术前及术后2周疼痛情况使用视觉模拟评分(visual analogue scale,VAS)评定,采用配对样本t检验,P<0.05为差异有统计学意义。
2 结 果
本组手术时间180~270 min,平均220 min;术中出血330~650 mL,平均出血量456 mL;术后引流量450~800 mL,平均650 mL。术后出现1例食道破裂,2例下肢深静脉血栓。术后随访13~36个月,平均23.3个月。8例患者因为肿瘤晚期合并其他并发症死亡;原位肿瘤复发6例,占总患者数30%,其他脊柱节段复发(包括原位复发)10例,占总患者数50%。术前及术后2周疼痛评分使用VAS评定,术前(8.65±1.02)分,术后2周降至(2.38±1.07)分,差异有统计学意义(P<0.001),神经功能使用Frinkle评分,术前及术后3个月复查所有患者Frinkle评分D级及C级均改善1~2级。
典型病例为一63岁男性患者,于2014年3月因“双下肢麻木乏力1个月”住院,完善相关检查后诊断为肾癌T9转移、胸脊髓损伤、双下肢不全瘫,给予行“T7、T8、T10、T11椎弓根内固定,T9全椎板减压微波消融术,同期腹腔镜下左肾切除术”,患者1个月后双下肢肌力由术前Ⅰ级恢复到Ⅳ级,可以下床活动,2017年3月因肿瘤晚期并发症死亡,死亡前患者双下肢肌力为Ⅴ级,手术前后影像学资料见图1~7。
3 讨 论
对于脊柱转移瘤,手术治疗的目标是控制局部脊柱肿瘤,减轻患者疼痛和临床症状,提高脊柱转移瘤患者的生存期和生活质量。脊柱转移瘤的手术适应证包括脊柱不稳定、椎体塌陷有或没有任何神经症状、放射治疗无效肿瘤,保守治疗无法缓解的疼痛[4]。脊柱转移瘤一般的手术原则是减轻肿瘤对脊髓的压迫,重建脊柱的稳定性,降低患者死亡率。脊柱转移瘤常见的手术方式包括姑息性手术,椎管减压结合后路内固定,病椎经皮椎体成形术或经皮椎体后凸成形术,全脊椎切除结合前、后路固定。全脊椎切除是对脊柱肿瘤的广泛切除,是国际上公认的最佳手术方式[5],全脊椎切除手术难度较高,需要后方棘突椎板及椎弓根整体切除,前方椎体及部分椎弓根整体切除,手术难度大、创伤大、手术时间长、出血量多,在国内能够开展这种手术的医院较少。
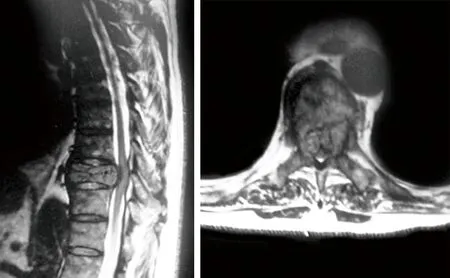
图1 术前MRI示T9转移瘤压迫脊髓

图2 术前腹部CT可见左肾肾门处肿物

图3 术后X线片示内固定在位,固定良好
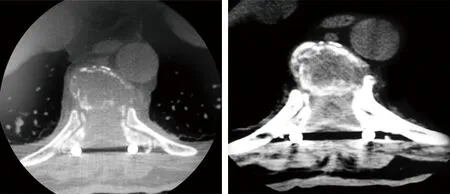
图4 术后3个月CT见T9肿物无增大 图5 术后6个月CT见T9肿物无增大,骨质有增加

图6 术后18个月MRI示肿瘤未复发 图7 术后36个月MRI显示腰椎肿瘤转移
2001年Tomita等[6]发表了一篇关于脊柱转移瘤外科策略治疗分类的文章,基于三个方面对患者进行评估:a)原发肿瘤的病理分级,原发于乳腺、甲状腺、前列腺等生长较慢的恶性肿瘤为1分;原发于肾脏、子宫等生长较快的恶性肿瘤为2分;原发于肺、肝、胃肠道等生长快的恶性肿瘤为4分。b)有无内脏转移重要器官(肺、肝脏、肾脏和大脑),无内脏转移为0分;有内脏转移灶,可以通过手术、介入等方法治疗为2分;有内脏转移灶不可以治疗为4分。c)骨转移包括脊柱转移单发或孤立脊柱转移灶为1分;多发骨转移为4分。Tomita认为,2~3分的患者,手术治疗选择全椎切除,这意味着边际或广泛切除;4~5分由边缘切除治疗或经瘤切除;6~7分建议接受姑息手术椎管减压和内固定;8分以上的患者被建议接受保守支持治疗,而不是手术治疗。Tomita报道,2~3分广泛切除术后平均生存38.2个月,4~5分行经瘤切除术后平均生存21.5个月,6~7分姑息减压手术平均生存10.1个月,8~10分的患者非手术治疗平均生存5.3个月。本组患者平均生存期现在已经接近4~5分组。
微波消融是指将1根特制微波针经皮穿刺到肿瘤中心区域,在微波针的某一点上含有1个1 mm大小的“微型微波炉”,由它释放的微波磁场可以使周围的分子高速旋转运动并摩擦升温,从而使组织凝固、脱水坏死,达到治疗目的。与全脊椎切除相比较,微波消融技术操作简单,结合胸腰椎椎弓根螺钉固定技术,可以对脊柱转移瘤进行手术,手术出血少、时间短,术后可以大大降低肿瘤原位复发率,提高患者生活质量及生存期[7]。微波消融术可以减小肿瘤体积,减少肿瘤术中出血,在手术中可以观察到,在消融中随着肿瘤颜色逐渐出现碳化改变,肿瘤局部渗血逐渐减少。
全脊椎手术切除适合Tomita评分2~3分的患者,而微波消融术适合6~7分的患者,适应证较全脊椎切除术广阔,在本组患者选择中Tomita评分有16例在4分以上,不适合全脊椎切除手术,所以选择姑息性手术治疗。Pusceddu等[8]报道微波消融术可以将骨转移瘤复发率由26%~67%降到6%。微波消融术适合患者范围为Tomita评分6~7分及以下患者,手术方式为姑息减压手术结合微波消融。转移节段建议为少发孤立转移,如果转移节段为多发跳跃转移,单节段的肿瘤治疗没有手术意义,内固定也容易失败,这一点在临床上大多数脊柱转移瘤患者不能满足。术中要求对脊髓降温,保证脊髓周围温度保持在42℃,所以术式要求必须进行全椎板减压,术中给予冰盐水不断冲洗,保证脊髓充分降温,而不能像在一些器官肿瘤中进行经皮微创微波消融。本组患者中有1例甲状腺癌T4转移患者在消融术后出现食道破裂,给予置入胃管鼻饲,术后13个月死亡,所以在术前分析时需要注意脊柱转移瘤局部侵犯问题,如果肿瘤与食道或大血管黏连,对肿瘤进行消融可能出现食道或大血管损伤。在消融术中,往往因为病灶消融温度没有达到要求,而神经周围温度已经达到42℃,进而被迫停止消融工作,累计单点消融时间不足,可能是术后原位复发的原因之一。脊柱转移瘤术后复发或其他节段转移的主要原因是原发肿瘤的控制较差导致的。Leong等[9]认为在肿瘤患者术前的检查中,包括MRI、全身骨扫描、PET-CT并不能发现血液或者骨髓中的微转移灶,而这些微转移灶经过血液的传播能够发展成为新的肿瘤病灶。国内学者[10]也认为转移癌的癌细胞可能定植于多个部位,是一个全身性疾病,脊柱转移瘤术后应该应用全身敏感药物治疗,包括化疗或其他肿瘤控制药物。所以,笔者认为对于脊柱转移瘤的治疗就像脊柱结核的治疗一样,手术治疗是一部分,术后全身治疗是脊柱转移瘤治疗的另一重要部分,关系到患者的生存期以及手术治疗的效果,包括脊柱转移瘤的复发率和其他节段的转移率。
[1]Bhatt AD,Schuler JC,Boakye M,et al.Current and emerging concepts in non-invasive and minimally invasive management of spine metastasis[J].Cancer Treat Rev,2013,39(2):142-152.
[2]Bilsky MH,Laufer I,Burch S.Shifting paradigms in the treatment of metastatic spine disease[J].Spine,2009,34(22):101-107.
[3]Lewandrowski KU,Anderson ME,McLain RF.Tumors of the Spine[M].Elsevier Saunders,2011:1480-1510.
[4]Davies AM,Cassar-Pullicino VN.Imaging of Bone Tumors and Tumor-like Lesions[M].Berlin Heidelberg:Springer,2009:111-137.
[5]Mert Ciftdemir,Murat Kaya,Esref Selcuk,et al.Tumors of the spine[J].World J Orthop,2016,7(2):109-116.
[6]Tomita K,Kawahara N,Kobayashi T,et al.Surgical strategy for spinal metastases[J].Spine,2001,26(8):298-306.
[7]陈秉耀,韦兴,史亚民,等,开放式微波消融结合减压内固定治疗椎体转移瘤的随访报告[J].中国骨与关节杂志,2016,3(5):346-350.
[8]Pusceddu C,Sotgia B,Fele RM,et al.Treatment of bone metastases with microwave thermal ablation[J].J Vasc Interv Radiol,2013,24(2):229-233.
[9]Leong SP,Tseng WW.Micrometastatic cancer cells in lymph nodes,bone marrow,and blood:Clinical significance and biologic implications[J].C A Cancer J Clin,2014,64(3):195.
[10]贺曦,韦峰,姜亮,等.脊柱转移癌全脊椎切除术后临床疗效分析[J].中国脊柱脊髓杂志,2016,26(5):421-427.

