内镜下肿瘤挖除术治疗固有肌层来源胃肿瘤的临床分析
陈佳园 黄智铭
近年来随着常规胃镜检查的普及,胃黏膜下肿瘤发病率越来越高[1]。部分黏膜下肿瘤存在恶变可能,尤其是来源于固有肌层的肿瘤[2]。胃间质瘤是其中最常见的类型,在新发病例中有10%~30%存在恶变可能[3-4]。消化道间质瘤可见于胃(50%~60%)、小肠(20%~40%)、结肠和回肠(5%~15%)[5]。随着内镜设备和内镜下手术的广泛使用和发展,内镜黏膜下剥离术已逐步发展为早期胃癌的治疗手段[6-7]。目前,内镜黏膜下肿瘤挖除术(endoscopic submucosal excavation,ESE)已用于黏膜下肿瘤的治疗。本院内镜中心近年来使用这项技术治疗固有肌层来源的胃黏膜下肿瘤(submucosal tumor,SMT)取得了良好的效果,现报道如下。
1 资料和方法
1.1 一般资料 2014年2月至2017年2月在本院行ESE治疗固有肌层来源的SMT 59例,其中男27例,女32例,年龄22~75岁,中位年龄57岁;临床表现为上腹痛13例,上腹部不适12例,腹胀3例,无临床症状31例;肿瘤位于胃底24例,胃体26例,胃窦5例,贲门4例;肿瘤大小 1.0~4.5(1.75±0.68)cm;所有肿瘤均来源于固有肌层,位于浅肌层49例,深肌层10例。入选标准:胃内SMT不伴溃疡;肿瘤的最大直径<5cm[21],超声内镜提示无恶性高风险,如边缘不规则,胞内空腔,或者异质性回声;无淋巴结侵犯或远处转移;血小板数量、凝血功能在正常范围内。
1.2 方法
1.2.1 术前准备 在ESE前,常规进行超声内镜检查,环扫超声内镜(日本奥林帕斯光学工业株式会社,UM 240)或12-fr导管探头(日本奥林帕斯光学工业株式会社,UM-3R,12MHz)用于检测 SMT 的大小、来源、内部回声、边缘和生长趋势。超声内镜能清晰显示固有肌层及浆膜层情况,本内镜中心常规以固有肌层全层厚度的1/2为界,定义肿瘤范围在内1/2的为浅肌层,在外1/2的为深肌层。腹部增强CT用于评估肿瘤周围的解剖结构和远处转移的可能性。在实施ESE前,患者签署知情同意书,告知患者可能发生的并发症,以及在严重并发症情况下需转为开腹手术。
1.2.2 ESE操作 所有ESE操作由同1位内镜医师完成。ESE操作过程中,采用标准单活检通道内镜(日本奥林帕斯光学工业株式会社,GIF-H260),内镜头端附加透明盖(D-201-11802)。其他设备包括:末梢绝缘手术刀(IT刀)(KD-610 L),Hook刀(KD-620LR),注射针(NM-4L-1),抓钳(FG-8U-1),圈套器(SD-230U-20),热活检钳(FD-410LR),止血夹(HX-610-90,HX-600-135),高频电凝发生器(德国爱尔博公司,ICC-20),APC300氩离子凝固器(德国爱尔博公司,APC300)。
所有患者行气管插管下全身麻醉,注射异丙酚维持。整个操作过程中,需监测患者的心率、血压和血氧饱和度。具体操作步骤如下:(1)确定目标病灶后,用氩离子探针在病灶边缘2mm做圆型标记;(2)取数毫升混合溶液(250ml甘油果糖,3ml的靛蓝胭脂红,2ml的1∶10000肾上腺素)于病灶边缘标记点进行黏膜下注射,抬起黏膜层。(3)用HOOK刀沿病灶边缘标记点环形切开病灶外侧黏膜;然后用末梢绝缘手术刀逐步切除。(4)用末梢绝缘手术刀分离病灶边缘的固有肌层,在切除过程中,可多次黏膜下注射混合液。最终使用末梢绝缘手术刀将整个病灶从固有肌层完整切除。(5)对于创面可见的小血管,应用氩粒子凝固术(argon plasma coagulation,APC)凝固治疗,预防延迟性出血。(6)如果在术中出血,可通过使用APC,热活检钳,钛夹进行内镜下止血。如果发生穿孔,钛夹可用于治疗穿孔。详见图1。

图1 E S E治疗来源于固有肌层的S M T(a:内镜下所见的S M T;b:CT显示的病灶;c:超声内镜显示的病灶;d:在病灶边缘做出环形标记;e:切除病灶;f:E S E完整切除病灶)
1.2.3 评价标准 整块切除定义为肿瘤完整切除,完全切除定义为整块切除伴切口边缘无肿瘤。穿孔的诊断依据为:肠系膜脂肪或腹腔可见。大出血定义为有临床症状,并且有输血的指征,或者因内镜下无法控制的出血而转为外科手术。操作时间是从在病灶周边标点起到内镜的退出。病理诊断:(1)病理学评价:切除的标本用10%的甲醛溶液固定后送病理检查;(2)免疫组化分析:平滑肌肌动蛋白(SMA),结蛋白,CD117(c-KIT),CD34,DOG1和S-100标志物进行肿瘤的分型。SMA反应阳性和表达结蛋白诊断为平滑肌瘤。CD117(c-KIT),CD34,DOG1阳性诊断为胃肠道间质瘤(GIST)。S-100阳性诊断为神经鞘瘤。根据国际卫生组织共识的风险分类,GIST潜在风险与肿瘤大小、有丝分裂指数相关[8-9]。病理诊断由2位有经验的病理医师下结论。
1.2.4 术后管理及随访 ESE术后常规禁食2d,使用质子泵抑制剂(PPI)和抗生素。如果有小穿孔发生,可予保守治疗,如胃肠减压,使用抗生素和PPI等,禁食时间应延长大约3~4d。术后1、3、6个月进行内镜随访。并进行腹部增强CT评估GIST是否有肝内或腹膜复发。
1.3 统计学处理 采用SPSS18.0统计软件。计数资料以百分率表示,比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 治疗结果 完成整块切除58例(98.3%)。1例因为肿瘤呈管腔内外生长方式,难以在内镜下操作,转为外科手术。ESE 操作时间 45~270(115.13±55.30)min。术后住院时间 3~15(5.67±2.05)d。
2.2 病理诊断 GIST 51例,平滑肌瘤7例,神经鞘瘤1例。根据国家综合癌症网络指南[10],51例GIST中,极低风险33例,低风险18例。
2.3 并发症 术中发生胃穿孔 7例,经钛夹封闭创面后,给予禁食、胃肠减压、使用PPI和抗生素等治疗,均获成功。在手术过程中或之后无一例出现气腹、大量出血、迟发性出血或腹腔感染。术后随访6~24个月,58例完整切除者创面愈合良好,腹部增强CT未见肿瘤复发及转移。
2.4 ESE并发胃穿孔的危险因素分析 见表1。
由表1可见,并发症的发生与肿瘤直径、病变深度、患者年龄有关(P<0.05或0.01),与性别、肿瘤位置、组织学诊断无关(均P>0.05)。
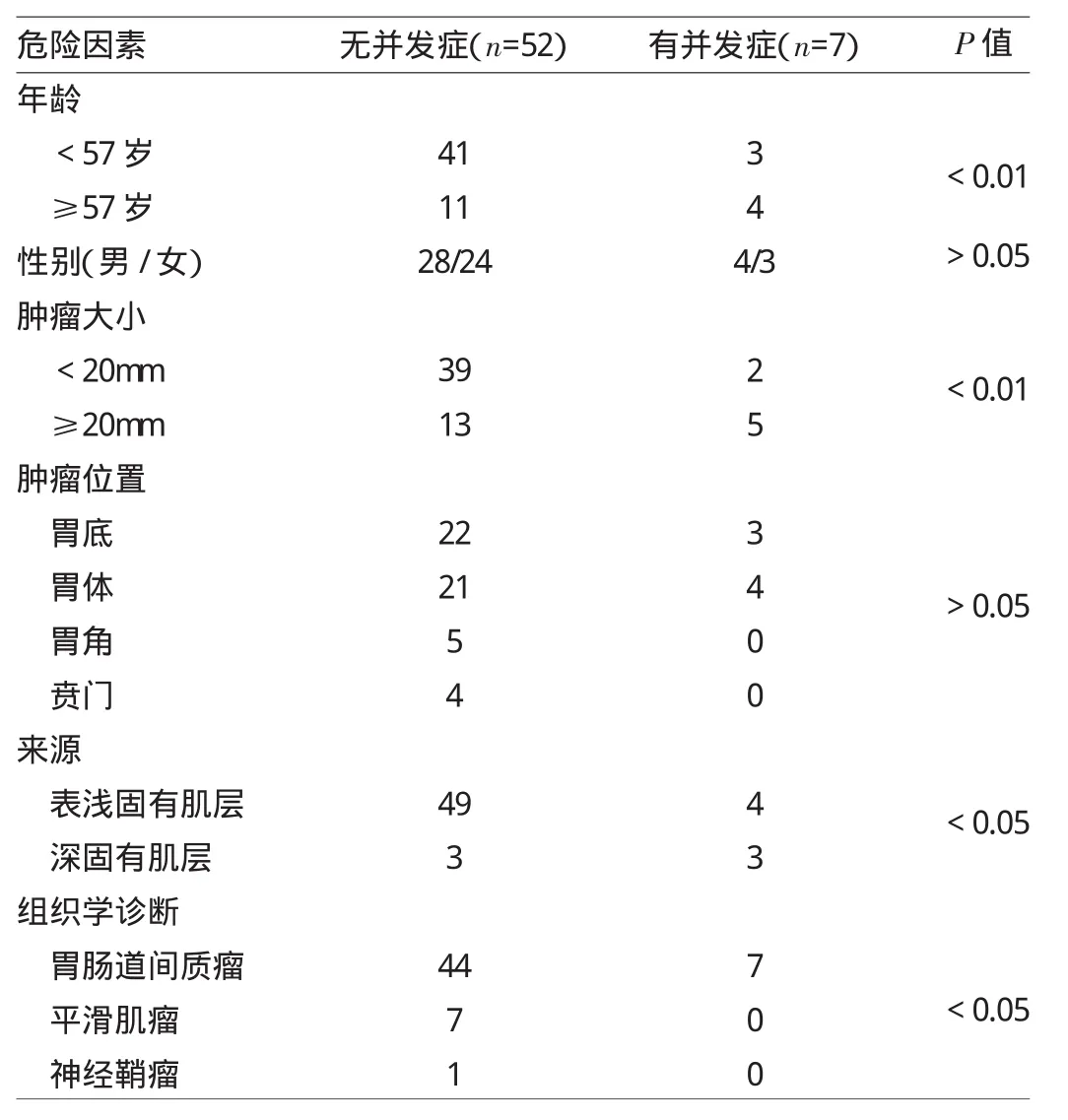
表1 E S E并发胃穿孔的危险因素分析(例)
3 讨论
腹腔镜手术因创伤小,住院时间短,术后生存期长,已成为治疗GIST的主要手段[11]。然而,腹腔镜手术也存在其局限性,很难确定微小病灶的范围,会切除更多正常组织,术后并发腹部创口感染等[12]。目前,内镜黏膜下剥离术以其更安全、有效、创伤小的优势成为治疗早期胃癌的主要手段[13],并已广泛应用于治疗上消化道SMT[14-22]。ESE可以观察完整胃壁,并且保持消化道生理功能的完整性,因此可以减少并发症和提高生活质量。GIST的特征是表达KIT基因或者血小板衍生生长因子受体[23]。GIST从发现到变异的过程中,有多种不同的临床特性。根据美国国家癌症综合网络指南,所有>2cm的GIST需要切除,而<2cm的肿瘤可以切除或者保留[10]。
本组患者完整切除率为98.3%(58/59)。1例61岁的患者,肿瘤直径约3.5cm,位于胃底,接近贲门,实施ESE失败,转为外科手术,术后病理诊断为GIST。Huang等[24]报道SMT的完整切除率是95%,这项操作的难点取决于病变的位置。Liu等[14]的一项研究指出SMT的完整切除率为96.8%,穿孔发生率为12.9%。Zhang等[15]指出SMT完整切除率为94.4%,穿孔发生率为11.1%。He等[16]指出SMT完整切除率为100%,穿孔发生率为19.35%。Chun[17]指出SMT完整切除率为74.3%,穿孔发生率为6.1%。在本研究中,穿孔发生率为11.86%,可能原因如下:(1)某些肿瘤穿孔的风险很大,包括体积大,基底宽;(2)24个病灶位于胃底,胃底的胃壁较胃的其他部分更薄。
在本研究中,平均手术时间为(115.13±55.30)min,较之前的报道长[14-17]。可能原因为:(1)一些病变同时呈腔内和腔外生长,需要更多的时间从固有肌层切除。(2)24个病灶位于胃底,由于内镜翻转导致难以操纵末梢绝缘手术刀,相比胃体和胃角的肿瘤,将消耗更多的操作时间。
胃穿孔是ESE在治疗SMT时的主要并发症,文献报道其发生率为0~20%[25-27]。ESE出现胃穿孔的危险因素较多,一定意义上限制了ESE技术的发展。研究提示,并发胃穿孔主要涉及3个方面:(1)患者相关因素:患者年龄、基础疾病、用药史等;(2)病变相关因素:包括病变位置、大小、肉眼形态、病理类型、侵犯深度等;(3)操作相关因素,包括操作时间、操作者等。本研究纳入年龄、性别、病变位置、病变大小、病理分型进行分析。研究表明,起源于深固有肌层的肿瘤并发胃穿孔的发生率显著高于浅固有肌层的肿瘤。原因可能为深固有肌层病变通常紧密粘附于胃浆膜。在这种情况下,胃壁很难保持完整性。
由于本研究属于回顾性分析,样本量也较小;随访时间短,尚难以确定远期疗效。因此,今后需大样本和多中心研究进一步提供循证医学依据指导临床。总之,针对固有肌层来源的SMT,ESE是一种可行、安全、有效的微创治疗方法,胃穿孔少,且多可通过内镜及其他内科手段成功治疗。病变位于深固有肌层,直径较大(>2mm),年龄大的患者发生并发症的风险可能更大,因此,操作者应更加小心谨慎,防止胃穿孔的发生。
[1]Zhang Y,Zhou P,Xu M,et al.Endoscopic diagnosis and treatment of gastric glomus tumors[J].Gastrointest Endosc,2011,73(2):371-375.
[2]Mcdonnell MJ,Punnoose S,Viswanath Y,et al.Gastrointestinal stromal tumours(GISTs):an insight into clinical practice with review of literature[J].Frontline Gastroenterol,2017,8(1):19-25.
[3]宋彬,杜娟.胃肠道间质瘤临床病理诊断研究进展[J].中华实用诊断与治疗杂志,2015,29(2):117-119.
[4]Moon JS.Role of Endoscopic Ultrasonography in Guiding Treatment Plans for Upper Gastrointestinal Subepithelial Tumors[J].Clin Endosc,2016,49(3):220-225.
[5]Iorio N,Sawaya RA,Friedenberg FK.Review article:the biology,diagnosis and management of gastrointestinal stromal tumours[J].Aliment PharmacolTher,2014,39(12):1376-1386.
[6]崔盈盈,卢忠生,令狐恩强,等.内镜黏膜下剥离术对治疗早期胃癌的临床应用价值[J].胃肠病学和肝病学杂志,2013,22(4):341-343.
[7]洪捷敏,林琪,尹雪,等.内镜黏膜下剥离或挖除术治疗消化道黏膜下肿瘤[J].现代实用医学,2013,25(3):260-261.
[8]Parkin B,Chugh R.Molecular pathology ofgastrointestinalstromal tumors and implications for treatment and prognosis[J].Curr ProblCancer,2011,35(5):245-254.
[9]Faigel DO,Abulhawa S.Gastrointestinal stromal tumors:the role of the gastroenterologist in diagnosis and risk stratification[J].J Clin Gastroenterol,2012,46(8):629-636.
[10]Demetri GD,von Mehren M,Antonescu CR,et al.NCCN Task Force report:update on the management of patients with gastrointestinalstromaltumors[J].J NatlCompr Canc Netw,2010,8(Suppl2):S1-S41,S42-S44.
[11]郁雷,梁小波.胃肠道间质瘤诊治指南解读[J].中华结直肠疾病电子杂志,2015,4(1):8-14.
[12]Ohtani H,Maeda K,Noda E,et al.Meta-analysis of laparoscopic and open surgery for gastric gastrointestinal stromal tumor[J].Anticancer Res,2013,33(11):5031-5041.
[13]叶淑芳,朱晚林,叶秀津,等.超声内镜辅助下ESD治疗上消化道隆起性病变的疗效及安全性探讨[J].浙江医学,2013,35(11):1041-1044.
[14]Liu BR,Song JT,Qu B,et al.Endoscopic muscularis dissection for upper gastrointestinal subepithelial tumors originating from the muscularis propria[J].Surg Endosc,2012,26(11):3141-3148.
[15]Zhang S,Chao GQ,Li M,et al.Endoscopic submucosal dissection for treatment of gastric submucosal tumors originating from the muscularis propria layer[J].Dig Dis Sci,2013,58(6):1710-1716.
[16]He Z,Sun C,Zheng Z,et al.Endoscopic submucosal dissection of large gastrointestinal stromal tumors in the esophagus and stomach[J].J GastroenterolHepatol,2013,28(2):262-267.
[17]Chun SY,Kim KO,Park DS,et al.Endoscopic submucosal dissection as a treatment for gastric subepithelial tumors that originate from the muscularispropria layer:a preliminary analysis of appropriate indications[J].Surg Endosc,2013,27(9):3271-3279.
[18]Feng Y,Yu L,Yang S,et al.Endolumenalendoscopic full-thickness resection ofmuscularis propria-originating gastric submucosaltumors[J].J Laparoendosc Adv Surg Tech A,2014,24(3):171-176.
[19]刘永东,谈理,杨梅,等.内镜下黏膜剥离术治疗上消化道肿瘤性病变[J].世界临床医学,2015,9(7):219.
[20]王一卓,李红,张崴琪,等.内镜黏膜下剥离术治疗上消化道黏膜下病变的疗效与并发症分析[J].胃肠病学和肝病学杂志,2015,24(5):519-521.
[21]孙圣斌,黄曼玲,刘爱斯,等.内镜黏膜下剥离术治疗上消化道固有肌层肿瘤的探讨[J].中国内镜杂志,2014,20(3):277-281.
[22]Catalano F,Rodella L,Lombardo F,et al.Endoscopic submucosal dissection in the treatment of gastric submucosal tumors:results from a retrospective cohort study[J].Gastric Cancer,2013,16(4):563-570.
[23]Joensuu H,Wardelmann E,Sihto H,et al.Effect of KIT and PDGFRA Mutations on Survival in Patients With Gastrointestinal Stromal Tumors Treated With Adjuvant Imatinib:An Exploratory Analysis of a Randomized Clinical Trial[J].JAMA Oncol,2017,3(5):602-609.
[24]Huang ZG,Zhang XS,Huang SL,et al.Endoscopy dissection of small stromal tumors emerged from the muscularis propria in the upper gastrointestinal tract:Preliminary study[J].World J Gastrointest Endosc,2012,4(12):565-570.
[25]廖湘祁,唐岸柳,肖定华,等.内镜全层切除术在34例胃固有肌层肿瘤治疗中的应用[J].中南大学学报(医学版),2016,41(3):282-286.
[26]Reinehr R.Endoscopic submucosal excavation(ESE)is a safe and useful technique for endoscopic removal of submucosal tumors of the stomach and the esophagus in selected cases[J].Z Gastroenterol,2015,53(6):573-578.
[27]Wang S,Shen L.Efficacy of Endoscopic Submucosal Excavation for Gastrointestinal Stromal Tumors in the Cardia[J].Surg Laparosc Endosc Percutan Tech,2016,26(6):493-496.

