过氧化氢提高燕麦幼苗耐碱性的活性氧代谢和渗透调节
刘建新,欧晓彬,王金成,刘秀丽(甘肃省高校陇东生物资源保护与利用省级重点实验室,陇东学院生命科学与技术学院,甘肃 庆阳 745000)
土壤盐碱化是制约农业发展的重要因素之一。中国盐碱土面积3.467×107hm2(不包括滨海滩涂),其中碱土面积为8.667×105hm2[1]。研究表明,盐碱土中碱性盐(Na2CO3和NaHCO3)对作物的胁迫(简称碱胁迫)与中性盐(NaCl和Na2SO4)胁迫(简称盐胁迫)是两种相关但有本质区别的不同类型胁迫[2],碱胁迫的伤害远大于盐胁迫[3]。然而,关于盐碱胁迫的研究多集中在盐胁迫方面,碱胁迫研究鲜见报道。燕麦(Avenanuda)是禾本科燕麦属一年生小杂粮作物,其籽粒不仅蛋白质、脂肪和β-葡聚糖等营养成分丰富,还对血糖、血压和血脂升高控制具有明显功效[4]。甘肃省燕麦种植地NaHCO3的含量远高于Na2CO3,成为燕麦壮苗形成和产量提高的重要限制因素[5]。因此,探究提高燕麦幼苗耐碱性的技术途径具有重要实际意义。
过氧化氢(hydrogen peroxide, H2O2)是植物代谢过程中产生的具有毒害作用的活性氧,但新近研究发现,低浓度H2O2作为信号分子参与植物对盐碱胁迫适应的调控[6]。研究表明,H2O2作为根源信号介导盐胁迫诱导的蚕豆(Viciafaba)气孔关闭[7];外源H2O2能够缓解氧化损伤和促进胁迫蛋白表达增强小麦(Triticumaestivum)耐盐性[8],并减轻受旱黄瓜(Cucumissativus)叶绿体膜的伤害[9],提高葡萄(Vitis)抗冷性[10]和水稻(Oryzasativa)镉胁迫耐性[11]。外源H2O2是否参与碱胁迫燕麦生理响应调控,从而提高燕麦耐碱性,目前研究未见报道。本试验以甘肃省广泛种植的‘定莜6号’燕麦新品种为材料,研究喷施H2O2对NaHCO3胁迫下幼苗生长及叶片活性氧代谢和渗透调节的影响,探讨H2O2提高燕麦耐碱性的作用及其生理机制,以期为燕麦耐盐碱栽培提供理论依据。
1 材料与方法
1.1 材料培养
试验于2015年4-7月在甘肃省高校陇东生物资源保护与利用省级重点实验室日光温室进行。供试燕麦品种 ‘定莜6号’种子用1%次氯酸钠表面消毒后在瓷盘中25 ℃催芽,选露白一致的萌发苗播种在装满珍珠岩的塑料盆(口径20 cm,高14 cm)中,浇水后置日光温室培养,昼/夜温度(23±6) ℃/(17±7) ℃,相对湿度60%~80%,光照强度360~710 μmol·m-2·s-1。幼苗两叶一心期选留长势一致的壮苗约200株/盆,三叶一心期用Hoagland营养液浇灌一次,然后进行处理。
1.2 试验方案
试验设6个处理:1) CK(对照):喷蒸馏水+根施蒸馏水;2) T1:喷蒸馏水+根施75 mmol·L-1NaHCO3;3) T2:喷0.01 mmol·L-1H2O2+根施75 mmol·L-1NaHCO3;4) T3:喷0.01 mmol·L-1H2O2+根施蒸馏水;5) T4:喷 0.01 mmol·L-1H2O2+根施75 mmol·L-1NaHCO3+根施5 mmol·L-1二甲基硫脲(DMTU);6) T5:喷0.01 mmol·L-1H2O2+根施75 mmol·L-1NaHCO3+根施2 mmol·L-1抗坏血酸(ASA)。
DMTU是H2O2的淬灭剂,ASA是H2O2的清除剂,DMTU、ASA和NaHCO3实验浓度参考文献[5,7,9]并由预试验筛选确定。为避免碱冲击幼苗,NaHCO3浓度每天按25 mmol·L-1递增至终浓度75 mmol·L-1后记为开始试验处理。叶面喷施于每天8:00和19:00进行,喷施量以叶面滴液为限,每盆喷施量约10 mL,为降低表面张力,喷施液中加2滴吐温-80。根部浇灌每天19:00进行,浇灌量800 mL。处理7 d后取幼苗叶片用液氮速冻后-70 ℃保存,用于测定相关生理指标。每5盆为1个重复,重复3次,随机排列。
1.3 生理指标的测定
幼苗鲜重测定采用称重法[5];超氧阴离子(O2·-)含量测定按高俊凤[12]的方法;H2O2含量参照Sergiev等[13]的方法测定;丙二醛(MDA)含量测定按李合生[14]的方法;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性及抗坏血酸(ASA)和谷胱甘肽(GSH)含量测定按陈建勋等[15]的方法;可溶性糖、可溶性蛋白质、游离氨基酸和脯氨酸含量测定按李合生[14]的方法;有机酸和叶绿素含量测定按高俊凤[12]的方法。所有测定指标以单位鲜重材料计算结果,用平均值±标准差表示。
1.4 数据统计分析
采用Excel 2003处理数据和绘图,SPSS 20.0方差分析和Duncan法多重比较(P<0.05)。将所检测的16项指标测定值离差标准化后进行SPSS 20.0主成分分析,结果提取4个主成分,方差贡献率分别为57.155%、21.529%、8.393%和7.182%,累积贡献率达94.260%,计算得出4个主成分的得分值后按王玲等[16]的方法计算隶属函数值U(Xj),以方差贡献率占累积贡献率的比重作为权重Wj,分别为0.606、0.228、0.089和0.076,按公式D=∑[U(Xj)×Wj]计算出各处理的综合评价值(D)。
2 结果与分析
2.1 NaHCO3胁迫燕麦叶片内源H2O2含量的变化和外施H2O2对燕麦幼苗生长的影响
燕麦幼苗三叶一心期进行75 mmol·L-1NaHCO3胁迫,取幼苗倒2叶检测H2O2含量显示,当胁迫9 h时H2O2出现爆发式骤增,随即急剧降低后转向逐渐升高(图1A)。H2O2“猝发”说明其可能作为一种信号参与碱胁迫响应,随胁迫时间延长H2O2又快速积累可能是碱胁迫伤害的表现。燕麦幼苗在75 mmol·L-1NaHCO3胁迫的同时喷施0.001~5 mmol·L-1H2O27 d后发现,0.001~1 mmol·L-1H2O2能够提高燕麦幼苗鲜重,其中0.01 mmol·L-1H2O2效果最佳(图1B)。因此,以0.01 mmol·L-1H2O2作为燕麦响应碱胁迫的实验浓度。
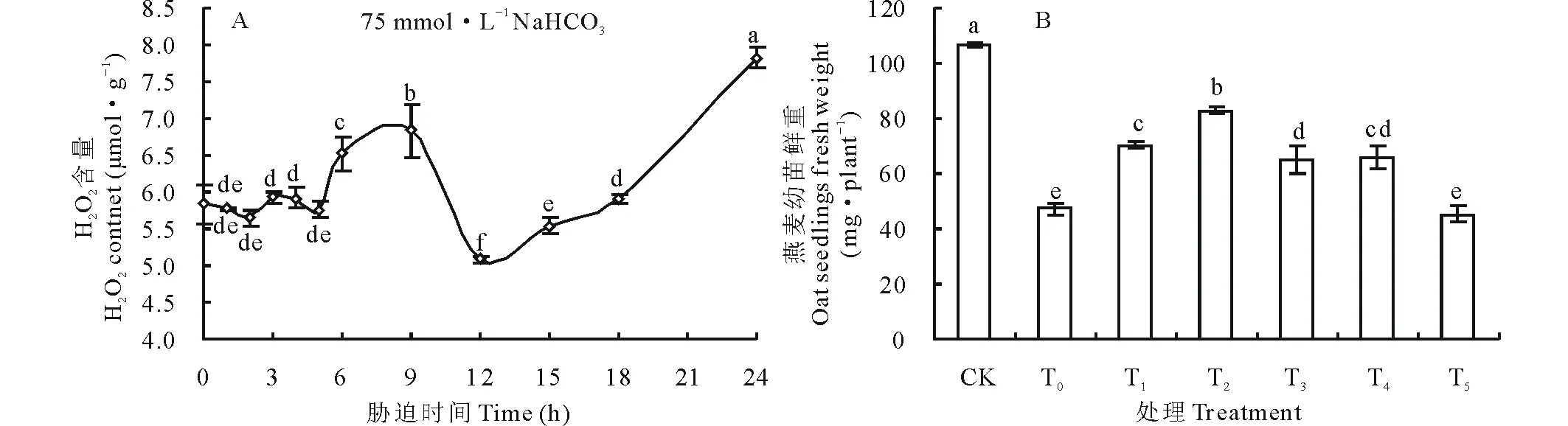
图1 75 mmol·L-1 NaHCO3胁迫下燕麦幼苗叶片内源H2O2含量变化(A)及喷施不同浓度H2O2对幼苗鲜重的影响(B)Fig.1 Change of endogenous H2O2 contents in leaves (A) and effects of spraying 0.001-5 mmol·L-1 H2O2 for 7 days on fresh weight of oat seedlings under 75 mmol·L-1 NaHCO3 stress (B)CK:Control;T0:75 mmol·L-1 NaHCO3;T1:75 mmol·L-1 NaHCO3+0.001 mmol·L-1 H2O2;T2:75 mmol·L-1 NaHCO3+0.01 mmol·L-1 H2O2;T3:75 mmol·L-1 NaHCO3+0.1 mmol·L-1 H2O2;T4:75 mmol·L-1 NaHCO3+1 mmol·L-1 H2O2;T5:75 mmol·L-1 NaHCO3+5 mmol·L-1 H2O2.不同字母表示处理间差异显著(P<0.05),下同。Different letters indicate significant difference among the treatments (P<0.05). The same below.
2.2 NaHCO3胁迫下喷施H2O2对燕麦幼苗叶片O2·-、H2O2、MDA和叶绿素含量的影响
从表1可知,NaHCO3胁迫(处理T1)引起了燕麦叶片O2·-、H2O2和MDA含量的显著升高和叶绿素含量的下降,而喷施H2O2(处理T2)有效抑制了NaHCO3胁迫下O2·-、H2O2和MDA含量升高及叶绿素含量下降的幅度;添加DMTU或ASA后部分逆转了H2O2对NaHCO3胁迫下O2·-的抑制,却显著提高了H2O2含量,降低了叶绿素含量,MDA含量在添加DMTU后(处理T4)显著升高,添加ASA后(处理T5)却没有明显变化;单独喷施H2O2(处理T3)与CK相比提高了H2O2含量,却降低了O2·-含量,MDA含量变化不大。
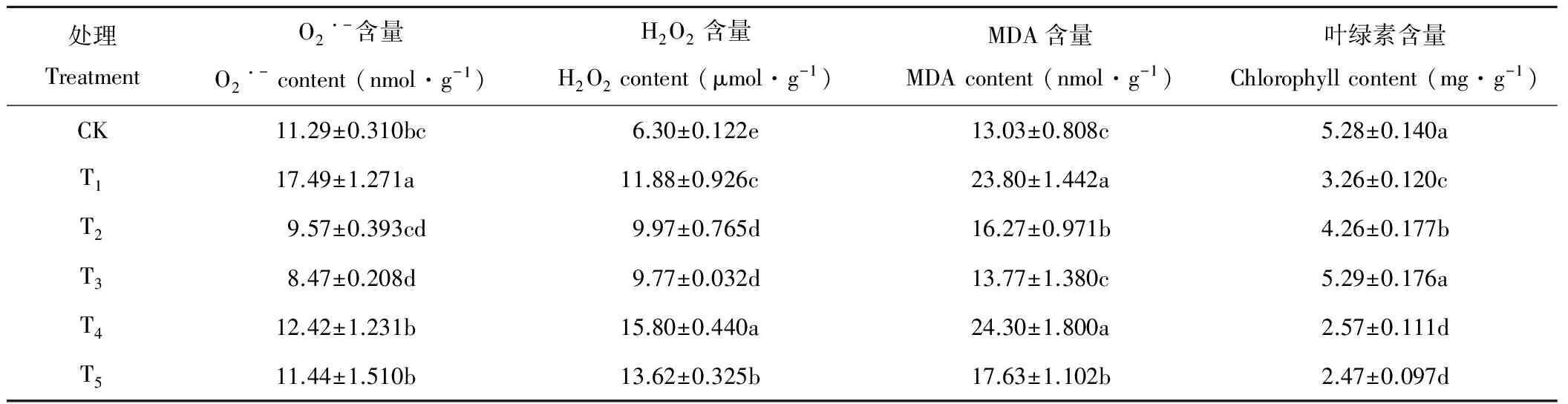
表1 喷施0.01 mmol·L-1 H2O2对75 mmol·L-1 NaHCO3胁迫下燕麦幼苗叶片O2·-、H2O2、MDA和叶绿素含量的影响Table 1 Effect of spraying 0.01 mmol·L-1 H2O2 on O2·-, H2O2, MDA and chlorophyll contents in oat seedling leaves under 75 mmol·L-1 NaHCO3 stress
CK:Control,喷水spraying H2O+根部浇水root application H2O;T1:喷水spraying H2O+根施root application 75 mmol·L-1NaHCO3;T2:喷spraying 0.01 mmol·L-1H2O2+根施root application 75 mmol·L-1NaHCO3;T3:喷spraying 0.01 mmol·L-1H2O2+根部浇水root application H2O;T4:喷spraying 0.01 mmol·L-1H2O2+根施root application 75 mmol·L-1NaHCO3+根施root application 5 mmol·L-1DMTU;T5:喷spraying 0.01 mmol·L-1H2O2+根施root application 75 mmol·L-1NaHCO3+根施root application 2 mmol·L-1ASA. 同列不同字母表示P<0.05水平差异显著,下同。Different letters within the same column indicate significant difference at 0.05 level. The same below.
2.3 NaHCO3胁迫下外源H2O2对燕麦幼苗叶片抗氧化系统的影响
图2表明,与CK相比,NaHCO3胁迫(处理T1)下燕麦幼苗叶片SOD、APX活性和ASA、GSH含量显著降低,CAT和POD活性明显升高;喷施H2O2(处理T2)提高了NaHCO3胁迫下SOD、APX活性和ASA、GSH含量,降低了CAT、POD活性;添加DMTU处理(T4)与处理T2相比SOD、CAT、POD、APX活性和ASA、GSH含量均显著降低;施用ASA处理(T5)与处理T2相比SOD、CAT、POD、APX活性和GSH含量显著降低,而ASA含量却明显升高;单独喷施H2O2(T3)与CK相比,SOD、APX活性和GSH含量降低,CAT、POD活性提高,ASA含量变化不大。
2.4 NaHCO3胁迫下外源H2O2对燕麦幼苗叶片渗透调节物质含量的影响
由表2可知,与CK相比,碱胁迫(处理T1)提高了燕麦幼苗叶片可溶性糖、可溶性蛋白质、游离氨基酸和脯氨酸含量,有机酸含量明显下降;喷施H2O2(处理T2)降低了碱胁迫下可溶性糖、游离氨基酸和脯氨酸含量,提高了有机酸含量,可溶性蛋白质含量无显著变化;施用H2O2淬灭剂DMTU处理(T4)与处理T2相比可溶性糖、可溶性蛋白质、游离氨基酸、脯氨酸含量均显著提高,但有机酸含量明显下降;施用H2O2清除剂ASA处理(T5)与处理T2相比可溶性糖、可溶性蛋白质、游离氨基酸、脯氨酸含量也是显著提高,而有机酸含量明显下降;单独喷施H2O2处理(T3)与CK相比,可溶性糖、可溶性蛋白质、游离氨基酸含量都显著提高,脯氨酸含量明显下降,而有机酸含量变化不大。
2.5 外源H2O2对碱胁迫下燕麦幼苗生长的影响及其耐碱性综合评价
由图3A可知,与CK相比,NaHCO3胁迫(处理T1)显著降低了燕麦植株鲜重,降幅达36.4%。喷施H2O2(处理T2)显著缓解了NaHCO3胁迫燕麦幼苗鲜重的降幅,增添DMTU(处理T4)和ASA(处理T5)完全逆转了H2O2对NaHCO3胁迫下燕麦幼苗鲜重下降的缓解作用;单独喷施H2O2(处理T3)与CK相比显著提高了燕麦幼苗鲜重,增幅为15.5%。
对检测的O2·-、H2O2、MDA、SOD、CAT、POD、APX、ASA、GSH、可溶性糖、可溶性蛋白质、游离氨基酸、脯氨酸、有机酸、叶绿素和鲜重16项指标进行主成分和隶属函数分析,得出各处理燕麦幼苗的综合评价值(D)。如图3B显示,与CK相比,NaHCO3胁迫(处理T1)显著降低了燕麦幼苗的D值,喷施 H2O2(处理T2)提高了NaHCO3胁迫(处理T1)燕麦幼苗的D值;添加DMTU(处理T4)和ASA(处理T5)完全或部分逆转了H2O2的作用;单独喷施H2O2处理(T3)的D值显著低于CK。

图2 75 mmol·L-1 NaHCO3胁迫下外源H2O2对燕麦幼苗叶片抗氧化系统的影响Fig.2 Effect of spraying 0.01 mmol·L-1 H2O2 on antioxidant system in leaves of oat seedlings under 75 mmol·L-1 NaHCO3 stressCK:Control,喷水spraying H2O+根部浇水root application H2O;T1:喷水spraying H2O+根施root application 75 mmol·L-1 NaHCO3;T2:喷spraying 0.01 mmol·L-1 H2O2+根施root application 75 mmol·L-1 NaHCO3;T3:喷spraying 0.01 mmol·L-1 H2O2+根部浇水root application H2O;T4:喷spraying 0.01 mmol·L-1 H2O2+根施root application 75 mmol·L-1 NaHCO3+根施root application 5 mmol·L-1 DMTU;T5:喷spraying 0.01 mmol·L-1 H2O2+根施root application 75 mmol·L-1 NaHCO3+根施root application 2 mmol·L-1 ASA. 下同The same below.
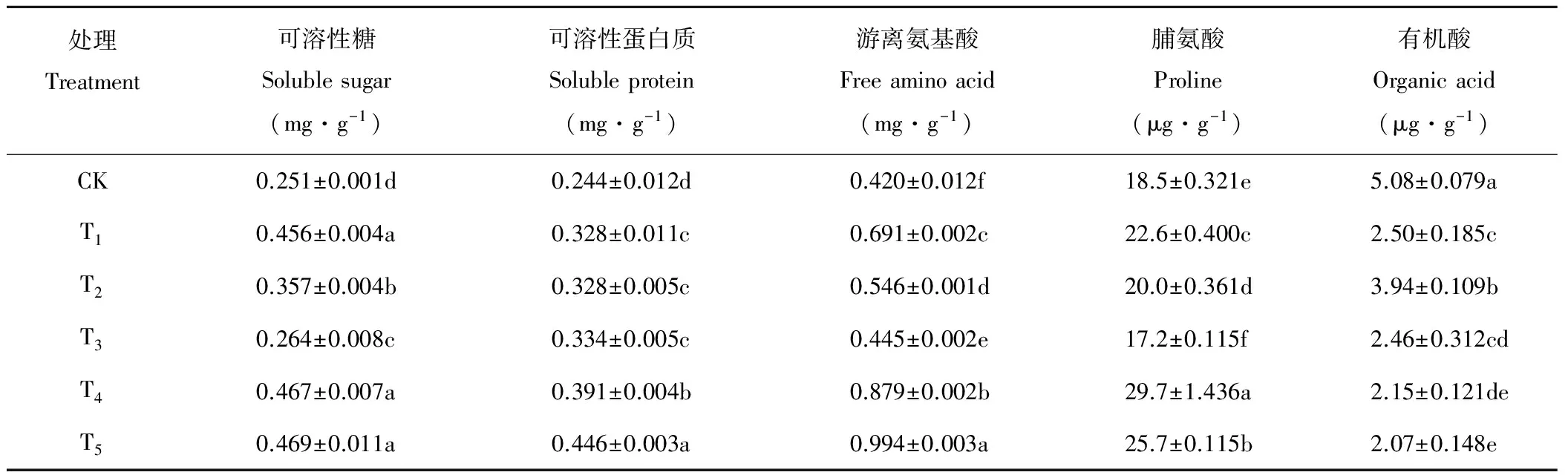
表2 75 mmol·L-1 NaHCO3胁迫下喷施0.01 mmol·L-1 H2O2对燕麦幼苗叶片渗透调节物质含量的影响Table 2 Effect of spraying 0.01 mmol·L-1 H2O2 on osmotica content in oat seedling leaves under 75 mmol·L-1 NaHCO3 stress

图3 75 mmol·L-1 NaHCO3胁迫下喷施0.01 mmol·L-1 H2O2对燕麦幼苗鲜重的影响及其耐碱性综合评价Fig.3 Effects of spraying 0.01 mmol·L-1 H2O2 on fresh weight of oat seedlings under 75 mmol·L-1 NaHCO3 stress and comprehensive evaluation to alkali resistance of oat seedlings
3 讨论
3.1 碱胁迫下燕麦幼苗活性氧代谢对外源H2O2的响应
Fedina等[17]研究发现,外源H2O2预处理能显著降低盐胁迫下大麦(Hordeumvulgare)幼苗MDA和内源H2O2含量。Abdul等[8]指出,用H2O2浸种能够通过缓解氧化伤害提高小麦幼苗的耐盐性[8]。本试验表明,碱胁迫下燕麦幼苗发生H2O2“猝发”现象(图1A),喷施H2O2能够有效抑制碱胁迫燕麦叶片O2·-、H2O2和MDA的积累(表1),提高植株生物量(图1B);而H2O2淬灭剂DMTU和清除剂ASA能够部分逆转H2O2抑制碱胁迫下O2·-的产生,并提高H2O2和MDA水平(表1)。表明H2O2可能作为一种胁迫信号能够减轻碱胁迫诱导的活性氧积累对燕麦细胞膜脂的过氧化损伤。这与H2O2能够缓解盐胁迫小麦[8]和受旱黄瓜[9]氧化伤害的结果一致。H2O2能够减轻活性氧积累对细胞膜脂氧化伤害的原因可能与它参与植物抗氧化系统的调节密切相关。Uchida等[6]研究表明,H2O2不仅能够诱导盐胁迫下水稻活性氧清除酶的活性,而且能够增强胁迫相关酶基因的表达。Gao等[18]发现,外源H2O2通过提高SOD、CAT、APX等抗氧化酶活性,降低热胁迫下黄瓜叶片的活性氧和MDA含量。本试验表明,喷施H2O2提高了碱胁迫下燕麦叶片的SOD、APX活性和ASA、GSH含量,却降低了CAT、POD活性,而H2O2淬灭剂和清除剂能够逆转H2O2对碱胁迫燕麦抗氧化系统的这种调节作用(图2),说明H2O2参与碱胁迫燕麦抗氧化系统的调节。这与外施H2O2可提高低温胁迫下葡萄SOD活性[10]及镉胁迫下水稻GSH含量[11],降低MDA含量的结果一致[10-11],而与外源H2O2可提高干旱胁迫下黄瓜SOD、CAT、POD、APX等活性的结果有所区别[9]。这可能与植物种类及胁迫类型等有关。外源H2O2提高植物抗氧酶活性的原因可能与它能够上调其编码基因表达有关[6,10],而对抗氧化物质含量调节的机理有待进一步探究。
3.2 碱胁迫下燕麦幼苗渗透溶质积累对外源H2O2的响应
积累渗透溶质是燕麦适应碱胁迫的重要特征[5]。可溶性糖和脯氨酸等是细胞主要的有机渗透溶质。本研究表明,喷施H2O2降低了碱胁迫下燕麦叶片的可溶性糖、游离氨基酸和脯氨酸含量,却提高了有机酸含量;H2O2淬灭剂或清除剂逆转了H2O2的这种调节作用(表2)。表明H2O2参与燕麦幼苗耐碱性适应过程渗透溶质积累的调控。这与外源H2O2预处理可降低NaCl胁迫下大麦叶片脯氨酸含量的结果一致[18],但与张波等[19]的外源H2O2提高盐胁迫下小麦可溶性糖含量的结果不同。说明不同胁迫下植物种类不同积累渗透溶质的机制存在差异。喷施H2O2降低碱胁迫下燕麦可溶性糖含量可能是其作为信号参与调节气孔关闭[7]后影响光合作用所致,游离氨基酸和脯氨酸含量下降可能与喷施H2O2后降低碱胁迫燕麦内源H2O2含量(表1)使蛋白质降解下降有关[20],但H2O2促进碱胁迫下有机酸积累的机制有待进一步探讨。
3.3 H2O2对碱胁迫下燕麦幼苗生物量的影响及耐碱性综合评价
生物量是燕麦耐碱性强弱的直接指标,也是生理响应的综合体现[5]。植物生物量与参与光合作用光能吸收和传递的叶绿素含量密切相关[1]。本试验表明,喷施H2O2有效抑制了碱胁迫下燕麦幼苗叶绿素含量(表1)和植株鲜重(图3A)的降幅,H2O2淬灭剂或清除剂完全逆转了H2O2的作用。这与Azevedo等[21]的外源H2O2能够缓解盐胁迫玉米(Zeamays)幼苗生长抑制的结论一致。说明外源H2O2能够增强燕麦幼苗的耐碱性。这可能一方面归因于H2O2对燕麦幼苗SOD、APX活性和ASA、GSH含量的提升作用(图2),使碱胁迫产生的活性氧能够快速地被清除,从而阻止了对细胞膜脂的过氧化伤害(表1);另一方面,可能与H2O2参与碱胁迫下燕麦幼苗渗透溶质积累的调节有关(表2),尤其是对有机酸积累的促进作用可能对增强燕麦适应碱胁迫造成的高pH胁迫发挥了重要作用。为了综合评价喷施H2O2对燕麦幼苗耐碱性的影响,采用主成分分析提取了4个独立的综合性指标替代所检测的16项指标,方差累积贡献率达94.26%,对4个主成分得分值采用隶属函数分析综合评价耐碱性结果显示,喷施 H2O2显著提高了碱胁迫下燕麦幼苗的综合评价值,H2O2的作用可被H2O2淬灭剂或清除剂部分或完全逆转(图3B),这与H2O2对生物量的影响基本一致(图3A),充分证明外源H2O2能够提高燕麦幼苗对碱胁迫的适应能力。
4 结论
喷施0.01 mmol·L-1H2O2能够显著降低75 mmol·L-1NaHCO3胁迫下燕麦叶片中O2·-、H2O2和MDA含量;提高抗氧化酶SOD、APX活性和非酶抗氧化剂ASA、GSH含量;降低渗透调节物质可溶性糖、游离氨基酸和脯氨酸含量,提高有机酸含量;使燕麦幼苗叶绿素含量和鲜重显著增加;而增添H2O2的淬灭剂DMTU或清除剂ASA能够有效逆转H2O2的这些调节作用。说明H2O2参与了碱胁迫下燕麦幼苗活性氧代谢和渗透溶质积累的调节,能够缓解碱胁迫造成的氧化伤害和生长抑制,提高燕麦幼苗的耐碱性。
References:
[1] Miao L, Gong B, Nie W J,etal. Effects of exogenous IAA on photosynthetic characteristics and antioxidative system inCucumissativusseedlings under NaHCO3stress. Plant Physiology Journal, 2014, 50(6): 765-771.
苗丽, 巩彪, 聂文婧, 等. 外源IAA对NaHCO3胁迫下黄瓜幼苗光合特性和抗氧化系统的影响. 植物生理学报, 2014, 50(6): 765-771.
[2] Yang C, Shi D, Wang D. Comparative effects of salt stress and alkali stress on growth, osmotic adjustment and ionic balance of an alkali resistant halophyteSuaedaglaucaBge. Plant Growth Regulation, 2008, 56(2): 179-190.
[3] Gong B, Wen D, VandenLangenberg K,etal. Comparative effects of NaCl and NaHCO3stress on photosynthetic parameters, nutrient metabolism, and the antioxidant system in tomato leaves. Scientia Horticulturae, 2013, 157(3): 1-12.
[4] Drzikova B, Dongowski G, Gebhardt E. Dietary fibre-rich oat-based products affect serum lipids, microbiota, formation of short-chain fatty acids and steroids in rats. British Journal of Nutrition, 2005, 94(6): 1012-1025.
[5] Liu J X, Wang J C, Wang R J,etal. Exogenous nitric oxide elevated alkali tolerance ofAvenanudaseedlings. Acta Prataculturae Sinica, 2015, 24(8): 110-117.
刘建新, 王金成, 王瑞娟, 等. 外源一氧化氮提高裸燕麦幼苗的耐碱性. 草业学报, 2015, 24(8): 110-117.
[6] Uchida A, Jagendorf A T, Hibino T,etal. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Science, 2002, 163(3): 515-523.
[7] An G Y, Li B Z, Wu G L,etal. H2O2Could act as root source signal to mediate stomatal closure induced by salt stress ofViciafabaL. Plant Physiology Journal, 2012, 48(3): 265-271.
安国勇, 李保珠, 武桂丽, 等. H2O2作为根源信号介导盐胁迫诱导的蚕豆气孔关闭反应. 植物生理学报, 2012, 48(3): 265-271.
[8] Abdul W, Mubaraka P, Sadia G,etal. Pretreatment of seed with H2O2improves salt tolerance of wheat seedlings by alleviation of oxidative damage and expression of stress proteins. Journal of Plant Physiology, 2007, 164(3): 283-294.
[9] Liu Z J, Guo Y K, Lin S H,etal. Effects of exogenous hydrogen peroxide on ultra structure of chloroplasts and activities of antioxidant enzymes in greenhouse-ecotype cucumber under drought stress. Acta Horticulturae Sinica, 2009, 36(8): 1140-1146.
刘忠静, 郭延奎, 林少航, 等. 外源过氧化氢对干旱胁迫下温室黄瓜叶绿体超微结构和抗氧化酶的影响. 园艺学报, 2009, 36(8): 1140-1146.
[10] Li X D, Hou L X, Liu X,etal. Involvement of H2O2in regulating the expression of VvIPK2in response to low temperature stress in leaves ofVitis. Acta Horticulturae Sinica, 2011, 38(6): 1052-1062.
李希东, 侯丽霞, 刘新, 等. H2O2与葡萄 VvIPK2基因表达及其低温胁迫响应的关系. 园艺学报, 2011, 38(6): 1052-1062.
[11] Bai X J, Liu L J, Zhang C H,etal. Effect of H2O2pretreatment on Cd tolerance of different rice cultivars. Chinese Journal of Rice Science, 2010, 24(4): 391-397.
白晓娟, 刘丽娟, 张春华, 等. H2O2预处理对不同水稻品种Cd耐性的影响. 中国水稻科学, 2010, 24(4): 391-397.
[12] Gao J F. Plant Physiology Experiment Guide. Beijing: Higher Education Press, 2006: 74-77, 199-222.
高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006: 74-77, 199-222.
[13] Sergiev I, Alexieva V, Karanov E. Effect of spermine, atrazine and combination between them on some endogenous protective systems and stress markers in plants. Comptes Rendus de I’ Academie Bulgare des Sciences, 1997, 51(2): 121-124.
[14] Li H S. The Experiment Principle and Technique on Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000: 184-196, 258-261.
李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 184-196, 258-261.
[15] Chen J X, Wang X F. Plant Physiology Experiment Instruction. Guangzhou: South China University of Technology Press, 2006: 68-77.
陈建勋, 王晓峰. 植物生理学实验指导. 广州: 华南理工大学出版社, 2006: 68-77.
[16] Wang L, Duan X Y, Tang M,etal. Comprehensive evaluation of physiol ogical indices of cold resistance in cymbidium under lanthanum treatment. Plant Physiology Journal, 2014, 50(8): 1177-1183.
王玲, 段晓宇, 唐敏, 等. 镧处理下大花蕙兰耐寒性生理指标的综合评价. 植物生理学报, 2014, 50(8): 1177-1183.
[17] Fedina S, Nedeva D, Cicek N. Pre-treatment with H2O2induces salt tolerance in Barley seedlings. Biologia Plantarum, 2009, 53(2): 321-324.
[18] Gao Y, Guo Y K, Lin S H,etal. Hydrogen peroxide pretreatment alters the activity of antioxidant enzymes and protects chloroplast ultrastructure in heat-stressed cucumber leaves. Scientia Horticulturae, 2010, 126(1): 20-26.
[19] Zhang B, Zhang H G. Regulation of exogenous hydrogen peroxide on wheat seedling salinity tolerance. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(12): 2491-2495.
张波, 张怀刚. 外源H2O2对小麦幼苗耐盐性的调节作用. 西北植物学报, 2007, 27(12): 2491-2495.
[20] Lu W, Li S, Li G F,etal. Effect of H2O2on stability of rice Rubisco. Plant Physiology Journal, 2002, 38(3): 213-216.
陆巍, 李森, 李国富, 等. H2O2对水稻Rubisco稳定性的影响. 植物生理学报, 2002, 38(3): 213-216.
[21] Azevedo N A D, Prisco J T, Enéas-Filho J,etal. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants. Journal of Plant Physiology, 2005, 162(10): 1114-1122.

