葡萄糖-6-磷酸脱氢酶在紫花苜蓿干旱耐受性中的响应
熊丽丽,闫霜,李萍,杨国柱,尹卫,严晓霞,张韩(.青海大学生态环境工程学院,青海 西宁8006;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 8006)
紫花苜蓿(Medicagosativa),又称苜蓿,蔷薇目、豆科、苜蓿属多年生的草本植物,也是世界上种植面积最广、最主要的牧草之一,苜蓿的年产值也很高。如今人们对紫花苜蓿的使用非常广泛,已经从传统的牧草改良扩展到了很多方面,在生产疫苗、工业酶制剂和药用蛋白等很多方面都以紫花苜蓿作为生物反应器,紫花苜蓿在人类安全、畜牧业的安全生产以及健康方面的应用具有很广泛的应用前景[1]。紫花苜蓿的抗逆性特别强,有抗旱耐寒、耐盐碱、适应性广和再生性强等优良的特点。优良的苜蓿草料为畜牧业的发展奠定基础,畜牧业的成长既能稳固农业的成长又能增进农业的成长。因此苜蓿的生产,将成为连接畜牧业生产和农业生产的桥梁。
为了保护生态环境,改变中西部地区落后的状况,越来越多的科学家开始研究生态经济效益好、抗旱、抗寒、耐盐碱的植物材料,所以抗旱性研究已经成为植物逆境环境研究的热点。因此,在进行植物抗逆性生理生化以及分子生物学研究的基础上,还应该强化各种学科之间的相互联系,将理论知识转化为实践。加强抗性生理学和育种学之间的相互联系与结合,综合分析有关抗逆性的各种指标,用更加丰富的选育方法选择新的植株品种[2]。干旱环境一直以来对农作物产量以及对植物生长影响非常大,已经成为限制农作物生产的主要抑制因素,严重降低了农作物的质量和产量。水资源的问题一直是影响农业生产的最主要原因之一,在降水比较多的地区也存在干旱问题。当今全球有很多地区还有土壤缺水严重的现象,这些干旱地区水分供不应求使得生态环境继续恶化,即使有的地方土壤水分很充足,但是水分亏缺的现象通常也会发生,从而影响了植物的正常生长[3]。干旱胁迫研究已在生理生化机制、植物激素信号传递[4]和抗逆性基因[5]的表达等方面有了很大的研究进展。因此,在此基础上,研究干旱胁迫下紫花苜蓿的生长和生理特性的变化规律,对提高紫花苜蓿植株的水分管理水平,促进紫花苜蓿在干旱高海拔地区的可持续发展具有非常重要的意义,为紫花苜蓿选育优良品种和提高植物的抗旱性提供可靠的科学依据[6]。
葡萄糖-6-磷酸脱氢酶(glucose-6-phosphatedehydrogenase, G6PDH, EC1.1.1.49)作为植物戊糖磷酸途径中的一个关键性调控酶,它为生物合成提供所需的NADPH和中间产物;另外还参与各种生物胁迫和非生物胁迫的应答反应[7-9]。有研究发现,G6PDH和其他脱氢代谢酶类的活性增加,可以降低植物体内活性氧水平,说明G6PDH是植物抗氧化过程中的一个抗性酶[10]。G6PDH在植物中有2种存在形式,一种存在于细胞质中,被称为胞质型G6PDH,对氧化胁迫以及磷酸化无明显反应;另一种存在于细胞基质中,被称为基质型G6PDH,却在对氧化胁迫的响应中被检测到活性增强,这可能与G6PDH要行使不同调控功能有关[11-12]。Wang等[13]通过酶的缺失和替代等研究了G6PDH对非生物胁迫的耐受调节机制,并通过基因克隆分析了G6PDHD的氨基酸序列,为进一步探索其生物学功能提供了理论依据。大量研究表明G6PDH参与了环境胁迫的应答[14-19],探索G6PDH对环境胁迫的响应,将有利于我们进一步认识G6PDH的功能,了解植物的防御反应机制。
本研究选用紫花苜蓿植物为材料,探索葡萄糖-6-磷酸脱氢酶在紫花苜蓿干旱耐受性中的响应,进一步揭示G6PDH在干旱胁迫下苜蓿植物的抗旱机制方面的作用以及为培育抗旱性品种提供重要的线索。
1 材料与方法
1.1 试验材料的培养
选择颗粒饱满、成熟度一致的紫花苜蓿种子为实验材料。首先将紫花苜蓿种子用自来水冲洗4~5遍,然后用75%的酒精浸泡30 s,再用无菌水冲洗2遍,之后用10%的H2O2浸泡30 min,最后用无菌水冲洗5遍,消毒后的种子接种到MS培养基上进行萌发。萌发和培养条件为:温室28 ℃,黑暗条件下萌发两天。等紫花苜蓿的根长到3.0 cm左右时,分别用经过滤灭菌的10%、15%、20%的PEG6000溶液模拟干旱胁迫处理紫花苜蓿幼苗10 d,培养箱内实行16 h/8 h光周期。处理结束后,收集紫花苜蓿幼苗,蒸馏水漂洗3遍,滤纸吸干表面水分,立即用于测定相关指标。
1.2 干鲜重、株高、根长的测定
取20棵紫花苜蓿幼苗进行株高和根长的测量,随即将新鲜的紫花苜蓿幼苗放入烘箱迅速升温至105 ℃,保持30 min,让温度下降至80 ℃,保持24 h后将样品取出,用电子天平进行称重。
1.3 MDA含量的测定
丙二醛含量的测定参照Hodges等[20]的方法,稍作改进。取1 g紫花苜蓿叶片在冰浴的研钵内加入2 mL 10%三氯乙酸(TCA)并研磨成匀浆后,转移到离心管中,在4000 r·min-1下离心10 min,将上清液转移至干净的离心管中备用。吸取1 mL上清液加入等体积的0.25%硫代巴比妥酸(TBA)(用10%TCA配制)、1 mL 0.1 mol·L-1Tris-HCl pH 7.6。混合后在95 ℃水浴中加热30 min,迅速冷却后置于10000 r·min-1离心10 min。测定440、532 和600 nm处的光吸收值。硫代巴比妥酸过氧化物(thiobarbituric acid-peroxidation,TBARS)含量由公式计算得出:6.45×(OD535-OD600)-0.56×OD440。
1.4 H2O2含量的测定
H2O2含量参照Heath等[21]的方法,略有改动。取1 g紫花苜蓿叶片在冰浴的研钵内加入2 mL 10%三氯乙酸(TCA)并研磨成匀浆后,转移到离心管中,在4000 r·min-1下离心10 min,将上清液转移至一干净的离心管中备用。吸取1 mL上清液加入等体积的0.1 mol·L-1Tris-HCl pH 7.6和1 mL KI。该混合液置于黑暗反应90 min后测定390 nm处的吸光值。
1.5 蛋白含量的测定
制作标准曲线:取6支试管,从1~6分别编号,按照表1加入标准蛋白液,向各管中加入2.5 mL考马斯亮蓝G-250溶液,摇匀,静置2 min。以空白为参比,在595 nm波长下比色测定吸光度(比色应在30 min内完成)。绘制标准曲线,求出标准直线方程(标准曲线是以蛋白质含量为横坐标,OD595为纵坐标)。
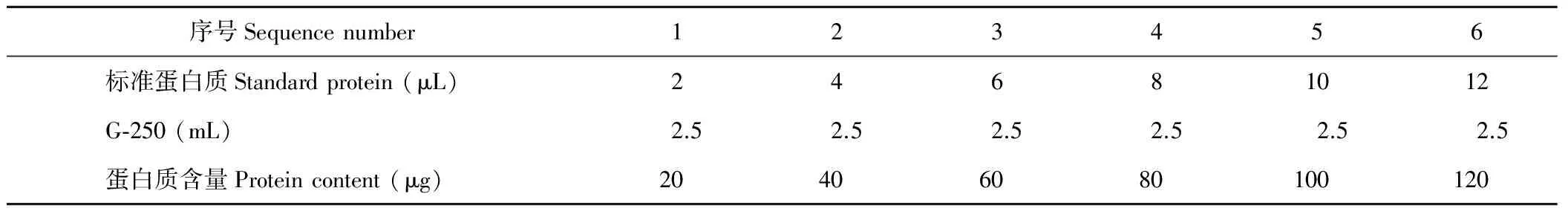
表1 考马斯亮蓝标准溶液配置表Table 1 Coomassie brilliant blue standard solution configuration table
根据Bradford[22]的方法进行蛋白定量,略有改动。吸取待测蛋白样品50 μL,放入试管中,加入3 mL考马斯亮蓝G-250溶液,摇匀后静置2 min,然后测定595 nm波长下的吸光度值,并通过标准曲线计算蛋白质含量(图1)。
1.6 G6PDH活性的测定
根据Esposito等[23]的方法提取G6PDH粗酶液,稍作改进。取0.5 g样品在冰浴的研钵内研磨成浆,转移到离心管中,加入1 mL提取液[50 mmol·L-1Hepes-Tris (pH 7.8),3 mmol·L-1MgCl2,1 mmol·L-1EDTA,1 mmol·L-1PMSF,1 mmol·L-1DTT],于4 ℃,12000 r·min-1离心20 min,上清液为粗酶提取液。G6PDH的活性测定,在预先37 ℃温浴的反应液3 mL反应混合液[55 mmol·L-1Hepes-Tris (pH 7.8),3.3 mmol·L-1MgCl2]中加入50 μL 15 mmol·L-1NaDPNa2,50 μL 15 mmol·L-1G6PDHNa2,最后加入100 μL粗酶提取液。空白对照用蒸馏水代替,启动反应作3次平行。记录反应起始5 min内340 nm的吸光值,每30 s记录一次。
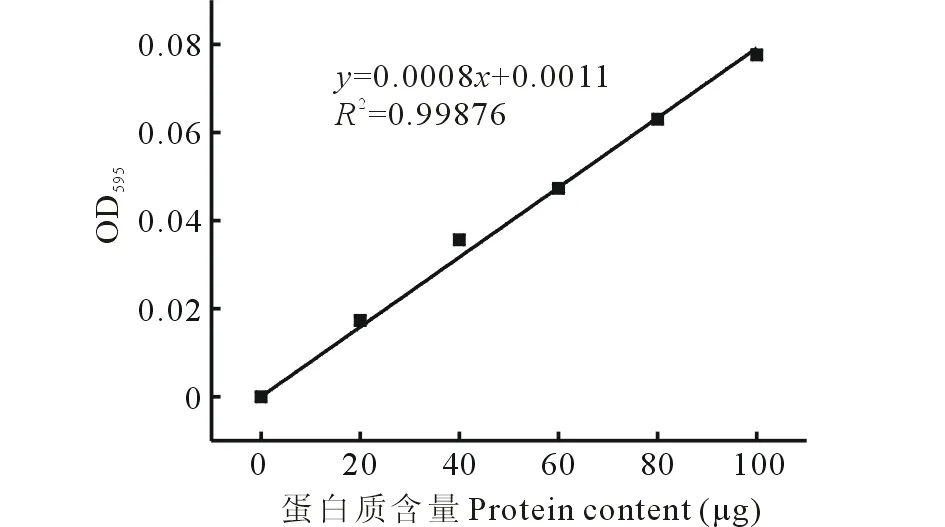
图1 蛋白质标准曲线Fig.1 Protein standard curve
2 结果与分析
2.1 不同浓度PEG对紫花苜蓿生长的影响
选取生长14 d、长势一致的紫花苜蓿幼苗,用不同浓度的PEG(10%, 15%, 20%)处理10 d后,观察紫花苜蓿幼苗的生长状态,测定其叶片中MDA和H2O2的含量以及G6PDH活性的变化。
2.1.1不同浓度PEG对紫花苜蓿幼苗生长的影响 结果发现,不同浓度PEG处理,紫花苜蓿幼苗的株高、根长及其干重都随PEG浓度的升高而逐渐降低。PEG很明显抑制了紫花苜蓿的生长,在PEG浓度为15%时紫花苜蓿幼苗生长开始出现萎蔫现象,在PEG浓度为20%时处理时间超过一周,紫花苜蓿幼苗出现枯黄致死现象(图2和图3)。

图2 不同PEG浓度处理下的表型Fig.2 The phenotype of different PEG concentrations

图3 不同浓度PEG处理对紫花苜蓿幼苗株高和根长(A)、鲜重和干重(B)的影响Fig.3 Effects of different concentrations of PEG treatment on plant height and root length (A), fresh weight and dry weight (B) of alfalfa seedlings不同字母表示差异显著(P<0.05)。Different letters mean significant difference (P<0.05).下同 The same below.
2.1.2不同浓度PEG对叶片中MDA含量的影响 结果发现,紫花苜蓿叶片中MDA的含量先上升后下降,PEG浓度在15%时MDA含量比对照组增加71.8%,在PEG浓度为15%时达到最高值(图4)。
2.1.3不同浓度PEG对叶片中H2O2含量的影响 结果发现不同浓度PEG处理,紫花苜蓿幼苗叶片中H2O2的含量先上升后下降,在PEG浓度为15%时达到最高值,相比对照组H2O2含量增加30.4%。干旱胁迫下植物体内H2O2快速积累引起氧化伤害,根据以上的试验结果选择15%作为干旱胁迫处理的浓度(图5)。

图4 不同浓度PEG处理下紫花苜蓿叶片中MDA含量的变化Fig.4 Changes of MDA content in leaves of alfalfa under different concentrations of PEG

图5 不同浓度PEG处理下紫花苜蓿叶片中H2O2含量的变化Fig.5 Changes of H2O2 content in leaves of alfalfa under different concentrations of PEG
2.1.4不同浓度PEG对G6PDH活性的影响 结果发现不同浓度PEG处理,随着PEG浓度的升高紫花苜蓿叶片中G6PDH活性先升高后降低,紫花苜蓿在15%PEG处理下达到最大值,比对照组G6PDH活性增加了18.5%(图6)。
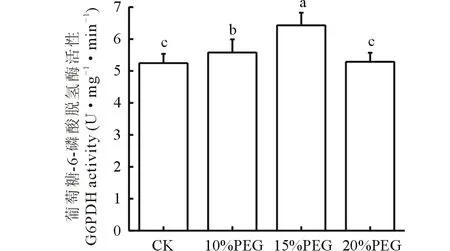
图6 不同浓度PEG处理对紫花苜蓿幼苗叶片中G6PDH活性的影响Fig.6 Effects of different PEG concentrations on the activity of G6PDH in alfalfa leaves
2.2 G6PDH对干旱胁迫的响应分析
为进一步研究G6PDH对干旱胁迫下紫花苜蓿幼苗生长的调节,通过预实验分别选取0.10, 0.25, 0.50, 1.00 mmol·L-1的Na3PO4进行处理并测定紫花苜蓿幼苗中G6PDH活性变化,发现0.25 mmol·L-1的Na3PO4即可使G6PDH活性被明显抑制,因此选用0.25 mmol·L-1Na3PO4[24]处理生长14 d、长势一致的紫花苜蓿幼苗后,再用不同浓度的PEG(10%、15%、20%)处理10 d后,观察紫花苜蓿幼苗的生长状态,测定其叶片中MDA和H2O2的含量以及G6PDH活性的变化。
2.2.1添加G6PDH抑制剂Na3PO4后干旱胁迫下幼苗的生长变化 干旱胁迫(15%PEG)下,紫花苜蓿株高、根长及干重分别比对照组有所降低,用0.25 mmol·L-1Na3PO4处理后进一步抑制了紫花苜蓿幼苗的株高、根长及其干重。添加抑制剂时紫花苜蓿幼苗的生长受到了抑制,在PEG和抑制剂的共同作用下紫花苜蓿幼苗的生长进一步受到抑制,这时植株开始出现发黄枯萎的现象。这些结果表明干旱胁迫下紫花苜蓿叶片中G6PDH参与了紫花苜蓿植株的生长过程(图7和图8)。
2.2.2添加G6PDH抑制剂后干旱胁迫下MDA含量的变化 丙二醛的积累对于膜及细胞会造成一定的伤害,所以MDA的含量可以反映在遭受逆境时的伤害程度。干旱胁迫(15%PEG)明显提高了紫花苜蓿叶片中MDA的含量,用0.25 mmol·L-1Na3PO4处理后使得紫花苜蓿叶片中MDA含量都明显提高,相比对照组增长了28.4%。用PEG和Na3PO4共同作用下紫花苜蓿叶片中丙二醛的含量也有明显提高,比对照组增长了65.7%,比Na3PO4单独作用增长了26.9%。结果进一步表明了紫花苜蓿幼苗通过增加G6PDH的活性来抵抗干旱胁迫的环境,避免受到严重的氧化伤害,进而达到增强植株对干旱耐受性的目的(图9)。

图7 添加G6PDH抑制剂后干旱胁迫下紫花苜蓿幼苗Fig.7 Phenotype of alfalfa seedlings under drought stress after adding G6PDH inhibitor

图9 添加G6PDH抑制剂后干旱胁迫下紫花苜蓿幼苗叶片中MDA含量的变化Fig.9 Changes of MDA content in leaves of alfalfa seedlings under drought stress by adding G6PDH inhibitor

图10 添加G6PDH抑制剂后干旱胁迫下紫花苜蓿幼苗叶片中H2O2含量的变化Fig.10 Changes of H2O2 content in leaves of alfalfa seedlings under drought stress by adding G6PDH inhibitor
2.2.3添加G6PDH抑制剂后干旱胁迫下H2O2含量的变化 干旱胁迫(15%PEG)明显提高了紫花苜蓿叶片中H2O2的含量,用0.25 mmol·L-1Na3PO4处理后使得紫花苜蓿叶片中H2O2含量明显升高,Na3PO4单独处理的H2O2含量比对照组增长了22%,用PEG和Na3PO4共同作用下紫花苜蓿叶片中H2O2含量有明显提高,比对照组增长了45%,比Na3PO4单独作用增长了18%(图10)。
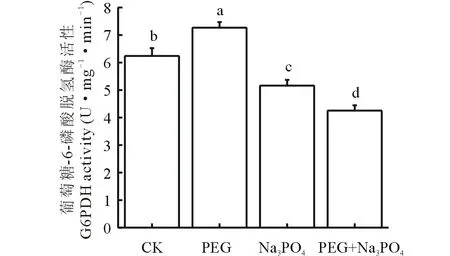
图11 添加G6PDH抑制剂后干旱胁迫下紫花苜蓿幼苗G6PDH活性的变化Fig.11 Changes of G6PDH activity in alfalfa seedlings under drought stress after adding G6PDH inhibitor
2.2.4添加G6PDH抑制剂后干旱胁迫下G6PDH活性的变化 干旱胁迫(15%PEG)下,紫花苜蓿幼苗叶片中G6PDH活性明显升高。用0.25 mmol·L-1Na3PO4处理后紫花苜蓿叶片中G6PDH活性明显下降,在PEG和抑制剂的共同作用下紫花苜蓿幼苗叶片中G6PDH的活性进一步下降,Na3PO4单独作用下的G6PDH的活性比对照组降低了20.9%,用PEG和Na3PO4共同作用下紫花苜蓿叶片中G6PDH的活性比对照组下降了46.8%,比Na3PO4单独处理下降了21.4%,表明紫花苜蓿通过增加G6PDH活性来抵抗干旱环境,减少对植株的伤害,以达到增强紫花苜蓿植株对干旱耐受性的响应(图11)。
3 讨论
植物遭受干旱胁迫时生长受到抑制,遭受胁迫程度不同植株会表现出不同的表型特征,如:轻中度干旱胁迫时植株株高降低,生长迟缓等特征,干旱胁迫增加时,植株会失水萎蔫、叶片卷曲变黄,胁迫程度再增加有可能导致植株枯萎或者死亡。本研究中使用0~20%PEG处理,首先通过观察其表型变化分析紫花苜蓿幼苗的干旱耐受范围,结果表明,当PEG浓度达到20%时,紫花苜蓿幼苗的地上部分基本不生长(图2和图3),初步可以判断紫花苜蓿幼苗对干旱的耐受浓度应该小于20%PEG。但是PEG浓度低于20%时,紫花苜蓿幼苗受损的程度仍不明确,因此检测了相关的伤害指标。细胞膜是保护植物细胞免受外界伤害的有力屏障,也是植物遭受逆境胁迫时首先遭到攻击的部位。丙二醛是植物在逆境中组织或器官受到伤害而产生的脂质氧化反应的最终代谢物,会引起核酸、蛋白质等大分子的交联聚合[25]。同样,其含量以及H2O2含量也可以作为评价植物在抗逆性中的重要指标[26]。干旱胁迫也会导致植物体内活性氧的大量积累,从而引起氧化损伤。结果表明,随PEG浓度的增加,MDA和H2O2的含量先增加后减少(图4和图5),15%PEG处理时积累量最大,推测此时出现活性氧爆发现象,并确定15%PEG为胁迫浓度。大量研究表明,G6PDH参与了植物对多种环境胁迫的耐受性响应,如干旱、盐胁迫、高温、病原菌侵染等[24,27-29]。G6PDH在植物干旱耐受性中的响应也有报道。如,Liu等[14]研究发现,干旱诱导了大豆(Glycinemax) G6PDH活性的增加,而且其活性水平在抗旱性强的品种中要高于抗旱性弱的品种。Wang等[13]也发现干旱胁迫增强了大多数根中G6PDH活性,并且提出了一个G6PDH在大豆干旱适应性中的模式图,强调干旱胁迫诱导了ABA的积累,进而通过激活NADPH氧化酶增强了H2O2的产生;H2O2作为下游信号分子通过调节G6PDH磷酸化过程而激活了胞质G6PDH活性;增强的胞质G6PDH活性通过调节ASA-GSH循环中关键酶活性从而增加了ASA和GSH含量;高水平的ASA和GSH能够增强植物清除ROS能力,以此维持细胞内适宜的ROS水平,从而避免细胞遭受氧化损伤。类似地,本研究结果表明PEG诱导了G6PDH活性的增加(图6),G6PDH抑制剂处理后紫花苜蓿幼苗的生长较对照组和干旱胁迫处理组受到的抑制更加严重(图7和图8),相应的MDA和H2O2含量较单独干旱胁迫下的有所增加(图9和图10),很明显G6PDH活性被抑制后加剧了干旱胁迫对植物引起的损伤,说明G6PDH在响应干旱胁迫中起了一定的调节作用,结合Wang等[13]的研究结果推测G6PDH在紫花苜蓿中可能通过调节自身活性来促使植物体内其他保护性酶或者信号分子的产生来响应干旱胁迫引起的氧化损伤,从而抵御干旱胁迫。所以,紫花苜蓿幼苗是通过增加G6PDH的活性来抵抗干旱胁迫环境以避免植株受到严重的氧化损伤,进而达到增强植株对干旱耐受性的目的,证明G6PDH可能参与调节了植物对干旱胁迫的响应。
4 结论
紫花苜蓿叶片中MDA、H2O2含量以及G6PDH活性随PEG浓度0、10%、15%、20%先上升后下降,15%处最高;在PEG浓度为15%时,MDA含量、H2O2含量以及G6PDH活性分别比对照组增长了71.8%、30.4%、18.5%;故采用PEG模拟紫花苜蓿干旱胁迫的最佳处理浓度为15%。
添加G6PDH的抑制剂Na3PO4的紫花苜蓿叶片中MDA含量以及H2O2含量都呈上升趋势,分别比对照组增长了65.7%和45.0%;抑制剂作用下的G6PDH活性比对照组降低了46.8%;干旱胁迫和抑制剂作用下叶片中MDA和H2O2含量分别较干旱胁迫下的增长28.4%和19.9%,G6PDH的活性明显降低了49.4%;因此,G6PDH可能参与调节了植物对干旱胁迫的响应。
References:
[1] Li Y, Sun H R, Ding N,etal. Alfalfa (MedicagosativaL.) root biomass. Acta Agrestia Sinica, 2011, (5): 872-879.
李扬, 孙洪仁, 丁宁, 等. 紫花苜蓿根系生物量. 草地学报, 2011, (5): 872-879.
[2] Lu S. Effects of drought stress on plant growth and physiological traits. Journal of Jiangsu Forestry Science & Technology, 2012, (4): 51-54.
鲁松. 干旱胁迫对植物生长及其生理的影响. 江苏林业科技, 2012, (4): 51-54.
[3] Zhou F. Effects of drought stress on plant growth and physiological traits. Beijing Agriculture, 2014, (3): 1.
周峰. 干旱胁迫对植物生长及其生理的影响. 北京农业, 2014, (3): 1.
[4] Jo B, Radhika D, Hancock J T,etal. ABA-induced NO generation and stomatal closure inArabidopsisare dependent on H2O2synthesis. Plant Journal, 2006, 45(1): 113-122.
[5] Yang X L, Zhu Y J. Advances of plant drought stress. Agricultural Engineening, 2012, (11): 44-45.
杨雪莲, 朱友娟. 植物干旱胁迫研究进展. 农业工程, 2012, (11): 44-45.
[6] Wang B F, Huang J P, Yang X L,etal. Advances on inhibition mechanism of crop photosynthesis by drought stress. Hubei Agricultural Sciences, 2014, (23): 5628-5632.
汪本福, 黄金鹏, 杨晓龙, 等. 干旱胁迫抑制作物光合作用机理研究进展. 湖北农业科学, 2014, (23): 5628-5632.
[7] Yu D Q, Tang H R, Zhang Y,etal. Research progress in glucose-6-phosphate dehydrogenase in higher plants. Chinese Journal of Biotechnology, 2012, (7): 800-812.
于定群, 汤浩茹, 张勇, 等. 高等植物葡萄糖-6-磷酸脱氢酶的研究进展. 生物工程学报, 2012, (7): 800-812.
[8] Kletzien R F, Harris P K W, Foellmi L A. Glucose-6-phosphate dehydrogenase, a “housekeeping” enzyme subject to tissue-specific regulation by hormones, nutrients, and oxidant stress. The FASEB Journal, 1994, 8: 174-181.
[9] Ghosh A K, Saini S, Das S,etal. Glucose-6-phosphate dehydrogenase and trypanothione reductase interaction protectsLeishmaniadonovanifrom metalloid mediated oxidative stress. Free Radical Biology and Medicine, 2017, 106: 10-23.
[10] Valderrama R, Corpas F J, Carreras A,etal. The dehydrogenase-mediated recycling of NADPH is a key antioxidant system against salt-induced oxidative stress in olive plants. Plant Cell & Environment, 2006, 29(7): 1449-1459.
[11] Li J S. Studies on the Mechanism of Regulations of G6PDH, cGMP, H2O2and Ca2+in Plant Adaptation to Salt Tolerance. Lanzhou: Lanzhou University, 2011.
李积胜. G6PDH、cGMP、H2O2和Ca2+在植物耐盐适应中调节作用的机理研究. 兰州: 兰州大学, 2011.
[12] Stanton R C. Glucose-6-phosphate dehydrogenase, NADPH, and cell survival. Iubmb Life, 2012, 64(5): 362-369.
[13] Wang H H, Yang L D, Li Y,etal. Involvement of ABA- and H2O2- dependent cytosolic glucose-6-phosphate dehydrogenase in maintaining redox homeostasis in soybean roots under drought stress. Plant Physiology Biochemistry, 2016, 107: 126-136.
[14] Liu J, Wang X M, Hu Y F,etal. Glucose-6-phosphate dehydrogenase plays a pivotal role in tolerance to drought stress in soybean roots. Plant Cell Report, 2013, 32(3): 415-429.
[15] Zhao C Z, Wang X M, Wang X Y,etal. Glucose-6-phosphate dehydrogenase and alternative oxidase are involved in the cross tolerance of highland barley to salt stress and UV-B radiation. Journal of Plant Physiology, 2015, 181: 83-95.
[16] Cardi M, Castiglia D, Ferrara M,etal. The effects of salt stress cause a diversion of basal metabolism in barley roots: possible different roles for glucose-6-phosphate dehydrogenase isoforms. Plant Physiology Biochemistry, 2015, 86: 44-54.
[17] Hofmann N R. The GSK3-type kinase ASKα targets glucose-6-phosphate dehydrogenase to mediate oxidative stress responses inArabidopsis. Plant Cell, 2012, 24(8): 3170.
[18] An X, Liu L Z, Hu P. Research in progress on glucose-6-phosphate dehydrogenase. Chinese Journal of Biologicals, 2011, (6): 745-748.
安选, 刘良忠, 胡鹏. 葡萄糖-6-磷酸脱氢酶的研究进展. 中国生物制品学杂志, 2011, (6): 745-748.
[19] Asai S, Yoshioka M, Nomura H,etal. A plastidic glucose-6-phosphate dehydrogenase is responsible for hypersensitive response cell death and reactive oxygen species production. Journal of General Plant Pathology, 2011, 77(3): 152-162.
[20] Hodges D M, Delong J M, Forney C F,etal. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 1999, 207: 604-711.
[21] Heath R L, Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation. Archives of Biochemistry and Biophysics, 1968, 125: 189-198.
[22] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[23] Esposito S, Carfagna S, Massaro G,etal. Glucose-6-phosphate dehydrogenase in barley roots: kinetic properties and localization of the isoforms. Planta, 2001, 212: 627-634.
[24] Liu Y G, Wu R R, Wan Q,etal. Glucose-6-phosphate dehydrogenase palys a pivotal role in nitric oxide-involved defense against oxidative stress under salt stress in red kidney bean roots. Plant and Cell Physioloy, 2007, 48(3): 511-522.
[25] Nie S H, Qi J C, Zhang H L,etal. Effect of drought stress simulated by PEG6000 on malondialdehyde content and activities of protective enzymes in barley seedings. Xingjiang Agricultural Sciences, 2011, (1): 11-17.
聂石辉, 齐军仓, 张海禄, 等. PEG6000模拟干旱胁迫对大麦幼苗丙二醛含量及保护酶活性的影响. 新疆农业科学, 2011, (1): 11-17.
[26] Wang H Z, Zhang L H, Jun M A,etal. Effects of water stress on reactive oxygen species generation and protection system in rice during grain-filling stage. Agricultural Sciences in China, 2010, 9(5): 633-641.
[27] Gong H, Chen G, Li F,etal. Involvement of G6PDH in heat stress tolerance in the calli fromPrzewalskiatanguticaandNicotianatabacum. Biologia Plantarum, 2012, 56(3): 422-430.
[28] Dal Santo S, Stampfl H, Krasensky J,etal. Stress-induced GSK3 regulates the redox stress response by phosphorylating glucose-6-phosphate dehydrogenase inArabidopsis. Plant Cell, 2012, 24(8): 3380-3392.

