PMP-HPLC法测定太子参中葡萄糖的含量
,2*
1.福建中医药大学药学院,福建 福州 350122;2. 福建中医药大学附属第二人民医院,福建 福州 350003
福建道地药材太子参中含有丰富的多糖。国内学者和本课题组研究表明,太子参多糖具有降低血糖、血脂、改善胰岛素抵抗,还具有心肌保护、增加免疫功能等作用,是太子参主要有效成分之一;太子参多糖降血糖、减少胰岛素抵抗,抗2型糖尿病(T2DM)具有潜在的实用价值[1-3]。多糖的单糖组成分析是进行多糖质量控制和获取多糖基本信息的重要环节,课题组前期工作证实太子参多糖中存在大量的葡聚糖[4-5];鉴于目前2015年版《中华人民共和国药典》太子参药材的质量标准中尚未制定含量测定指标,笔者从多糖入手,建立单糖葡萄糖含量测定的方法,为完善中药太子参的质量标准奠定基础。
有关太子参多糖含量测定的研究很多,检测多糖的方法有分光光度法、高效液相-蒸发光散射法、酶联免疫法、电化学法[6-9],但其单糖组成迄今少见报道。对糖类物质而言,其化学结构中不含生色团,不产生紫外光吸收,多数不产生荧光,无法通过紫外或荧光直接检测而是将多糖水解成单糖后进行测定。因此笔者采用高温强酸水解的方法将太子参多糖水解为单糖,以1-苯基-3-甲基-5-吡唑啉酮(PMP)为衍生物,在碱性条件下与单糖缩合生成单糖-PMP衍生物,高效液相色谱(HPLC)法测定单糖的含量[10]。
1 仪器与材料
1.1 仪器 DIONEX Ultimate 3000双三元高效液相色谱系统(包括Ultimate 3000 DAD检测器、Chromeleon 7.1 数据处理系统,美国DIONEX公司);AE240S型电子分析天平(梅特勒-托利多有限公司);BARNSTEAD TⅡ型超纯水机(美国Thermo公司)。
1.2 材料 太子参(购自福建柘荣太子参市场);:D-无水葡萄糖对照品(≥99.9%,批号:110833-201506,中国食品药品检定研究院)。色谱纯甲醇(批号:1880707710、德国Merck公司),色谱纯乙腈(批号:167265、美国Fisher公司),1-苯基-3-甲基-5-吡唑啉酮(批号:BCBP1308V,美国SIGMA公司),三氟乙酸(批号:C1713014,aladdin公司),无水乙醇(批号“20170424)、磷酸二氢钾(批号:20170324)、甲醇(批号:20170712)等均为国药集团化学试剂有限公司产品,水为电阻率为18.2Ω的超纯水。
2 方法与结果
2.1 色谱条件 采用大连依利特HypersiL BDS C18色谱柱(4.6 mm×250 mm,5μm),检测波长为250 nm,流速为1.0 mL/min,柱温为30℃,进样量20 μL。流动相:溶剂A,15%(v/v)乙腈+50 mmol/L磷酸缓冲液(KH2PO4-NaOH,pH 6.9),溶剂B,40%(v/v)乙腈+50 mmol/L磷酸缓冲液(KH2PO4-NaOH,pH 6.9),梯度洗脱(0~10 min,100%~90% A;10~30 min,90%~80% A;30~40 min,80% A;40~45 min,80%~100% A)
2.2 对照品溶液的制备 精密称定葡萄糖对照品104.08 mg,加蒸馏水溶解至5 mL容量瓶中,摇匀,得浓度为20.82 mg/mL的对照品溶液,作为标准母液。分别精密量取标准母液0、0.05、0.10、0.20、0.50、1.00、1.50 mL,加水定容至2 mL,配制成浓度为0、0.52、1.04、2.08、5.21、10.41、15.62 mg/mL的对照品溶液。
2.3 供试品溶液的制备
2.3.1 乙醇脱脂与多糖提取 称取太子参(粉碎过3号筛)1.0 g,精密称定,加入乙醇100 mL,加热4 h,弃去乙醇液,药渣挥干乙醇,准确加水50 mL、称重,水浴加热回流提取2 h,放冷后加水补重,混匀,离心,取上清液备用。
2.3.2 三氟乙酸水解 准确吸取上述溶液2 mL,准确加入0.6 mL市售三氟乙酸,1.4 mL的蒸馏水,使溶液总体积为4.0 mL(三氟乙酸终浓度2mol/L),于110 ℃烘箱中水解4 h;水解后,转移至100 mL圆底烧瓶,加入3 mL甲醇旋转蒸干,重复4次。加超纯水溶解样品,转移至2mL容量瓶中,以制得供试品溶液。
2.4 衍生化产物的制备 准确吸取对照品溶液和供试品溶液各100 μL,加入50 μL的0.6 mol/L NaOH溶液,100 μL的0.5 mol/L PMP甲醇溶液,混匀,在70 ℃烘箱反应90 min;冷却至室温,准确加入100 μL的0.3 mol/L HCL中和,加水定容至2 mL;转移至具塞塑料试管中,加2 mL氯仿,振摇,离心,弃去氯仿相,重复萃取3次,取水相用0.45 μm微孔滤膜过滤,备用,供HPLC分析。
2.5 线性关系的考察 准确吸取各对照品溶液100 μL,各3份,按“2.4项”下进行PMP柱前衍生化,按“2.1项”下色谱条件测定。以葡萄糖浓度为横坐标,峰面积平均值为纵坐标,绘制标准曲线,计算回归方程,为y=41211.2191x-857.2319,r=0.9990。表明葡萄糖在0.52~15.62 mg/mL线性范围内线性关系良好。
2.6 精密度试验 精密吸取供试品溶液20 μL,按“2.1项”下色谱条件重复进样6次。计算太子参中葡萄糖的含量RSD为0.60%,说明该仪器的精密度良好。
2.7 重复性试验 称取太子参(粉碎过3号筛)1.0 g,6份,精密称定,按“2.3项”下方法制备样品溶液,按“2.1项”下的色谱条件进行测定,结果太子参中葡萄糖平均含量为20.22%,RSD为1.64%,结果表明该方法重复性良好。
2.8 稳定性试验 称取太子参(粉碎过3号筛)1.0 g,精密称定,按“2.3项”下方法制备样品溶液,于0 h、6 h、12 h、24 h、48 h,按“2.1项”下的色谱条件进行测定,计算葡萄糖的含量RSD为1.06%,说明该供试品溶液在48 h内稳定。
2.9 加样回收试验 准确吸取已知含量的样品溶液9份,分别加入葡萄糖对照品溶液适量,使得高、中、低浓度对照品加入量与所取供试品中待测定成分量之比为1.5∶1,1∶1,0.5∶1各3份,按“2.3项”下进行PMP柱前衍生化,按“2.1项”下的色谱条件测定,计算回收率。葡萄糖的平均加样回收率为97.96%、99.45%、104.29%。
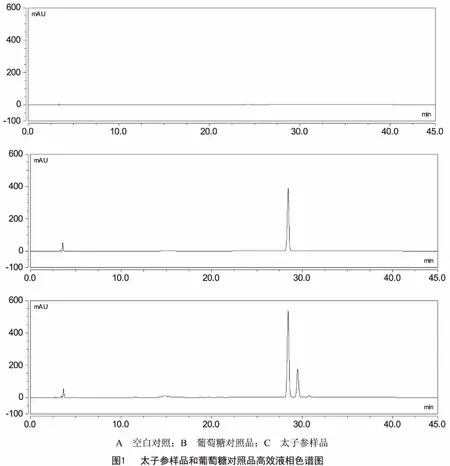
2.10 样品含量测定 分别称取3个批次的太子参1.0 g,精密称定,每个批次平行3份,按“2.3项”下方法制备样品溶液,按“2.1项”下的色谱条件进行测定,计算太子参药材中葡萄糖含量。色谱图如图1所示,结果见表1。
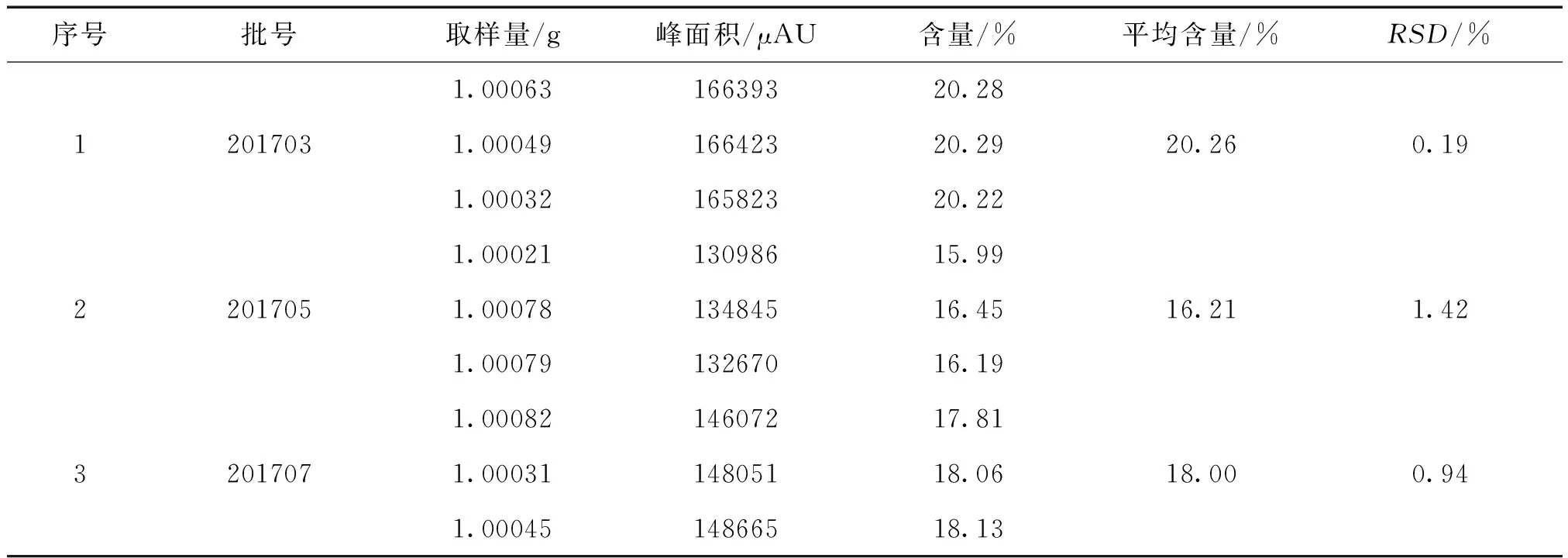
表1 太子参样品葡萄糖含量测定结果
3 讨论
3.1 检测波长的选择 配制一定浓度的葡萄糖对照品溶液,在210~400nm波长内进行全波长扫描,结果发现葡萄糖在250nm处有最大吸收如图2所示,本实验选择250nm波长为检测波长。
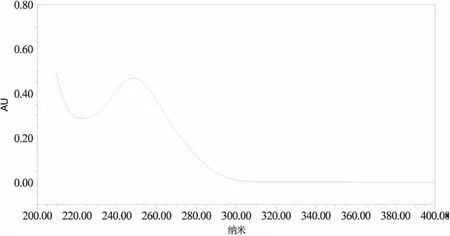
图2 葡萄糖对照品(0.4 mg/mL)210~400 nm波长扫描图
3.2 供试品溶液制备方法的确定 对太子参样品量、提取方法以及提取时间进行考察,筛选出合理的提取方法。采用三氟乙酸水解太子参多糖溶液,将太子参多糖水解为单糖,以PMP为衍生物,在碱性条件下与单糖缩合生成单糖-PMP衍生物,应用高效液相色谱法分析测定太子参中单糖主成分—葡萄糖的含量。
4 结论
综上所述,采用高温强酸水解的方法将太子参多糖水解为单糖,利用PMP对其进行衍生化,将衍生化产物用HPLC分析检测单糖主成分葡萄糖含量。以250 nm为检测波长;大连依利特HypersiL BDS C18色谱柱(4.6 mm×250 mm,5μm);流动相:溶剂A,15%(v/v)乙腈+50 mmol/L磷酸缓冲液(KH2PO4-NaOH,pH 6.9),溶剂B,40%(v/v)乙腈+50 mmol/L磷酸缓冲液(KH2PO4-NaOH,pH 6.9),进行梯度洗脱;建立太子参葡萄糖含量测定方法。本方法重现性好、准确度高,为太子参药材质量标准的完善奠定基础。

