人p65真核表达载体的构建及鉴定
杨莞琦,王瑞峰,程龙,牛畅
1.首都师范大学 生命科学学院,北京 100048;2.军事医学研究院 生物工程研究所,北京 100850
作为抗感染免疫的关键通路,NF-κB信号通路能够被多种信号,包括多种病原的组分如脂多糖,前炎性细胞因子如肿瘤坏死因子(TNF)、白细胞介素 1(IL-1)及丝裂原等活化[1]。NF-κB家族包括 5个成员,即 RelA(p65)、RelB、c-Rel、NF-κB1(p105-p50)和 NF-κB2(p100-p52),它们的 N端均包含一个Rel同源结构域(RHD),这一大约包含300个氨基酸残基的同源序列能够介导其与DNA结合及二聚化[2]。在正常细胞中,NF-κB/Rel与IκBa、IκBb或 IκBg结合,以非活性形式被阻滞在胞质中。当IκB激酶(IKK)复合物活化时,磷酸化IκB家族成员,使其泛素化并被蛋白酶体降解[3-4]。IκB 降解后 NF-κB/Rel被释放,进一步由翻译后修饰(磷酸化、乙酰化、糖基化)作用激活,并转移到细胞核内,在核内单独或联合其他转录因子(AP-1、Ets和Stat)共同诱导下游基因(如IL-6、TNFα、IL-12等)转录,这些下游分子发挥不同的生物学功能,包括先天和适应性免疫、炎症、应激反应、B细胞发育和淋巴器官形成[5-6]。在真核细胞中,NF-κB主要以p50-RelA(p65)异源二聚体的形式存在[7]。已有报道,NF-κB发挥功能需要与其他蛋白的相互作用[8]。为了寻找到更多的NF-κB相互作用蛋白,我们构建了pcDNA3.1-Myc-p65真核表达载体,并对该载体的定位和活性进行了验证,为进一步筛选NF-κB的相互作用蛋白及功能研究奠定了基础。
1 材料和方法
1.1 材料
HEK293T细胞、HeLa细胞、真核表达载体pcDNA3.1-Myc由本实验室保存;大肠杆菌DH5α感受态细胞和LipofectAMINE 2000转染试剂购自Invitrogen公司;PCR试剂、限制性内切酶、T4DNA连接酶及DL2000 DNA marker购自TaKaRa公司;DNA纯化、质粒提取、萤光素酶活性检测试剂盒购自Promega公司;Vigofect转染试剂和Western印迹发光底物试剂盒购自威格拉斯生物技术(北京)有限公司;DMEM培养基和胎牛血清购自浙江天杭生物科技有限公司;DAPI染料购自Sigma公司;Myc抗体、GAPDH抗体、羊抗鼠二抗、羊抗兔二抗购自Santa Cruz公司。
1.2 pcDNA3.1-Myc-p65真核表达载体的构建
根据pcDNA3.1-Myc载体图提供的酶切位点,分别在上、下游引物中加入EcoRⅠ和BamHⅠ酶切位点。根据文献报道[9]的p65编码序列设计上游 引 物(5′-GAATTCTGGCTCGTCTGTAGTGCACG C-3′)和下游引物(5′-GGATCCGGAGCTGATCTG ACTCAGCAG-3′),引物由北京赛百盛生物技术有限公司合成。利用PCR技术,以乳腺癌文库为模板扩增p65基因的编码序列[两步法PCR扩增条件:98℃预变性1 min,30个循环反应(98℃ 10 s,68℃ 2 min),4℃保存]。琼脂糖凝胶电泳鉴定扩增产物大小正确后用胶回收试剂盒回收PCR产物,然后将分别经EcoRⅠ和BamHⅠ双酶切形成粘性末端的PCR片段和pcDNA3.1-Myc空载体,用T4DNA连接酶于16℃连接过夜,连接产物转化大肠杆菌DH5α感受态细胞,37℃培养12 h后挑取LB平板上单个可见菌斑进行菌液PCR鉴定。琼脂糖凝胶电泳显示为阳性的克隆接种于液体LB培养基,37℃培养12 h并提取质粒,所得质粒再经EcoRⅠ和BamHⅠ双酶切鉴定,酶切鉴定结果正确的阳性克隆送样品测序,序列测定由北京博迈德科技发展有限公司完成。
1.3 Westrn印迹检测转染基因的表达
将含10%胎牛血清的DMEM培养基培养的HEK293T细胞接种于六孔板,待细胞密度达60%~80%时,按照VigoFect转染试剂说明书转染对照空载体和重组质粒,48 h后观察转染效率并收集细胞,加入含蛋白酶抑制剂的RIPA细胞裂解液裂解收集到的细胞,蛋白定量后取20 μg蛋白样品进行SDS-PAGE并转移至硝酸纤维素膜上,用5%脱脂奶粉常温下封闭1 h,分别与按一定比例稀释的抗Myc抗体和抗GAPDH抗体室温孵育2 h或4℃孵育过夜,TBST漂洗3次后与HRP标记的羊抗鼠二抗及羊抗兔二抗孵育1 h,TBST漂洗3次后加入发光底物孵育5 min,在暗室中用X线胶片曝光显影。
1.4 免疫荧光
将宫颈癌HeLa细胞接种于放置了圆形玻片的24孔板中,细胞密度达40%~50%时,用LipofectAMINE 2000转染对照空载体和重组质粒,24 h后加入浓度为10 ng/mL的TNFα刺激5 h,弃去细胞培养液,PBS清洗圆形玻片后用3%甲醛(PBS配制)室温固定20 min,PBS洗去甲醛后加入裂解液(0.5%Triton X-100+1%羊血清)置于冰上通透 10 min,用 1%NGS(PBS配制)封闭 30 min,Myc抗体4℃孵育过夜,用1%NGS洗3次后加入荧光素标记的二抗αm448室温孵育2 h,用PBS洗3次后加入DAPI染核5 min,PBS清洗后滴加3~5 μL防淬灭剂封片,荧光显微镜下观察、拍照,4℃暗盒内避光保存。
1.5 萤光素酶活性检测
HEK293T细胞接种于24孔细胞培养板中,待细胞密度达60%~80%时,将重组质粒和NF-κBLuc萤光素酶报告基因质粒按所需比例和用量转染HEK293T细胞,同时每孔均共转染海肾萤光素酶对照报告基因质粒pRL-TK消除转染效率的误差。转染24 h后,加入浓度为10 ng/mL的TNFα刺激5 h,收集细胞加入细胞裂解液,取30 μL裂解上清液加入等体积的萤光素酶检测试剂,用化学发光检测仪检测萤光素酶活性;继续加入30 μL终止液,淬灭反应同时启动海肾萤光素酶反应,测定海肾萤光素酶活性。每组实验均进行3次重复,取平均值做图。
2 结果
2.1 真核表达载体的构建和鉴定
PCR扩增p65基因片段,PCR产物经1%琼脂糖凝胶电泳分离后在约1600 bp处可见明显的扩增条带,与扩增片段大小基本一致。用DNA回收试剂盒回收,将PCR产物与pcDNA3.1-Myc载体同时用EcoRⅠ和BamHⅠ双酶切,酶切产物连接后转化大肠杆菌感受态细胞,挑取单克隆扩增p65基因片段,能够扩增出p65基因的克隆为阳性克隆,培养后提取质粒进一步双酶切鉴定,能够切出p65基因片段的克隆确定为阳性克隆,如图1酶切后得到2条带,约1600 bp的条带是目的条带,约5000 bp的条带是空载体条带。将阳性克隆测序,证实pcDNA3.1-Myc-p65重组质粒插入片段的序列与已报道的p65序列完全一致,表明p65的真核表达载体构建成功。
2.2 Western印迹鉴定pcDNA3.1-Myc-p65的表达
将构建的pcDNA3.1-Myc-p65重组质粒、对照空载体pcDNA3.1-Myc(阴性对照)、pcDNA3.1-Myc-p53(阳性对照)分别瞬时转染HEK293T细胞,48 h收集细胞并用RIPA裂解,提取细胞总蛋白,抗Myc抗体Western印迹检测pcDNA3.1-Mycp65蛋白的表达。从图2可见,转染pcDNA3.1-Myc空载体的细胞没有条带,转染pcDNA3.1-Myc-P53质粒的细胞在相对分子质量53 000处有条带,转染pcDNA3.1-Myc-p65质粒的细胞在65 000处有特异条带,说明构建的pcDNA3.1-Myc-p65重组质粒在蛋白水平得到表达。
2.3 pcDNA3.1-Myc-p65免疫荧光定位
转染了pcDNA3.1-Myc-p65重组质粒的宫颈癌HeLa细胞,经固定、封闭、裂解后用Myc和αm488抗体孵育,DAPI核染色后封片,在荧光显微镜下观察拍照。由图3可知,没有TNFα刺激时,p65主要分布在细胞质中,胞质中的IκB与p65结合抑制了其活性,图中蓝色为DAPI标记的细胞核;加入TNFα后,大部分p65进入细胞核,因为TNFα激活了IKK复合物,该复合物能够磷酸化IκB家族成员,使其泛素化并被蛋白酶体降解,IκB降解后p65被释放,进一步由翻译后修饰(磷酸化、乙酰化、糖基化)作用激活,并转移到细胞核内,激活下游基因的转录。
2.4 pcDNA3.1-Myc-p65萤光素酶报告基因活性检测
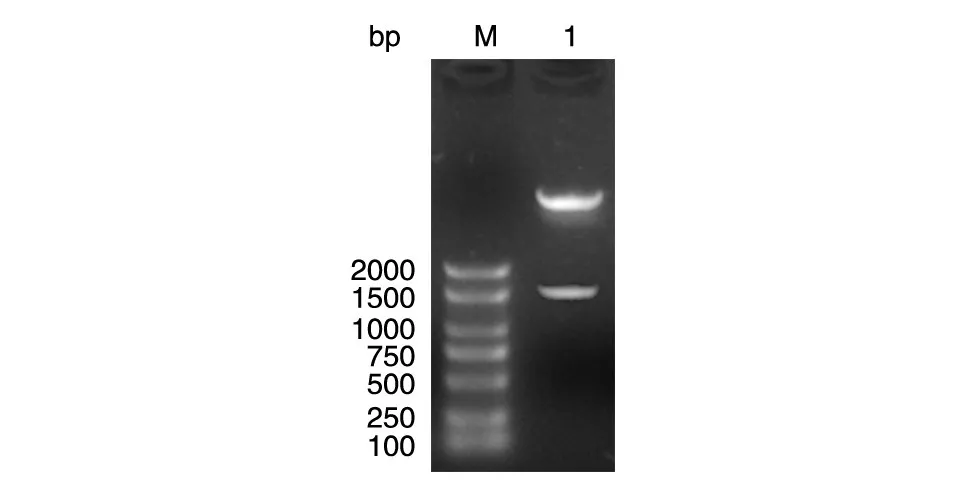
图1 pcDNA3.1-Myc-p65载体的酶切鉴定
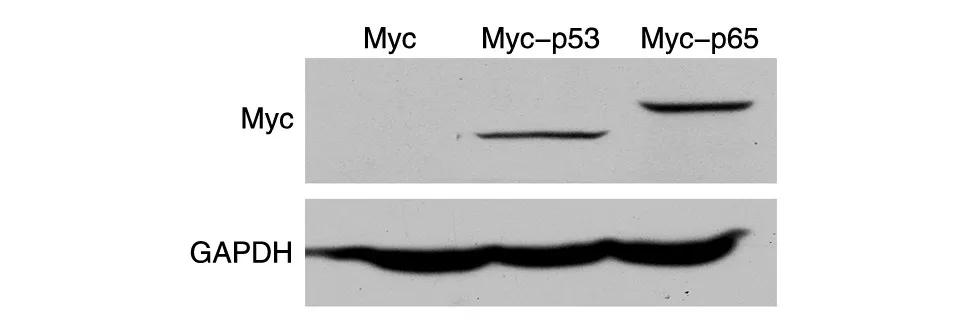
图2 pcDNA3.1-Myc-p65载体的蛋白表达鉴定
pcDNA3.1-Myc-p65重组质粒和NF-κB-luc报告基因共转染HEK293T细胞,24 h后加入10 ng/mL的TNFα刺激5 h,收集细胞,检测萤光素酶活性。结果如图4,p65和TNFα均可以明显激活NF-κB的转录,并且p65是以TNFα不依赖的方式激活NF-κB信号通路活性。
3 讨论
病原相关分子模式(pathogen-associated mo⁃lecular patterns,PAMP)如脂多糖等,炎性细胞因子如TNF、IL-1及丝裂原等信号结合细胞膜上的受体,通过一系列的分子传递,最终激活NF-κB信号通路的转录因子,其中p65被认为是最重要的转录因子。p65发挥功能需要结合一些蛋白,这些蛋白有的促进p65转录活性的发挥,被称为共激活因子,如 p300[10]、AEG-1[11]等;有的抑制 p65的转录活性,被称为共抑制因子,如RAC3[12]、周期蛋白D1[13]、ING4[14]等。为了寻找更多的共调节因子,我们构建了p65的真核表达载体pcDNA3.1-Myc-p65,酶切鉴定和蛋白表达鉴定均提示载体构建成功。
接下来将pcDNA3.1-Myc-p65转染细胞,对其转录翻译出来的Myc-p65蛋白进行了初步验证。首先通过免疫荧光检测其定位,发现Myc-p65蛋白主要定位于细胞质中,在加入TNFα后主要定位于细胞核内。TNFα能激活IKK复合物,活化后的IKK复合物又可以磷酸化NF-κB的抑制分子IκB,磷酸化的IκB蛋白被泛素连接酶复合物SCFβTrCP泛素化,并最终被蛋白酶体降解[4]。这样,原本被结合并滞留在细胞质中的转录因子(p65、c-Rel、RelB、p50、p52等)可以进入细胞核,开启下游基因的转录。上述结果证实构建的Myc-p65的定位与文献报道一致。其次,我们检测了Myc-p65对NF-κB报告基因活性的调节,发现Myc-p65能促进报告基因的活性,且这种促进作用不依赖于TNFα,这与p65的已知功能一致。上述结果均提示Myc-p65能够发挥内源p65相同的功能,可以用于后续相互作用蛋白的筛选。
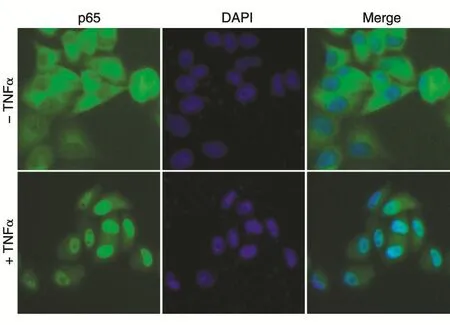
图3 pcDNA3.1-Myc-p65在宫颈癌HeLa细胞中的定位
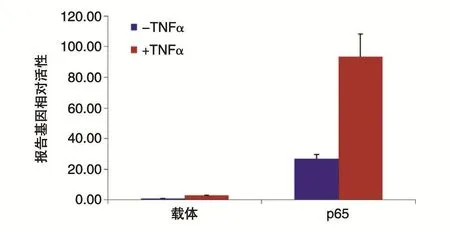
图4 pcDNA3.1-Myc-p65激活NF-κB的转录活性
[1] Tall A R,Yvan-Charvet L.Cholesterol,inflammation and innate immunity[J].Nat Rev Immunol,2015,15(2):104-116.
[2] Hayden M S,Ghosh S.Shared principles in NF-κB signaling[J].Cell,2008,132(3):344-362.
[3] Wang C,Deng L,Hong M,et al.TAK1 is a ubiqui⁃tin-dependentkinaseofMKK and IKK[J].Nature,2001,412(6844):346-351.
[4] Xia Z P,Sun L,Chen X,et al.Direct activation of protein kinases by unanchored polyubiquitin chains[J].Nature,2009,461(7260):114-119.
[5] Perkins N D.Post-translational modifications regulat⁃ing the activity and function of the nuclear factor κB pathway[J].Oncogene.2006,25(51):6717-6730.
[6] Ghosh S,Dass J F.Study of pathway cross-talk inter⁃actions with NF-κB leading to its activation via ubiq⁃uitination or phosphorylation:a brief review[J].Gene,2016,584(1):97-109.
[7] McDonald P P,Cassatella M A.Activation of tran⁃scription factor NF- κB by phagocitic stimuli in hu⁃man neutrophils[J].FEBS Lett,1997,412(3):583-586.
[8] Pahl H L.Activators and target genes of Rel/NF-κB transcription factors[J]. Oncogene, 1999,18(49):6853-6866.
[9] 程欣,王立峰,张健,等.人p65和IKBa基因真核表达载体的构建及在永生化滑膜细胞中的表达[J].第四军医大学学报,2006,27(19):1729-1732.
[10]Zhong H,May M J,Jimi E,et al.The phosphoryla⁃tion status of nuclear NF-κB determines its associa⁃tion with CBP/p300 or HDAC-1[J].Mol Cell,2002,9(3):625-636.
[11]Sarkar D,Park E S,Emdad L,et al.Molecular basis of nuclear factor-κB activation by astrocyte elevated gene-1[J].Cancer Res,2008,68(5):1478-1484.
[12]Wu R C,Qin J,Hashimoto Y,et al.Regulation of SRC-3(pCIP/ACTR/AIB-1/RAC-3/TRAM-1)coactiva⁃tor activity by IκB kinase[J].Mol Cell Biol,2002,22(10):3549-3561.
[13]Rubio M F,Fernandez P N,Alvarado C V,et al.Cy⁃clin D1 is a NF-κB corepressor[J].Biochim Biophys Acta,2012,1823(6):1119-1131.
[14]Nozell S,Laver T,Moseley D,et al.The ING4 tumor suppressor attenuates NF-κB activity at the promoters of target genes[J].Mol Cell Biol,2008,28(21):6632-6645.

