miR-141及MMP-16对骨性关节炎疼痛及软骨损伤的影响
胡 玲,马 垚,胡 冰,余文雄,左 毅
(武汉科技大学附属天佑医院,湖北 武汉 430064)
骨性关节炎(OA)是一种以关节软骨变性、破坏及骨质增生为特征的慢性疼痛性疾病。我国OA患病率约为15%,同时伴随年龄的增长,其患病率不断升高,最终导致残疾[1-2]。近年来的研究表明,微小RNA(miRNA)具有调节软骨发育及维持软骨代谢平衡的作用,通过对其下游多靶点基因的干预,可调节软骨细胞分化、生长和修复,从而影响OA的病变过程[3]。miR-141是OA患者血液中具有高度特异性的miRNAs,其降低与关节软骨细胞凋亡和炎症相关,可影响OA的进展;同时其可通过对炎性因子及神经细胞中致痛因子的调控,从而对OA产生的疼痛具有调节作用[4]。miR-141家族在OA患者软骨组织中的表达明显高于正常组织[5],生物信息学分析发现其能被特定的基质金属蛋白酶-16(MMP-16)所调控而影响骨关节炎的进展。因此如何在早期阻断关节软骨的损伤,减轻或消除疼痛,改善关节功能,降低致残率是OA研究领域中的重要课题。本实验拟通过观察OA模型大鼠背角神经元中miR-141及软骨组织中MMP-16的表达情况来探究它们的相关性及功能意义,以期为OA严重程度的判断及靶向治疗提供新思路和理论依据。
1 实验资料
1.1 动物 健康雄性SD大鼠30只,体质量250~300 g,武汉大学实验动物中心提供。分笼进行饲养,自由饮食。环境温度20~26 ℃,湿度50%~70%,昼夜节律以1∶1进行调节。
1.2 主要试剂和仪器 兔抗大鼠MMP-16抗体(博士德BA1280),兔二步法检测试剂盒(中杉金桥PV-6001);miScript Ⅱ反转录试剂盒(QIAGEN-218161)、miScript SYBR Green PCR 检测试剂盒(QIAGEN-218073)、1% 琼脂糖、漩涡振荡机(江苏海门其林贝尔仪器制造有限公司);Heraguard EC 超净工作台( 美国 Thermo Scientific公司) ;单道可调移液器(德国 Eppendorf 公司);CFX96 荧光定量PCR仪(美国 Bio-Rad 公司);Power Pac Basic 电泳仪(美国 Bio-Rad 公司);水平电泳槽(美国 Bio-Rad 公司)。
1.3 分组及造模 将SD大鼠编号后,随机分为实验组20只和对照组10只。采用苯巴比妥麻醉大鼠,仰卧位固定,以左侧膝关节作为手术侧,常规备皮消毒。髌旁内侧切口显露膝关节,暴露髌骨后向外侧脱位,尽量屈曲膝关节显露前交叉韧带,实验组直视下切断前交叉韧带,抽屉试验确认完全切断后彻底止血,将髌骨复位,1号丝线逐层闭合关节腔。对照组不切断前交叉韧带,其余处理同实验组。术后大鼠手术侧给予固定,分笼饲养,每只大鼠肌注青霉素20万IU/d预防感染,连续术后3 d。
1.4 冷痛阈测定 分别在手术前连续3 d以及手术2,8周后,于每天上午的固定时间点进行测量。测量前将大鼠静置入多孔钢丝笼中,适应环境15 min后,在右侧皮区(右侧为优势区,更加敏感)悬滴0.5 mL冷丙酮,记录滴下冷丙酮后1 min内后爪抓挠皮区或理毛的次数,重复测量3次,每次间隔5 min,取3次记录值的平均值作为冷痛阈值。
1.5 软骨组织病理切片观察 2组分别于手术2,8周后各断颈处死一半大鼠,取2 cm×0.5 cm软骨组织,经生理盐水冲洗后,即行多聚甲醛固定、脱钙、冲洗、脱水、透明、石蜡包埋、切片,通过苏木精-伊红染色观察大鼠骨关节的形态变化。
1.6 背根神经节组织中miR-141表达检测 采用RT-PCR法检测。断颈处死大鼠后取L4—6脊髓组织,分离出双侧脊髓背角组织,提取总RNA,在荧光定量PCR仪上按照标准步骤进行反应。按照反应体系配置说明配备总反应液25 μL:其中2×Quantiect SYBR Green PCR 12.5 μL,10×miscript Universal Primer 2.5 μL,10×miscript Primer Assay 141 2.5 μL,RNase-free water 5 μL,Template CDNA 2.5 μL,每个样本设3个复孔,反应条件为:95 ℃预变5 min,1个循环。15 s 94 ℃,30 s 55 ℃,30 s 70 ℃,40个循环。计算2-ΔΔCT值进行定量分析,2-ΔΔCT值表示目的基因相对表达量。
1.7 MMP-16蛋白表达检测 采用免疫组化法检测。取4 μm厚的软骨组织切片,常规脱蜡至水,0.3% H2O2孵育10 min阻断内源性过氧化物酶。0.01 mol/L PBS冲洗5 min×3次,将切片浸入0.01 mol/L柠檬酸盐抗原修复液(pH=6.0),高压2 min抗原修复,冷却至室温。0.01 mol/L PBS冲洗5 min×3次,滴加一抗(MMP-16浓度为1∶200),4 ℃冰箱孵育过夜。0.01 mol/L PBS冲洗5 min×3次,滴加生物素标记的二抗,室温孵育30 min。0.01 mol/L PBS冲洗5 min×3次,DAB显色,苏木素复染,树胶封片。PBS代替一抗作为阴性对照。镜下阳性细胞核呈深浅不一的棕色,随机10个视野下计数阳性着色细胞。

2 结 果
2.1 手术前后大鼠冷痛阈值比较 手术2,8周后,对照组大鼠对冷丙酮刺激的阳性反应次数未见明显变化(P均>0.05);实验组大鼠对丙酮刺激的阳性反应次数明显高于对照组(P<0.05),并且随着时间的延长,阳性反应次数明显增加(P<0.05)。见表1。

表1 2组大鼠手术前后冷痛阈值比较次)
注:①与手术前1 d比较,P<0.05;②与手术后第2周比较,P<0.05;③与对照组比较,P<0.05。
2.2 大鼠滑膜软骨组织HE染色表现 对照组大鼠假手术2周和8周后HE染色表现无明显变化,软骨细胞形态扁平,排列整齐,结构清晰,无炎性细胞浸润,无充血增生,间质内无纤维化。实验组大鼠手术2周后软骨细胞发生收缩,数量增多、排列紊乱,基质染色减退,此时发生以巨噬细胞、单核细胞、嗜酸性粒细胞为主的急性炎性细胞浸润,可见明显的增生血管和轻度纤维化;手术8周后,大鼠软骨细胞数量明显减少,形态消失,可见成团积聚的炎症细胞出现,同时组织裂隙较深,基质不可染色,出现关节结构的改变。见图1~3。
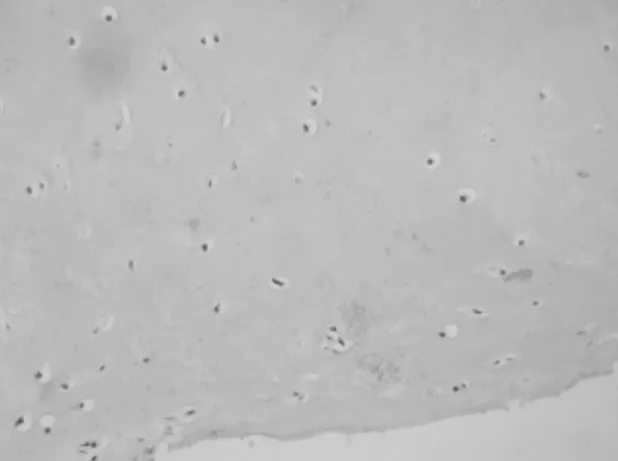
图1 假手术2周后对照组大鼠滑膜软骨组织HE染色表现 (×100)
2.3 大鼠背根神经节组织中miR-141相对表达量 手术2,8周后,实验组大鼠背根神经节组织中miR-141相对表达量均明显高于对照组(P均<0.05),且手术8周后明显高于手术2周后(P<0.05)。见表2。

图2 手术2周后实验组大鼠滑膜软骨组织HE染色表现(×100)
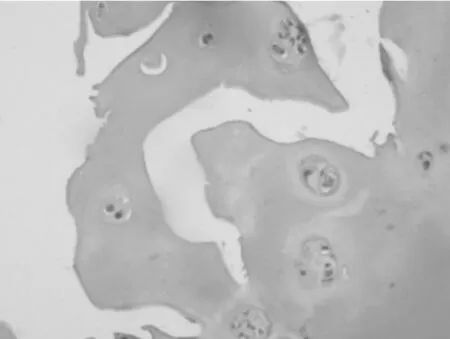
图3 手术8周后实验组大鼠滑膜软骨组织HE染色表现(×100)

组别n手术2周后手术8周后对照组513.43±2.3414.54±3.82实验组1028.54±62.72①34.56±7.98①②
注:①与对照组比较,P<0.05;②与手术2周后比较,P<0.05。
2.4 大鼠软骨组织中MMP-16蛋白表达情况 对照组大鼠假手术2,8周后骨组织中MMP-16蛋白表达量比较差异无统计学意义(P均>0.05);实验组大鼠手术2,8周后骨组织中MMP-16蛋白表达量均明显高于对照组(P均<0.05),且手术8周后明显高于手术2周后(P<0.05)。见图4~6。
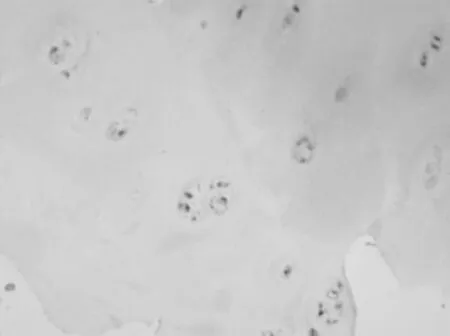
图4 假手术2周后对照组大鼠软骨组织中MMP-16蛋白表达情况(×100)
3 讨 论
OA作为一种累及关节软骨的慢性退行性病变,其病因尚不清楚,患者主要表现为关节疼痛及肿胀,这与软骨及其微环境的合成代谢障碍所致的胞外基质(ECM)退化和关节软骨的损伤有关,随着软骨的破坏、外界机械因素刺激以及游离物质的析出,导致疼痛加剧及关节活动受限,最终出现关节畸形[6-7]。miRNAs是一类长度为22个小核苷酸,来源于内源染色体上的非编码单链RNA,它们在进化上具有高度的保守性,能够通过与靶mRNA特异性的碱基互补配对,引起靶mRNA 降解或抑制其翻译,从而调控基因进行转录后的表达。参与细胞增殖凋亡、器官形成、炎症免疫应答、炎性疼痛、肿瘤发生等进程[8],近年来研究表明miRNAs的表达差异与OA发生、发展过程中关节软骨破坏、软骨细胞凋亡、滑膜炎症以及疼痛等病理变化关系密切[9]。miR-141是一种在软骨组织中表达的miRNAs。张文明[5]发现在成骨过程中,miR-141是成骨负性调节因子,它通过转录后抑制降低Dlx5/Msx2/Runx2信号轴的级联作用,减少成骨表达和成骨作用。申发娟等[10]研究发现miR-141高表达的胃腺癌SGC-901细胞E-cadherin表达增加,N-cadherin、MMP-9表达减少,细胞迁移减少。这些都提示miR-141与骨细胞代谢生长、肿瘤、炎症有密切关系。本实验发现,实验组手术2,8周后背根神经节组织中miR-141表达量均明显高于对照组,且手术8周后高于手术2周后,表明随着OA的发展,miR-141呈现持续上升的趋势。另外手术2周和8周后实验组大鼠对丙酮刺激的阳性反应次数明显高于对照组,且随着病情进展其阳性反应次数明显增加。推测脊髓背根神经元中miR-141升高可以导致OA疼痛的发生,并可反映严重程度。

图5 手术2周后实验组大鼠软骨组织中MMP-16蛋白表达情况(×100)

图6 手术8周后实验组大鼠软骨组织中MMP-16蛋白表达情况(×100)
随着分子生物学的快速发展,MMP-16在OA发病中的作用备受关注。Nobuaki等[11]发现IL-1β通过Wnt16信号通路诱导MMP-16产生并促进成骨细胞的增殖,但在OA患者中发现MMP-16不仅可以降解ECM,而且也可以激活MMP-2在酶原水平上调节细胞外基质降解,这都促进了OA的发展[12]。Zhang等[13]证实下调miR-155可以导致MMP-16的基因表达增加,降解ECM,从而引起椎间盘疾患,而上调MMP-16的表达可达到治疗腰椎间盘突出的作用。本实验发现,实验组大鼠手术2,8周后骨组织中MMP-16蛋白表达量均明显高于对照组,且手术8周后明显高于手术2周。这表明MMP-16在OA的病理过程中起到降解软骨细胞,促进病情发展的作用。
综上所述,在OA的发展过程中,脊髓背角细胞中的miR-141可导致关节疼痛,而MMP-16可以竞争性地降解软骨细胞ECM,促进OA的发展。两者相互作用促进病情的发展,最终可能导致OA晚期出现关节疼痛和畸形,但两者之间如何互相调节还有待于进一步研究。
[1] Min Z,Zhang R,Yao J,et al. MicroRNAs associated with osteoarthritis differently expressed in bone matrix gelatin (BMG) rat model[J]. Int J Clin Exp Med,2015,8(1):1009-1017
[2] Murata K,Furu M,Yoshitomi H,et al. Comprehensive microRNA analysis identifies miR-24 and miR-125a as plasma biomarkers for rheumatoid arthritis[J]. Plos One,2013,8(7): 69118-69120
[3] Alcaraz MJ,Megías J,García-Arnandis I, et al. New molecular targets for the treatment of osteoarthritis[J]. Biochem Pharmacol,2010,80(1):13-21
[4] Shen WS,Xu XQ,et al. Potential mechanisms of microRNA-141-3p to alleviate chronic inflammatory pain by downregulation of downstream target gene HMGB1: in vitro and in vivo studies[J]. Gene Therapy,2017,24(6):353-360
[5] 张文明. miR-141调控OP大鼠BMSCs成骨分化机制及健骨颗粒干预作用研究[D]. 福州:福建中医药大学, 2016
[6] Benito MJ,Veale DJ,FitzGerald O,et al. Synovial tissue inflammation in early and late osteoarthritis[J]. Ann Rheum Dis,2005,64(9):1263-1267
[7]ZeaerstromC,JiangW,WahamaaH,etal.Pivotaladvance:inhibitionofHMGB1nucleartranslocationasamechanismfortheanti-rheumaticeffectsofgoldsodiumthiomalate[J].LeukocBiol,2008,83(1):31-38
[8]StadlerBM,Ruohola-BakerH.SmallRNAs:keepingstemcellsinline[J].Cell,2008,132(4):563-566
[9]ChenB,HuangI.MicroRNAs’involvementinosteoarthritisandtheprospectsfortreatments[J].EvidBasedComplementAlternatMed,2015,10(26):236179
[10] 申发娟,苏娟,张庆瑜,等. 上调miR-200a、miR-141表达对胃腺癌细胞生长的体外研究[J]. 天津医药,2013,41(6):517-519
[11]NobuakiOzeki,MakioMogi,NaokoHase,etal.Wnt16SignalingisrequiredforIL-1β-inducedmatrixmetalloproteinase-16-regulatedproliferationofhumanstemcell-derivedosteoblasticcells[J].IntJMolSci,2016,17(2):221
[12]JungJC,WangPX,ZhangG,etal.Collagenfibrilgrowthduringchickentendondevelopment:matrixmetalloproteinase-2anditsactivation[J].CellTissueRes,2009,336(1):79-89
[13]ZhangWL,ChenYF.RoleofmiR-155intheregulationofMMP-16expressioninintervertebraldiscdegeneration[J].JOrthopRes,2017,35(6):1323-1334

