干热处理对葫芦科种子质量的影响及对黄瓜绿斑驳花叶病毒的防治效果
宋顺华 宫国义 耿丽华* 吴 萍 孟淑春 徐 茂 焦玉英
〔1北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,农业部都市农业(北方)重点实验室,北京 100097;2北京市顺义区种植中心,北京 101300;3北京市延庆区农业技术推广站,北京 102100〕
黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)是葫芦科植物上的重要检疫性病害,病毒主要通过带毒种子进行远距离传播,也可通过病株汁液随着农事操作进行机械传播导致病害的扩展流行。我国辽宁省首次报道了田间西瓜大面积发生CGMMV,发病面积达333 hm2,其中有13 hm2绝收(陈红运 等,2006)。目前,CGMMV在我国很多地区已有分布,生产上以感染瓠瓜(葫芦)、西瓜、黄瓜和南瓜种子较为常见,尤其是葫芦种子带毒更加普遍。在西瓜生产中,CGMMV主要通过砧木种子带毒传播,自然条件下西瓜种子很少带毒,甚至不带毒(蔡明 等,2011)。
为了控制病害的发生,迫切需要有效灭活病毒的带毒种子处理技术和无毒种子生产技术。已有研究表明,热水处理和干热处理是灭活种子中病毒最有效的方法(Ullman et al.,1991;Kim & Lee,2000)。笔者的前期试验研究也表明,72 ℃、72 h干热处理葫芦种子能有效钝化CGMMV(宋顺华等,2015)。西瓜、甜瓜和油菜种子经干热处理后在常温下保存1 a,其活力与处理前没有明显的变化(宋顺华 等,2011)。80 ℃以下的温度处理黄瓜、南瓜和葫芦种子1~7 d,不会影响种子的发芽率,葫芦种子的发芽率还高于未处理的种子(Kubota et al.,2012)。但是不适宜的处理方法会缩短种子的贮藏时间,降低种子活力(孟姗姗 等,2014),而且不同作物种类,甚至不同品种对温度的敏感性也不一样。为了探索葫芦科作物不同种类、同一种类不同品种有效的种子干热处理条件及贮藏对种子活力的影响,本试验以西瓜生产上最常使用的砧木葫芦和南瓜为材料,通过测定种子发芽能力来分析不同的干热处理条件和种子保存温度对不同品种种子活力的影响,以界定不同品种适宜的干热处理温度参数范围和种子保存温度,为实际生产应用提供参考依据;进一步以不同的葫芦砧木种子为材料进行干热处理,通过不同季节和不同生育期的田间种植试验来评价干热处理对CGMMV的防治效果和效果的持续性,为生产上防治CGMMV提供实际依据。
1 材料与方法
1.1 材料
砧木分2种类型,一是葫芦(Lagenaria siceraria)类型,品种为葫芦京欣砧1、葫芦京欣砧2、葫芦京欣砧3、葫芦京欣砧4、葫芦京欣砧5;二是南瓜(Cucurbita moschata)类型,品种为南瓜京欣砧2与南瓜京欣砧8。田间种植试验中,西瓜(Citrullus lanatus)接穗品种分别为超越梦想、京颖-6、墨童2号。试验种子均由京研益农(北京)种业科技有限公司提供。
试剂:CGMMV特异抗体(美国Agdia公司),其他试剂均为国产分析纯试剂。
仪器:MK3酶标仪,芬兰Thermo Labsysterms Multiskan(雷勃)公司产品;恒温干燥箱,上海一恒科技有限公司产品。
1.2 试验方法
1.2.1 变温干热处理 不同处理的种子平铺在单层纱布上,置于恒温干燥箱中,先在35 ℃处理24 h,然后55 ℃处理24 h,接着高温处理72 h,设4个处理温度:68、72、75、80 ℃。高温处理后关掉电源,种子在恒温干燥箱中放置24 h。以不做任何处理的种子为对照(CK)。干热处理完成后,每个处理取400粒种子进行发芽试验。另外,每个处理的种子分成2份,分别装入种子袋,1份放置在室温保存,另1份放置在6 ℃的种子保存箱中保存,葫芦品种保存15个月,南瓜品种保存12个月,之后进行发芽试验。
1.2.2 发芽试验 种子发芽势和发芽率采用GB/T 3543.4—1995《农作物种子检验规程 发芽试验》的方法进行评价,发芽基质为蛭石。播种后放置在温度为25 ℃的恒温培养箱中,16 h光照、8 h黑暗,每处理100粒种子,4次重复。
1.2.3 田间栽培试验 根据笔者前期试验(宋顺华 等,2015),72 ℃、72 h干热处理对葫芦种子CGMMV的灭活效果较好,于是对葫芦京欣砧2、葫芦京欣砧3、葫芦京欣砧4、葫芦京欣砧5的种子进行CGMMV带毒检测和72 ℃、72 h干热处理,处理后的种子进行田间栽培试验。
春季栽培试验:砧木为葫芦京欣砧3,接穗为京颖-6。夏季栽培试验:砧木为葫芦京欣砧3,接穗为超越梦想;砧木分别为葫芦京欣砧2和葫芦京欣砧4,接穗均为京颖-6。春季和夏季栽培试验,每个砧木品种种植1个大棚,600株嫁接苗。长季节栽培试验:砧木分别为葫芦京欣砧5、葫芦京欣砧4、葫芦京欣砧2,接穗均为墨童2号。每个砧木品种种植1个大棚,900株嫁接苗。2015年的春季栽培试验和2014~2016年的夏季栽培试验均在北京顺义区大棚内进行,2015年和2016年的长季节栽培试验在北京延庆区大棚内进行。嫁接苗移栽后,监测整个大田生长期瓜苗的生长情况,如果发现疑似病毒病的植株,采集叶片样本进行DASELISA检测。待西瓜成熟采收后,不同的砧木嫁接植株分别采样,因为不是吊蔓而是爬地栽培,后期植株与植株之间不好区分,因此隔一定的距离采摘1片叶片,采集中上部的叶片,将10片叶片混合成1个样品,进行DAS-ELISA检测。
1.2.4 DAS-ELISA方法检测CGMMV 种子和叶片样本的CGMMV带毒情况采用DAS-ELISA方法(Koenraadt & Remeeus,2014)进行检测。用酶标仪读取OD405,当(样品OD405-空白OD405)/(阴性对照OD405-空白OD405)≥2.0时,判定样品为阳性,否则为阴性。
1.3 数据分析
利用SPSS 13.0单向方差分析模型(one-way ANOVA model)分析数据,利用SNK(Student-Newman-Keuls,P= 0.05)检验平均数差异的显著性。
2 结果与分析
2.1 变温干热处理对不同葫芦科种子活力的影响
试验结果表明(表1),经过68~80 ℃高温处理后,3个葫芦品种种子的发芽势和发芽率与对照没有显著差异,但2个南瓜品种种子的发芽势和发芽率均显著降低,其中,80 ℃高温处理后的种子活力最低。
2.2 不同保存条件对不同葫芦科种子活力的影响
变温干热处理后的葫芦种子分别放置在常温和6 ℃下保存15个月后,种子活力的变化情况见表2。结果表明,3个品种未经变温干热处理的对照种子,不管是在常温还是在6 ℃下保存,其发芽率与保存前都没有显著变化,但发芽势均显著降低。
经过68~80 ℃高温干热处理的葫芦种子,不管是在常温还是在6 ℃下保存,3个品种的发芽势均显著低于对照;在发芽率方面,葫芦京欣砧1以及在常温下保存的葫芦京欣砧2也显著低于对照,葫芦京欣砧3与对照差异不显著(表2)。试验结果表明,变温干热处理能显著降低葫芦种子的发芽势。

表1 变温干热处理对葫芦科种子活力的影响

表2 干热处理后不同保存条件对葫芦种子活力的影响
变温干热处理后的南瓜种子分别放置在常温和6 ℃下保存12个月后,种子活力的变化情况见表3。可以看出,2个南瓜品种未经变温干热处理的对照种子,在常温下保存12个月后,种子的发芽势均显著下降,南瓜京欣砧2和南瓜京欣砧8的发芽势分别从保存前的75%和41%下降到58%和36%;在6 ℃下保存12个月后,2个品种的种子活力没有明显的降低,发芽势和发芽率与保存前没有显著差异。
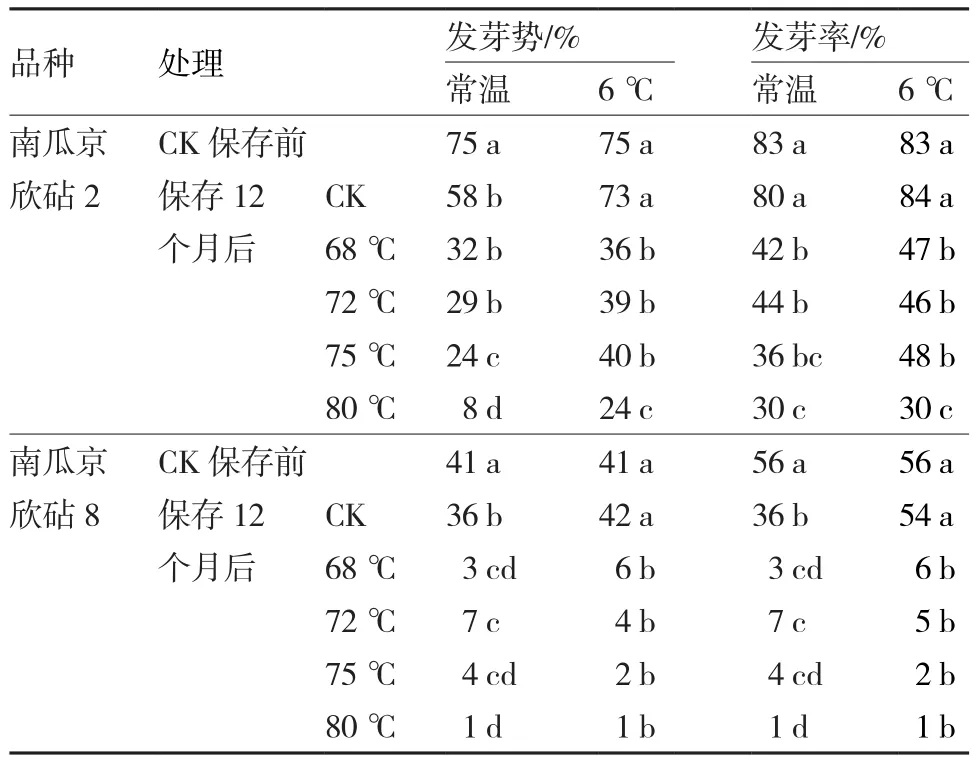
表3 干热处理后不同保存条件对南瓜种子活力的影响
2个南瓜品种种子经变温干热处理后,不管是在6 ℃还是在常温下保存,与未经变温干热处理的对照和保存前相比,种子活力均有所降低,且随着处理温度的增加,其发芽势和发芽率的降低幅度加大。保存前活力较低的种子对高温更加敏感。南瓜京欣砧2和南瓜京欣砧8保存前发芽势分别为75%和41%,发芽率分别为83%和56%,在6 ℃下保存12个月后,南瓜京欣砧2和南瓜京欣砧8种子的发芽势分别下降到24%~36%和 1%~6%,发芽率分别下降到30%~47%和 1%~6%,与对照都具有显著差异。在常温下保存12个月后的种子与6℃保存相似,2个品种种子的发芽势和发芽率在保存后都有不同程度的下降,除68 ℃和72 ℃处理的南瓜京欣砧2种子的发芽势以外,其他所有处理种子的发芽势和发芽率都与对照存在显著差异。
2.3 种子变温干热处理对CGMMV的防治效果
嫁接苗移栽后,对大田生长植株进行病情监测,无论是春大棚、夏大棚还是长季节栽培,田间植株都没有发生CGMMV的可疑症状。
西瓜采收后对田间植株进行叶片采样,室内ELISA检测结果表明(表4),无论是春大棚、夏大棚还是长季节栽培,都没有检测到CGMMV带毒植株。说明种子干热处理用于防治CGMMV是可行的。

表4 不同栽培模式的田间试验结果
3 结论与讨论
CGMMV属于烟草花叶病毒组,是一类非常稳定的病毒,在种子上存活时间长,以种子表面带毒为主(吴会杰 等,2011;宋顺华 等,2015),通过化学药剂(次氯酸钠和磷酸三钠等)和物理方法(热水处理和干热处理)处理比较容易使种子外部的病毒失去活性(Stace-Smith & Hamilton,1988;Hull,2002),但化学处理很难有效地对大粒葫芦科作物种子胚胎中的病原物产生灭菌作用;干热处理时较高的温度能更有效地灭活种子内外的病毒,但过高的温度会伤害种子,较低的水分含量能提高干热处理对种子的安全性,因此,在干热处理前对种子进行预热处理可以保护种子免遭伤害(Shiomi et al.,1991;Imada & Dan,2002;Shirakawa,2002)。本试验采用阶梯式逐步提高处理温度,降低了高温处理时种子的含水量,避免了种子伤害。
高温干热处理后种子的活力还与处理的温度和处理后种子的保存时间有关(Kubota et al.,2012)。从本试验结果来看,68~80 ℃的温度处理种子72 h,不会影响葫芦种子的发芽势和发芽率,但显著降低了南瓜种子的发芽势和发芽率。种子在不同条件下保存一定时间后,种子质量产生不同的变化:与保存前相比,未经干热处理的葫芦种子在不同条件下保存15个月后,发芽率没有降低,但发芽势显著下降;未经干热处理的南瓜种子在低温下保存其发芽势和发芽率要高于常温保存,与保存前没有显著差异。经不同温度的干热处理后,不管是常温还是低温下保存,与未处理种子相比,3个葫芦品种种子的发芽势及葫芦京欣砧1的发芽率显著下降;2个南瓜品种种子的发芽势和发芽率均显著下降(68、72 ℃处理的南瓜京欣砧2常温保存的种子发芽势除外),这可能与试验种子的活力不高有关。本试验结果也说明,干热处理的种子经过一段时间贮存后,大粒的南瓜和葫芦种子的发芽率受到影响,因此,干热处理后的葫芦和南瓜种子宜直接播种,不宜长期贮藏,这也与孟姗姗等(2014)的报道一致。
已有研究表明,不同温度和处理时间的热水和干热处理是目前灭活种子和植株中病毒最有效的方法(Ullman et al.,1991;Kim & Lee,2000)。CGMMV为检疫性病害,对带毒种子和材料有非常严格的控制,应该种植在防虫温室中。笔者之前在防虫温室的实生苗试验结果表明(宋顺华等,2015),72 ℃处理葫芦种子72 h能有效钝化CGMMV。本试验以不同带毒率的葫芦砧木作为试验材料,3种不同栽培模式的田间试验结果表明,种子经过72 ℃干热处理72 h后,在田间栽培均没有发生CGMMV。其中长季节栽培的时间达250 d左右,说明病毒已经被完全钝化而失活。
干热处理作为防治种传病害一种有效的种子处理方法,使用时还应注意以下问题:首先,处理种子的最高温度因作物种类和种子来源不同而稍有差别,温度过高可能会影响种子的质量,因此应针对作物种类和品种摸索不同的干热处理条件;其次,干热处理前要先降低种子的含水量,但在商业种子的处理上不容易操作,费时费力,成本高。一方面需要专门的处理机械,性能好的进口干热处理机械非常昂贵,且商业种子量大,每次处理的种子量太多会影响机器内部通风,难以保证各部位温度均匀一致,影响处理效果;另一方面,每次处理至少费时6 d,处理效率低。
蔡明,江冬,张丽英,李眷,张昆.2011.黄瓜绿斑驳花叶病毒种子处理试验研究.植物检疫,25(1):62-63.
陈红运,赵文军,程毅,李明福,朱水芳.2006.辽中地区花叶病病原的分子鉴定.植物病理学报,36(4):306-309.
孟姗姗,韩之琪,谢学文,柴阿丽,石延霞,李宝聚.2014.贮藏时间对干热处理后带菌黄瓜种子和病原菌的影响.华北农学报,29(s):71-76.
宋顺华、吴萍,郑晓鹰,丁海凤.2011.干热处理对蔬菜种子质量的影响及其杀菌效果研究.河南农业科学,40(4):117-119.
宋顺华,吴萍,宫国义,孟淑春,耿丽华.2015.黄瓜绿斑驳花叶病毒在葫芦上的种传规律及热处理效果评价.植物保护学报,42(5):841-847.
吴会杰,秦碧霞,陈红运,彭斌,蔡建和,古勤生.2011.黄瓜绿斑驳花叶病毒西瓜、甜瓜种子的带毒率和传毒率.中国农业科学,44(7):1527-1532.
Hull R.2002.Matthews’ Plant Virology.Fourth ed.San Diego:Academic Press.
Imada S,Dan K.2002.Development of techniques for avoidance anddecrease of stresses on seeds by disinfection treatments//Ministry of Agriculture,Forest and Fisheries.Development of Methodsto Control Bacterial Fruit Blotch in Watermelons.Tokyo:Ministry of Agriculture,Forest and Fisheries:51-58.
Kim D H,Lee J M.2000.Seed treatment forCucumber green mottle mosaic virus(CGMMV)in gourd(Lagenaria siceraria)seeds and its detection.J Korea Soc Hort Sci,41:1-6.
Koenraadt H M S,Remeeus P M.2014.Detection of squash mosaic virus,Cucumber green mottle mosaic virusandMelon necrotic spot virusin cucurbits//International Seed Testing Association.International Rules for Seeding Testing.Annexe to Chapter 7:Seed Health Testing Methods.Switzerland:International Seed Testing Association.
Kubota M,Hagiwara N,Shirakawa T.2012.Disinfection of seeds of cucurbit crops infested withAcidovorax citrulliwith dry heat treatment.Journal of Phytopathology,160(7/8):364-368.
Shiomi T,Takeuchi S,Tezuka N.1991.Disinfection of cabbage seeds infested with the pathogen of black rot,Xanthomonas campestrispv.campestris,by hot air treatment.Bull Veg Orn Crop Res St,4:9-14.
Shirakawa T.2002.Development of treatment for seed disinfection//Ministry of Agriculture,Forest and Fisheries.Development of Methods to Control Bacterial Fruit Blotch in Watermelons.Tokyo:Ministry of Agriculture,Forest and Fisheries:35-51.
Stace-Smith R,Hamilton R I.1988.Inoculum thresholds of seedborne pathogens-viruses.Phytopathology,78:875-880.
Ullman D E,German T L,McIntosh C E,Williams D D F.1991.Effect of heat treatment on a closterovirus like particle associated with mealybug wilt of pineapple.Plant Dis,75:859-861.

