医疗器械不良事件监测主体责任落实现状及对策研究
【作 者】任文霞,茅鸯对,罗文华,丁静,王雯,朱清
0 引言
医疗器械安全关乎民众健康和生命,21世纪初的“奥美定”事件导致我国近30万人付出了惨痛代价,2007年珠海体外循环管道事件致使数名患者出现肝功能异常症状,2016年眼用全氟丙烷气体群体不良事件再次引起全社会关注。基于风险社会的不确定性,已上市医疗器械依然存在诸多不可预知的安全隐患,只有经广大人群长期使用后才能被发现[1]。为努力让监管工作始终跑在风险前面,切实保证用械安全,我们亟需严格落实监测主体不良事件监测责任,切实做好医疗器械上市后监督管理工作。
1 医疗器械不良事件监测主体责任内涵
根据《医疗器械不良事件监测和再评价管理办法(试行)》(国食药监械〔2008〕766号)的规定,医疗器械不良事件监测主体包括医疗器械生产企业、经营企业和使用单位,国家同时鼓励公民、法人和其他相关社会组织上报不良事件。在机制设计上,医疗器械不良事件监测工作应明确“谁来负责,对何事负责,负责到何种程度”。医疗器械不良事件监测主体应配备专(兼)职监测员开展日常监测工作,履行报告义务,主动发现、收集、调查、分析所有可疑不良事件,并积极主动配合监管部门对事件的调查和处理过程[2]。
2 医疗器械不良事件监测主体履责现状
为深入研究医疗器械不良事件监测工作履职现状,笔者通过专家访谈和问卷调查方式对江、浙、沪三省(市)的医疗器械监管部门、技术机构、生产企业、经营企业和使用单位开展调研工作。其中问卷发放对象包含食药监管部门及直属医疗器械不良事件监测机构或中心50家,一级医院、二级医院、三级医院各40家,医疗器械生产企业和经营企业50家。总共发放问卷220份,回收200份,有效问卷191份,有效率95.5%。综合来看,医疗器械不良事件监测主体履责现状及问题分析如下。
2.1 医疗器械不良事件监测主体表现不佳
食药监管部门受访者认为企业在监测工作中表现十分到位的仅占5.88%,基本到位的占35.29%,不太到位的占50.98%,完全不到位的占7.85%;认为使用单位在监测工作中表现基本到位的占47.06%,不太到位的占49.02%,完全不到位的占3.92%。医疗器械不良事件监测主体履职不到位的主要表现为瞒报漏报(41.18%)、报告不及时(62.75%)、报告填写不完整(64.71%)、报告用语不规范(45.1%)、报告反映情况不真实(29.14%)以及其他(13.73%)。
2.2 医疗器械不良事件监测主体对监测工作认知不足
医疗器械不良事件监测主体责任缺位的根本原因在于其对监测工作的重视程度不够,对监测工作认知不足,使用单位和企业对医疗器械不良事件工作认知程度大部分聚集于完全不清楚和不太清楚。使用单位对相关法规掌握最差,企业对报告表的填写能力最差,两者表现形式有所差异(如图1、图2所示)。
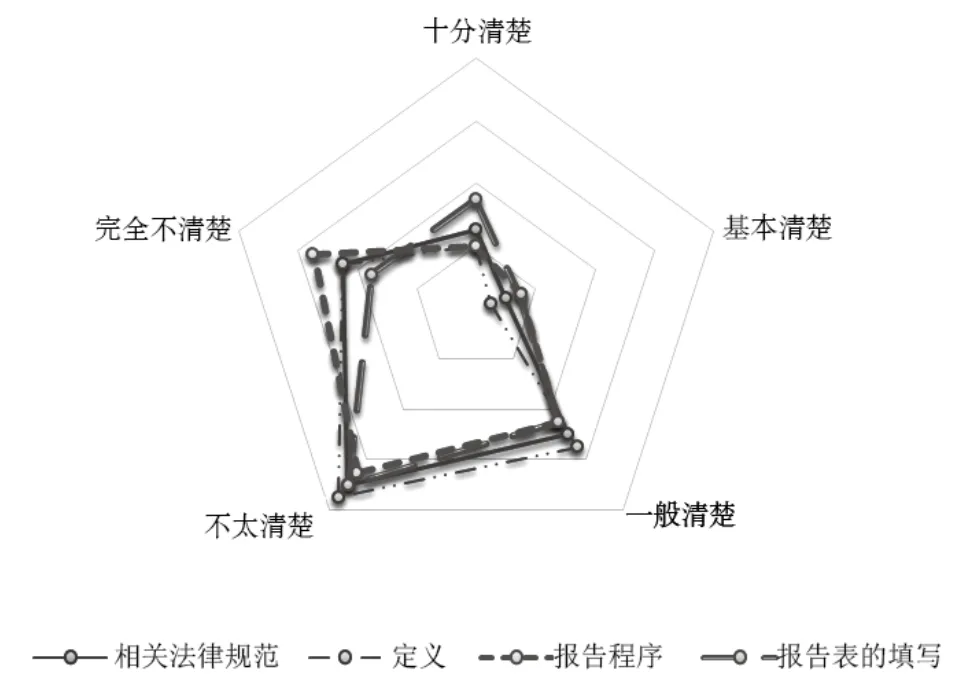
图1 企业对医疗器械不良事件认知情况Fig.1 The cognizance of enterprises to the adverse medical device events

图2 使用单位对医疗器械不良事件认知情况Fig.2 The cognizance of medical institutions to the adverse medical device events
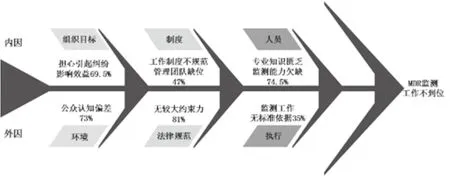
图3 医疗器械不良事件监测履责缺位鱼骨图分析Fig.3 Fishbone diagram analyzing the medical device adverse event monitoring entities
2.3 医疗器械不良事件监测主体履职缺位原因分析
调研发现,医疗器械不良事件监测主体履职不到位的原因具有多样性(见图3),包括内外双重因素。从内因看,组织目标兼容性、制度规范性和人员素质匹配性都有影响;从外因看,则有环境适应性、法律规范和执行有效性等。如果我们将受访对象选择率接近或超过70%作为判断指标,发现关键原因在于现行法律规范对监测主体没有强制约束,上报与否并不会对主体有太大的影响。加之公众认知度差,认为不良事件等同于产品质量事故,企业担心上报不良事件会影响公司效益,医院则害怕引起医患纠纷。上述原因共同导致监测主体监测工作缺乏内生动力,致使政策实施过程中存在诸多瓶颈。
3 落实医疗器械不良事件监测主体责任的对策建议
3.1 全力推动医疗器械不良事件监测主体履职到位
3.1.1 加强医疗器械不良事件监测主体责任意识
首先,积极引导各责任主体开展监测工作,构建医疗器械不良事件监测的培训体系,编写《医疗器械不良事件监测实施指南》和《医疗器械不良事件监测案例库》等操作文件,使主体明确国家法律法规的要求、自身所担负的社会责任,以及医疗器械不良事件监测工作规范化程序。其次,根据医疗器械风险评估分析,对于高风险、重点监测、履责不到位的医疗器械责任主体,医疗器械监管部门可以开展落实主体责任告知约谈会,由各单位负责人认领告知书。最后,针对行业容易犯、经常犯、反复犯的问题制作提示性告知书,与各医疗器械不良事件监测主体签订医疗器械上市后质量安全承诺书,使之牢固树立医疗器械质量安全意识。
3.1.2 推进医疗器械上市许可持有人制度,助力监测工作落实
2017年10月,中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,首次提出要建立由医疗器械上市许可持有人直接报告不良事件的制度和完善医疗器械再评价制度。医疗器械上市许可持有人必须开展全过程监管,实现全程可追溯,同时必须主动上报不良事件,评估产品风险并采取相对应的控制措施[3]。目前上海市率先试点医疗器械注册人制度,符合条件的医疗器械注册证持证人可以委托有资质和生产能力的生产企业进行生产[4],建议尽快出台与各个监管环节相配套的实施细则,针对上市后监管环节,明晰医疗器械不良事件监测工作实施方案和相关约束机制。
3.2 建立医疗器械不良事件监测主体责任评价制度
3.2.1 构建医疗器械不良事件监测主体责任评价模型
医疗器械不良事件监测主体履职效果评价是监管的重要手段,建议构建医疗器械不良事件监测主体责任评价模型(如图4)。主体责任认知可以看作监测主体对不良事件监测工作本身及其在医疗器械全生命周期中作用的理解,主要表现了主体对监测责任的认识水平和重视程度;主体责任行为指的是主体对利益相关者的需求做出的反应;主体责任绩效是指主体履行责任后的结果和效果,反映了利益相关者对主体的总体评价,进一步激励医疗器械不良事件监测主体全面落实责任。
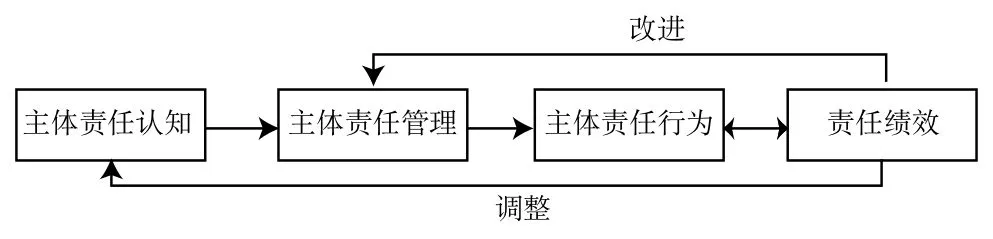
图4 医疗器械不良事件监测主体责任实现过程Fig. 4 The implementation process of the responsibility of monitoring the adverse events of medical devices
3.2.2 开展医疗器械不良事件监测主体责任双重评价
针对医疗器械不良事件监测主体,建立外部和内部双重评价制度。其中外部评价是监管部门对监测主体的综合评价,评价指标体系包括监测制度、监测人员、监测专业化程度、监测报告数量和质量等指标,可考虑将其列入招投标考量的指标,以激励监测主体主动开展不良事件监测、完善不良事件监测体系。内部评价是监测主体将不良事件监测工作纳入职工考核指标,开展奖惩制度考核工作,对于主动上报不良事件的员工,给予一定物质奖励和精神奖励,而对于瞒报、漏报、错报的员工给予相应的惩罚。为了使评价工作有据可依,建议国家加快起草《医疗器械不良事件监测测评管理办法》和《医疗器械不良事件报告审核评价规范》,实现不良事件报告质量评估标准化、统一化。针对监测工作中常见盲区和难点,邀请专家参与不良事件现场调查,邀请审评中心、医疗机构和食药监管部门相关人员定期参加“风险会商”。
3.3 完善医疗器械不良事件监测主体追责制度
3.3.1 实现医疗器械不良事件监测主体追责有法可依
目前针对监测主体没有十分明确的动力机制和约束机制[5],表现在监测主体开展不良事件监测的积极主动性不高、开展的效果缺少评价、对于不进行不良事件监测或不良事件监测不到位的缺少有力的追责。完善法律规范中的法律责任,明确不报、漏报、错报者的法律责任,建议对拒不上报MDR的单位采取警告信、禁令、传讯、起诉、加入失信名单、吊销许可证、停产停业等惩处措施。对于拒不上报死亡不良事件、严重不良事件、群体不良事件等造成恶劣影响的单位予以严重处罚,并对企业质量负责人、使用单位负责人以及不良事件监测负责人予以资格罚,情节严重者追究其刑事责任。对于上报质量不高,或存在谎报、虚报的单位予以公开警示,最终倒逼企业和使用单位实现主体责任工作。
3.3.2 建立医疗器械不良事件基金—保险救济模式
医疗器械不良事件对患者的身体、精神、经济等造成一定损害,严重事件和死亡事件涉及患者的损失更是巨大。患者诉诸于司法诉讼要求生产企业赔偿的难度十分大,即使企业进行赔偿,也会实质性地打击不良事件上报的积极性,陷入不报、瞒报的困境。目前美国、德国、日本、中国台湾等都已建立药品不良反应补偿制度,笔者认为可以借鉴该模式,基于我国国情建立医疗器械不良事件基金—保险救济模式[6],由国家牵头组织政府、医疗器械生产经营企业、医疗机构、社会团体或个人筹集资金作为救济的基金,再利用救济基金向特定的保险公司购买“医疗器械不良事件险”,由此可以转嫁生产经营企业独自承担不良事件赔偿救济的负担,同时承担了重要的社会责任[7]。
3.4 构建医疗器械不良事件监测主体履责的社会共治网
监管部门和监测主体的监测力量有限,建议搭建以行政监管部门、技术支撑机构、行业协会、社会组织为共同体的社会共治网(见图5),形成一股合力。
3.4.1 加大行政监管力度
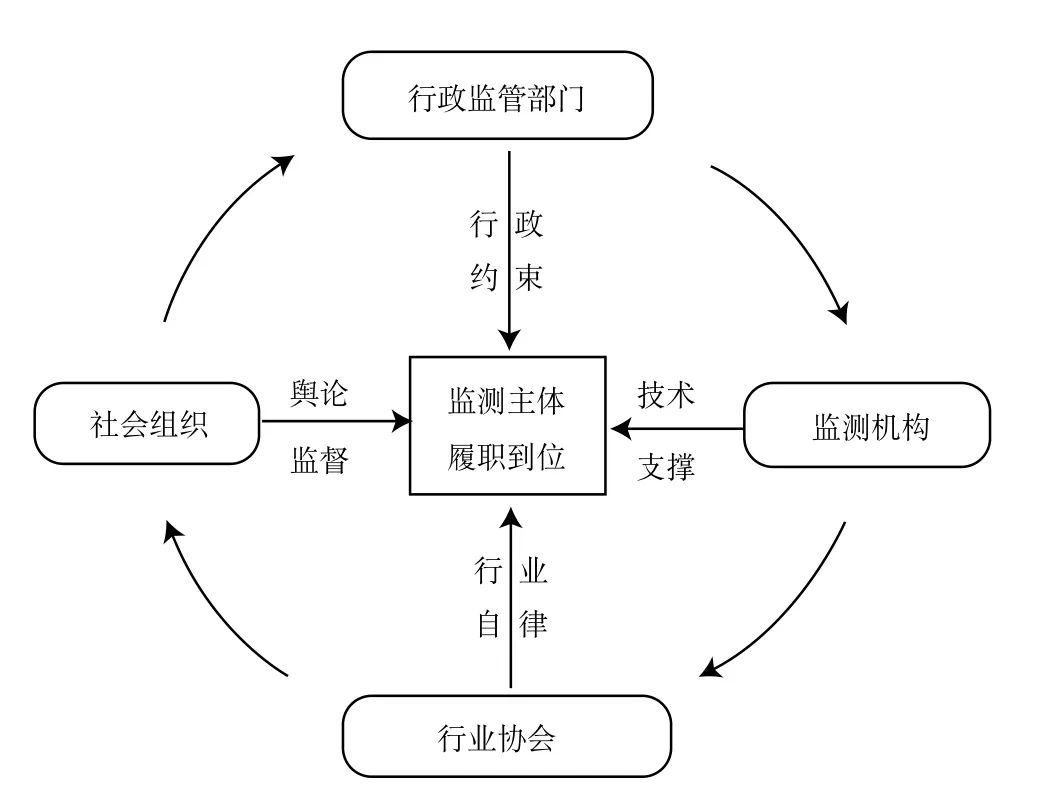
图5 医疗器械不良事件监测社会共治网Fig.5 Social governance model of the adverse medical device events monitoring
全面深化监管体制改革,按照“地方政府负总责”的要求,将医疗器械不良事件监测工作作为关键指标列入各级政府重点工作目标考核。建立食品药品监督管理部门与卫生行政部门的协调工作机制,使两方产生协同效应,形成合力,提高不良事件监测管理工作实效。为适应社会化需要,建立健全监测联动机制,加强与上级机关、认证机构和社会媒体等定期信息沟通,以便形成有效的监管网络,获得强有力的技术支持,增强社会认同。
3.4.2 夯实技术支撑基础
建立内部技术资源协同机制,加强局认证检查中心、医疗器械审评中心、医疗器械质量监督检验机构、医疗器械不良事件监测中心等技术支撑机构的相互衔接协调。要加强技术支撑力量,加强专业化人才队伍建设,编写医疗器械不良事件报告范例,定期开展系统性培训工作,大力推广风险控制理念。建立“国家—省—市”医疗器械不良事件数据共享平台,利用大数据挖掘风险信号,及时反馈给监测主体。在监管部门介入上,要加大监测主体合规性检查力度,在GMP、GSP飞行检查中更加重视不良事件监测相关检查项目,对监测主体的医疗器械不良事件监测制度建设、组织机构和专(兼)职人员在职在岗情况、不良事件监测的上报、调查和处理记录真实性和完整性、医疗器械产品定期的风险评估报告、再评价情况等方面进行全面的摸底检查,找出相应的缺陷并要求整改。
3.4.3 发挥行业协会桥梁作用
要充分发挥行业协会在政府与企业间的纽带、桥梁作用。行业协会要及时发现行业内不良事件监测出现的问题、多倾听企业的声音,将行业内不良事件监测的痛点问题及时汇报给监管部门,畅通监管部门与企业沟通的渠道,开创监管部门与行业企业良性互动的新局面。
3.4.4 调动社会组织力量
拓宽公众监督渠道,畅通不良事件报告、投诉举报的热线,以监管力量下沉为目的,选取基层协管员参与到不良事件监测中来,夯实外部监督力量。社会组织应积极引导大众走出医疗器械不良事件的认识误区,形成一种不良事件上报“常态化”的新舆论环境,为监测主体开展不良事件监测、产品召回等工作减少阻力。
4 小结
医疗器械不良事件监测体系是医疗器械上市后的风险监管,是对产品长期使用效果的真实评估,通过加强监测主体责任意识,建立评价制度和追责制度,构建社会共治网等方式,不仅能够实质性地推动监测工作的开展,还能提高监测工作的质量,提升主体专业监测水平,对聚集医疗器械风险信号,提前预警危害事件,保护公众用械安全,有着重要的现实意义。
[1] 王兰明. 医疗器械不良事件监测与风险管理浅议[J]. 中国药房,2003, 14 (9): 516-519.
[2] 国家食品药品监管总局. 国家食品药品监管总局关于进一步加强医疗器械不良事件监测体系建设的指导意见(食药监械监〔2013〕205号)[EB/OL]. http://www.sda.gov.cn/WS01/CL0845/93174.html.
[3] 中共中央办公厅, 国务院办公厅. 关于深化审评审批制度改革鼓励药品医疗器械创新的意见[EB/OL]. http://www.gov.cn/xinwen/2017-10/08/content_5230105.htm.
[4] 新华社. 上海将率先试点医疗器械注册人制度[EB/OL]. http://www.gov.cn/xinwen/2017-09/13/content_5224844.htm.
[5] 董放, 王刚, 关薇, 等. 我国医疗器械不良事件信息管理机制研究[J]. 中国药物警戒, 2016, 13(3): 148-153.
[6] 冯默, 周志宏, 龙项, 等. 建立我国药品不良反应救济制度的构想[J]. 中国药业, 2010, 19(16): 1-2.
[7] 郭记敏. 我国药品不良反应损害救济模式构建的研究[D]. 郑州:河南中医药大学, 2016.

