蚕蛹蛋白的酶法水解工艺及其口服液的制备
黄美佳,戴 燕,程剑锋,徐玉娟,邹宇晓,李 欣,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.南昌大学食品学院,江西南昌 330047;3.广东省农业科学院蚕业与农产品加工研究所,广东广州 510610)
我国蚕蛹产量居世界首位,资源丰富,同时蚕蛹也是一种营养价值较高的资源,蕴藏着一定的开发价值和经济价值[1-2]。蚕蛹蛋白是一种优质蛋白质,含有人体所需的8种必需氨基酸以及多种生物活性物质,且配比均衡性较好[3-4],在中国、韩国、日本、泰国和印度等亚洲地区成为了一种较受欢迎的食物[5-6]。蚕蛹还富含核黄素、锌、铁、铜等营养素[7-8],含有脑激素、保幼激素等多种具有抑制衰老以及促进生长的激素[9-10]。蛋白酶水解蛋白质是将大分子蛋白水解成小分子肽段的过程,反应条件温和,且能得到更多的免疫活性肽[11-12]。蚕蛹蛋白酶解制备多肽国内已有部分研究,但对本文同时以水解度和小鼠脾细胞的增殖为检测指标进行优化的实验并未研究。免疫活性肽具有缓解疲劳[13],参与人体代谢降低血压等功能[7]。因此蚕蛹具有比较高的营养价值,可以将它作为一种生产具备生物活性功能产品的优质原料[14]。本实验以蚕蛹为原料,采用酶解方法制备蚕蛹蛋白肽,并研制蚕蛹蛋白肽口服液,不仅为特需人群提供营养,也为蚕蛹资源的开发和应用奠定一定的基础。
1 材料与方法
1.1 材料与仪器
蚕蛹(两广二号) 2015年4月购于广东省农业科学院蚕业与农产品加工研究院;BALB/C纯系小白鼠 南昌大学医学院实验动物科;菠萝蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶和风味蛋白酶 南宁庞博生物工程有限公司,蛋白酶酶活均为20万U/g;低分子量Marker 美国Thermo公司;OPA Sigma公司;DTT 上海生工;胎牛血清 美国Gibco公司;RPMI-1640细胞培养基 北京索莱宝公司。
高速冷冻离心机 美国Thermo公司;TU-1901紫外可见分光光度计 北京普析通用仪器有限公司;HJ-A6恒温磁力搅拌水浴锅 常州迈科诺仪器有限公司;CO2细胞培养箱 日本三洋公司;Mode 1860酶标仪、PowerPac 3000电泳仪、Quantity One凝胶成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 蚕蛹蛋白肽酶解工艺的研究
1.2.1.1 蛋白酶的筛选 本实验选用了菠萝蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶和风味蛋白酶这五种蛋白酶对脱脂蚕蛹蛋白进行酶解。将蚕蛹清洗除油制备脱脂蚕蛹蛋白粉[7],称取一定量脱脂蚕蛹蛋白粉,用蒸馏水稀释后搅拌均匀,用食用级的二水合磷酸二氢钠、十二水合磷酸氢二钠调节体系酸度至各蛋白酶最适pH范围,并于恒温水浴锅上搅拌加热恒温至设定温度。迅速加入己准备好的蛋白酶溶液进行酶解,酶解过程中不断滴加二水合磷酸二氢钠或十二水合磷酸氢二钠溶液以保持体系恒定的pH,在水浴中反应15、30、60、90、120、150、180、240 min后取出,沸水浴灭酶10 min后得到蚕蛹蛋白酶解产物,冷却后将酶解液的pH调至7.0,然后以8000 r/min转速离心20 min,取上清液冷藏备用。采用最优蛋白酶酶解制备蚕蛹蛋白肽,以水解度(DH)与淋巴细胞增殖实验为指标,从五种酶中筛选出最佳的蛋白酶。表1是说明书推荐的各蛋白酶酶解的最适条件以及酶活,作为实验条件。

表1 各蛋白酶酶解最适条件Table 1 The optimum conditions of protease hydrolysis
1.2.1.2 碱性蛋白酶酶解脱脂蚕蛹蛋白条件优化 通过碱性蛋白酶单因素预实验确定适宜条件:pH8,加酶量为6.0%,水/底物为20∶1,温度为55 ℃。且酶解温度在55 ℃左右以及加酶量在6%左右对实验结果影响不大,选用酶解时间、酶解pH和水/底物三个因素作为优化的因素,并利用响应面分析法确定最佳酶解条件,设计Box-Behnken中心组合实验,在单因素预实验的基础上确定pH、酶解时间和水与底物比这三个因素的取值范围,如表2。

表2 Box-Behnken中心组合实验的因素和水平Table 2 The factors and levels of the Box-Behnken center combination experiment
1.2.2 水解液的精制 水解液经医用纱布(六层)粗滤,得到酶解液;采用活性炭吸附的方法[7]对酶解液进行脱苦脱色,温度为50 ℃,搅拌脱色处理时间1 h,离心(8000 r/min,20 min);然后脱臭:β-环糊精吸附,至没有难闻的气味为止,离心(8000 r/min,20 min)并用0.45 μm的膜抽滤,使水解液澄清。
1.2.3 蚕蛹口服液的研制
1.2.3.1 工艺流程 蚕蛹→清洗→烘干→磨粉→脱脂→烘干→酶解→纱布粗滤→脱苦脱色→脱臭→调配→灌装→封口→灭菌→口服液→包装。
1.2.3.2 操作要点 混合调配:将蔗糖、柠檬酸按照一定比例加入到精制后的肽液中,即得基本料液;灌装:采用10 mL的口服液瓶子灌装,排气(70~80 ℃,10 min)减少口服液中的空气量,封口机封口,水浴中100 ℃灭菌10~15 min,包装[15]。
1.2.3.3 配方设计 由于蚕蛹蛋白肽具有缓解疲劳,增加免疫力等作用,因此本实验进行了蚕蛹蛋白肽口服液的研制。通过响应面实验确定的蚕蛹蛋白肽酶解最佳工艺条件制备蚕蛹蛋白肽,并按1.2.3.1中工艺流程进行口服液的研制。采用活性炭吸附的方法对酶解液进行脱苦脱色处理,分析0.5%、1.5%、3.0%、5.0%、7.0%的活性碳用量对脱苦结果的影响。用1%、2%、4%、6%、7%β-环糊精吸附对其进行脱臭处理。通过色泽、气味、状态等感官评价为指标进行结果的评定。
通过蔗糖和柠檬酸的含量来调配口服液的口味。蔗糖含量选择2%、4%、6%、8%、10%,柠檬酸含量选择0.1%、0.5%、1%、1.5%、2%。蔗糖的每种含量分别对应于柠檬酸的五种含量,共25组实验,以口服液的口感、色泽、气味、状态等感官评价为指标。
1.2.4 指标测定
1.2.4.1 水解度测定 采用邻苯二甲醛(OPA)法[15-16]。以精氨酸作为标准品,绘制标准曲线。取400 μL样品溶液加入到盛有3 mL OPA的离心管中,混匀5 s,避光反应2 min,同时做空白对照实验,未水解样品(未加酶的蚕蛹蛋白溶液)代替,340 nm下测定吸光值,根据标准曲线计算水解度如下:
h=(ht-hc)×DF
DH(%)=h/htot×100
式中,ht-样品的吸光度从标曲上查得的浓度;hc-对照品(未水解样品)的吸光度从标曲上查得的浓度;htot-全部酶解液(蛋白酶解完全的溶液)的吸光度从标准曲线上查得的浓度;DH-样品的水解度;DF-样品的稀释倍数。
1.2.4.2 免疫活性检测 小鼠淋巴细胞的增殖实验[17-18]。具体方法为:2只5周龄健康的18~20 g BAL B/C小白鼠,颈椎脱臼处死,置于消毒酒精中,10 min后在超静台中解剖分离出小鼠脾脏。然后碾碎并过100目尼龙细胞筛,加入10 mL不完全培养基RPMI-1640,转移至15 mL离心管中,1000 r/min离心5 min后弃上清,重复2次。加入3~4 mL红细胞裂解液,5 min后加入不完全培养基RPMI-1640重悬脾细胞,1000 r/min离心5 min弃上清,重复1次,加入含0.1 mg/mL胎牛血清的完全培养基RPMI-1640约2 mL。向0.15 mL 0.4%台盼蓝染色液中加入等体积的细胞悬液进行细胞计数。稀释细胞浓度为1~2×106cell/mL后,加入到96孔无菌细胞培养板中。蚕蛹酶解液经0.22 μm微孔滤膜过滤除菌,以400 μg/mL浓度加入到细胞培养板中刺激脾细胞。同时设置阴性对照组(灭活的酶溶液)和空白对照组(生理盐水)。培养72 h后每孔加入0.01 mL MTT溶液(0.5%,w/v),继续在CO2细胞培养箱中培养4 h,1000 r/min离心10 min后小心吸去孔内培养液,每孔加入0.1 mL DMSO后置于摇床上低速振荡10 min,使结晶物充分溶解。由酶标仪检测490 nm处的OD值。另设一组阴性对照组和调零孔(不加细胞)。每组设5个复孔,实验重复3次。
1.3 数据处理
所有数据都以平均值的形式表示,每个测试都重复三次,结果采用SPSS statistical软件进行方差分析。
2 结果与分析
2.1 蚕蛹蛋白肽酶解工艺
2.1.1 蛋白酶的筛选 图1~图5分别为风味蛋白酶、菠萝蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶对脱脂蚕蛹蛋白的水解度和免疫活性。从图1~图5中可以看出,风味蛋白酶、碱性蛋白酶和中性蛋白酶对脱脂蚕蛹蛋白的水解度明显高于菠萝蛋白酶和木瓜蛋白酶,其中以碱性蛋白酶对脱脂蚕蛹蛋白的水解度略高于风味蛋白酶、中性蛋白酶。而对于酶解脱脂蚕蛹蛋白肽的免疫活性,碱性蛋白酶和中性蛋白酶明显高于其他三种蛋白酶,其中碱性蛋白酶最大值略高于中性蛋白酶,综合考虑水解度和酶解肽的免疫活性,本实验选用碱性蛋白酶作为酶解脱脂蚕蛹蛋白的优势酶。并由图3可知,当酶解时间选用90 min时,酶解脱脂蚕蛹蛋白肽的免疫活性最强,因此,在后续的对酶解条件的初步优化过程中,选用酶解时间90 min为中心值,进行优化实验。

图1 风味蛋白酶对脱脂蚕蛹蛋白的 水解度和免疫活性的影响Fig.1 Effects of flavourzyme on the degree of hydrolysis and immune activity of the defatted silkworm pupa protein

图2 菠萝蛋白酶对脱脂蚕蛹蛋白的 水解度和免疫活性的影响Fig.2 Effects of bromelain on the degree of hydrolysis and immune activity of the defatted silkworm pupa protein
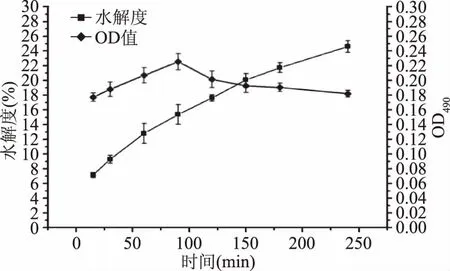
图3 碱性蛋白酶对脱脂蚕蛹蛋白的 水解度和免疫活性的影响Fig.3 Effects of alkaline protease on the degree of hydrolysis and immune activity of the defatted silkworm pupa protein

图4 木瓜蛋白酶对脱脂蚕蛹蛋白的 水解度和免疫活性的影响Fig.4 Effects of papain on the degree of hydrolysis and immune activity of the defatted silkworm pupa protein
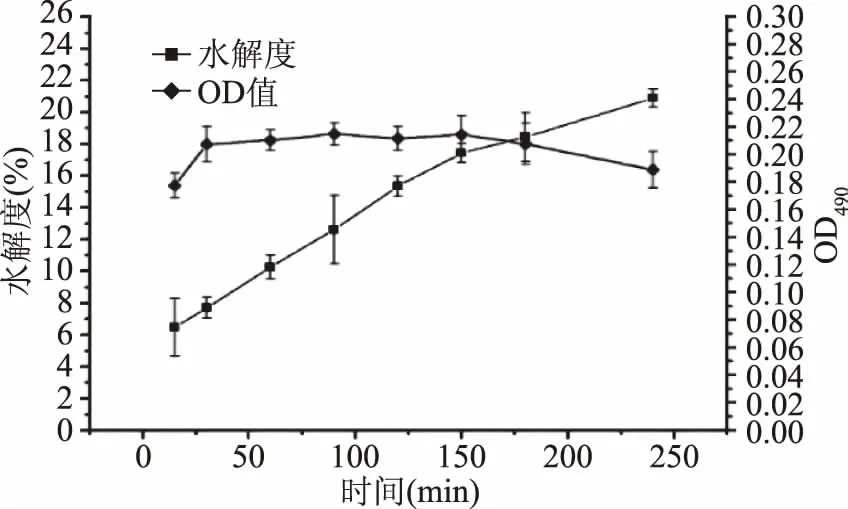
图5 中性蛋白酶对脱脂蚕蛹蛋白的 水解度和免疫活性的影响Fig.5 Effects of neutral protease on the degree of hydrolysis and immune activity of the defatted silkworm pupa protein
2.1.2 碱性蛋白酶酶解脱脂蚕蛹蛋白条件的优化 通过以上对几种蛋白酶的酶解分析,选用碱性蛋白酶对其进行单因素预实验。刘旭辉[19]也用碱性蛋白酶通过单因素实验得出蚕蛹蛋白肽酶解最优工艺条件,但只以水解度作为优化条件,且并没有进行后续的响应面分析。
以脱脂蚕蛹蛋白的水解度和免疫活性(OD490)作为结果值。Box-Behnken实验结果如表3所示,利用软件Design-Expert 8.0对实验数据进行二次多项回归拟合[20-21],得到水解度 R1和免疫活性R2对酶解时间(A)、酶解pH(B)和水/底物(C)三个因素的回归方程:
R1=17.70+3.55A-0.71B-1.15C+0.42AB+0.16AC+0.59BC-0.061A2-1.12B2-2.03C2
R2=0.26+0.00714A+0.0000388B+0.000208C+0.00358AB+0.00463AC+0.00214BC-0.011A2-0.013B2-0.00798C2

表3 Box-Behnken 实验设计和结果Table 3 Experimental design and results of Box-Behnken

表4 水解度回归分析结果Table 4 Regression analysis results of degree of hydrolysis
由回归方程方差分析结果(表4,表5)可知,水解度和免疫活性两个回归模型的p值均小于0.01,说明该模型高度显著(p<0.01),水解度的相关系数为R2=0.9175,免疫活性的相关系数为R2=0.9076,这说明该两个回归方程的可信度高,水解度的失拟项p=0.3257>0.05以及免疫活性的失拟项p=0.3218>0.05,均为不显著,说明该回归方程的拟合度高。由模型的显著性检验可知,对于水解度模型,酶解时间的一次项以及水与底物比的二次项为极显著(p<0.01),水与底物比的一次项和pH的二次项为显著(p<0.05);对于免疫活性模型,酶解时间的一次项和二次项以及pH和水与底物比的二次项为极显著(p<0.01)。由回归方程R1和R2可知,三个因素A、B、C的一次项回归系数的绝对值大小均为A>C>B,这说明酶解时间对碱性蛋白酶酶解脱脂蚕蛹蛋白的水解度以及免疫活性的影响最大,其次为水与底物比,pH影响最小。
根据图6和图7可知,随着酶解时间增加水解度逐渐增加,而酶解液的免疫活性则是先升高,而后下降,而对于pH和水与底物比例,不管是对于水解度还是免疫活性,都呈抛物线形式,先升高后回落。

表5 免疫活性回归分析结果Table 5 Regression analysis results of immune activity

图6 三因素对酶解脱脂蚕蛹蛋白的水解度三维响应面图Fig.6 Three-dimensional response surface of three factors to the degree of hydrolysis of the defatted silkworm pupa protein

图7 三因素对酶解脱脂蚕蛹蛋白的免疫活性三维响应面图Fig.7 Three-dimensional response surface of three factors to the immune activity of the defatted silkworm pupa protein
由软件Design-Expert 8.0对两回归曲线的精确计算,得到碱性蛋白酶酶解脱脂蚕蛹蛋白的最佳工艺参数为:酶解时间1.96 h,pH8.03,水/底物20.16∶1,且在此最佳条件下,预测酶解脱脂蚕蛹蛋白的水解度为20.87%,免疫活性OD490为0.2598。为方便实验条件并验证预测结果的准确性,选取酶解时间2 h,pH8,水/底物20∶1的条件下对脱脂蚕蛹蛋白进行了三次酶解实验,测得的平均水解度为19.96%±1.02%;平均免疫活性OD490为0.2512±0.0125,与模型预测值的较为接近,因此,该响应面对酶解条件的优化准确可靠。
2.2 蚕蛹蛋白肽的精制
采用活性炭吸附的方法对酶解液进行脱苦脱色处理,结果表明3%的活性炭用量效果最好。脱臭结果发现4%β-环糊精吸附效果最佳。
2.3 蚕蛹口服液的研制
蔗糖含量与柠檬酸含量进行感官分析和品尝,得到最佳工艺为:蔗糖量8%,柠檬酸量1%,此时口服液口感良好,具有蚕蛹独特风味。
2.4 产品质量指标
感官指标:淡黄色,澄清,有光泽。
3 结论
通过五种酶的筛选,采用碱性蛋白酶水解制备蚕蛹蛋白肽,通过单因素和响应面实验确定蚕蛹蛋白肽酶解的最佳工艺条件为:酶解温度55 ℃,加酶量6%,酶解时间2 h,pH8,水和底物比20∶1,此条件下水解度为19.96%±1.02%,免疫活性OD490为0.2512±0.0125。酶解可将蚕蛹蛋白分解成小肽段,可能大量破坏其结合表位,既能降低过敏的风险,又能获得活性肽。因此,实验对蚕蛹蛋白的酶解条件对潜在致敏性的研究有重要意义,同时给低致敏蚕蛹口服液提供一定的理论依据。本文以得到的酶解结果进行了蚕蛹免疫活性蛋白肽口服液的研制,得到最佳工艺为:蔗糖量8%,柠檬酸量1%,在此条件制得的口服液口味最佳。这也为特需人群提供了一定的营养价值。
[1]吕秋楠,史高峰,陈学福,等. 脱脂蚕蛹酸水解制备复合氨基酸的工艺研究[J]. 食品科技,2009(10):86-88.
[2]梁贵秋,周晓玲,陆春霞,等. 不同蚕蛹的营养成分分析[J]. 食品工业,2013(12):236-238.
[3]金维维,赵钟兴,刘旭辉,等. 蚕蛹蛋白氨基酸含量的高效液相色谱法测定[J]. 时珍国医国药,2010,21(3):537-539.
[4]刘偲琪. 蚕蛹肽的制备以及功能活性的研究[D]. 山东:山东农业大学,2013.
[5]Zhou J,Han D. Safety evaluation of protein of silkworm(Antheraea pernyi)pupae[J]. Food and Chemical Toxicology,2006,44(7):1123-1130.
[6]Zhou J,Sun X,Xu H,et al. Research progress on silkworm pupae[J]. Special Wild Economic Animal and Plant Research,1996,18(1):38-40.
[7]陈静,郑明珠,王浩. 蚕蛹蛋白肽的制备及其运动饮料研制[J]. 食品科学,2009(14):318-320.
[8]Mattison C P,Grimm C C,Wasserman R L.Invitrodigestion of soluble cashew proteins and characterization of surviving IgE-reactive peptides[J]. Molecular Nutrition and Food Research,2014,58(4):884-893.
[9]余华. 高营养蚕蛹复合氨基酸液的研制[J]. 粮油食品科技,2000,8(4):18.
[10]Hu D,Liu Q,Cui H,et al. Effects of amino acids from selenium-rich silkworm pupas on human hepatoma cells[J]. Life Science,2005,77(17):2098-2110.
[11]杨安树,陈红兵,郑功源,等. 酶法水解蚕蛹蛋白制备免疫活性肽工艺的研究[J]. 食品工业科技,2008,29(1):225-227.
[12]蔡丽丽,陆启玉,钱林. 酶法改性食品蛋白质的研究进展[J]. 粮油加工与食品机械,2006(6):85-87.
[13]徐家玉,吕晓华. 蚕蛹蛋白缓解运动性疲劳的实验研究[J]. 现代预防医学,2008,35(12):2309-2311.
[14]王伟,何国庆,金英哲,等. 蚕蛹蛋白的综合利用现状分析和开发前景展望[J]. 食品与发酵工业,2006,32(9):112-115.
[15]Church F C,Swaisgood H E,Porter D H,et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins1[J]. Journal Dairy Science,1983,66(6):1219-1227.
[16]王艳,龙彩云,夏佳恒,等. 不同酶水解对鸡蛋清蛋白降解和潜在致敏性的影响[J]. 食品工业科技,2016(10):34.
[17]鲍英存,张李峰,程卫东,等. 含红芪与含黄芪玉屏风散含药血清对老龄小鼠脾淋巴细胞增殖和抗衰老作用的比较研究[J]. 中药药理与临床,2012,28(4):3-7.
[18]朱科学,聂少平,李文娟,等. 黑灵芝多糖对小鼠脾淋巴细胞增殖及诱生细胞因子的影响[J]. 食品科学,2010(19):351-354.
[19]刘旭辉.蚕蛹蛋白质酶解制备蚕蛹活性肽的研究[D].广西:广西大学,2012.
[20]金文刚,吴海涛,朱蓓薇,等. 响应面优化虾夷扇贝生殖腺多肽-Ca2+螯合物制备工艺[J]. 食品科学,2013,34(16):11-16.
[21]赵鸿霞,朱蓓薇,周大勇,等. 响应面法优化牡蛎酶解工艺[J]. 大连工业大学学报,2010,29(6):421-425.

