高速射流对木薯淀粉 结构和性能的影响
胡 洋,夏 文,李积华,刘洋洋,王 飞,魏晓奕,林燕云
(1.华中农业大学食品科技学院,湖北武汉 430070;2.中国热带农业科学院农产品加工研究所,广东湛江 524001)
淀粉是最丰富的自然资源之一,它是由α-D-吡喃葡萄糖通过α-1,4糖苷键和α-1,6糖苷键连接而成的天然高分子化合物,大量存在于植物果实、根、块茎等部位,其作为增稠剂、胶凝剂广泛应用于食品加工中[1-3]。我国木薯资源丰富,价格低廉,木薯淀粉作为一种新型的非粮淀粉资源,具有广阔的应用开发前景。天然木薯原淀粉在溶解性、结构稳定性等方面存在不足,因此对木薯淀粉进行改性研究,使之获得某些功能特性具有重要意义[4]。目前淀粉改性方法主要包括三种:物理改性、化学改性和酶改性。物理改性相对简易,在食品加工中已经有较广泛应用,其中高压技术更是一种比较常用的物理改性技术,目前已有学者将其应用于淀粉改性。Che等研究发现随着均质压力增加,淀粉的糊化程度和温度增加,且在处理压力为100 MPa时颗粒尺寸显著变大,但结晶结构无显著变化[5]。Modig等分析了高压均质对疏水改性淀粉的降解,发现高压均质能减小辛烯基琥珀酸淀粉的分子量及分子平均旋转半径[6]。Kasemwong等研究发现高压微射流可使木薯淀粉颗粒表面糊化、糊化焓降低,但是对结晶性无显著影响[7]。Fu等研究发现经过不同次数高速射流处理后的大米淀粉,其溶解度增加、表面结构破坏、结晶度减小,且处理两次后,处理效果明显[8]。据此,本文通过高速射流处理对木薯淀粉的粒度分布、颗粒结构、结晶度、冻融稳定性、溶解性及DSC曲线影响的研究,为高速射流处理在淀粉改性中的应用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
木薯淀粉 水分含量为14.8%,直链淀粉含量为12%,佛山市南海区奇润食品有限公司;无水乙醇 分析纯。
TS 1.1 kw型高压细胞破碎仪 英国Constant Systems Limited公司;Mastersizer 2000型粒度分布仪 英国马尔文仪器有限公司;S-4800型扫描电子显微镜 日本Hitachi 公司;D8 Advance X-射线衍射仪 德国布鲁克公司;TA Q2000型扫描示差量热仪 英国沃特斯公司;Sigma 3-30K型离心机 德国sigma公司;DF-101S集热式恒温磁力搅拌器 巩义市予华仪器有限责任公司;FA2004N型电子天平 上海精密科学仪器有限公司;RB29KBFH1WW/SC型冰箱 苏州三星电子有限公司。
1.2 实验方法
1.2.1 高速射流处理木薯淀粉 在室温条件下,称取500 g木薯淀粉加入1 L蒸馏水配制成浓度为0.5 g/mL的乳液。将淀粉乳液置于高压细胞破碎仪进样盘里,不断搅拌乳液,以不同压力(60、100、140、180、220 MPa)处理样品,每个压力下的样品处理两次。处理后的样品冷冻干燥48 h,再经研磨、过筛,得高速射流处理样品,备用。
1.2.2 粒度分布测定 称取一定量木薯淀粉样品(干基),在测定前用无水乙醇分散,将样品加到有一定量蒸馏水的烧杯中,进行粒度测定[9]。
1.2.3 微观形态观察 将木薯淀粉样品(干基)用导电胶粘在样品座上,并置于离子溅射仪中,在样品表面蒸镀一层铂金膜后,在扫描电子显微镜下进行观察与拍照[10]。
1.2.4 X-射线衍射 采用连续扫描法,用X射线衍射仪对样品进行测定[7]。测定条件:扫描速率0.6 °/min,扫描范围 5~40 °,管压36 kV,管流30 mA。结晶度计算采用峰强度法[11],计算公式如下:
式(1)
式中:I2为2θ=16.20o的衍射强度,表示无定形区的衍射强度;I1=15.20 °的衍射强度,表示结晶区的衍射强度。
1.2.5 冻融稳定性测定 称取一定量的淀粉样品(干基)配制成质量分数为6%的淀粉乳液,置于95 ℃的水浴锅中30 min,随后将糊液放在-18 ℃的冰箱中贮藏24 h,接着在干燥箱中25 ℃条件下解冻2 h,最后在1500×g条件下离心30 min[12],析水率按下式计算。

式(2)
1.2.6 溶解度测定 取30 mL质量分数为1%的淀粉乳液置于50 mL离心管中,在热水浴锅中加热糊化30 min,在2000×g条件下离心20 min,取上清液置于培养皿中105 ℃烘干10 h,称重[13]。

式(3)
1.2.7 DSC测定 取一定量的木薯淀粉样品,置于铝盘中,加一定体积的去离子水(w/v=1∶2),样品盘密封,在室温下平衡24 h。样品以10 ℃/min的速率从20 ℃升温至100 ℃,记录实验结果[14]。
1.3 数据分析
每个样品设3个平行,采用Oringin 8.0和SPSS 19.0软件进行数据分析。测试结果以平均值±标准差来表示。实验数据采用ANOVA进行邓肯氏(Duncan’s)差异分析,以p<0.05为差异显著。
2 结果与分析
2.1 粒度分析
高速射流处理前后木薯淀粉颗粒粒径分布见图1。由图1可以看出,所有样品都只出现一个峰,但是峰的形状变化明显。随着处理压力的增加,峰的高度减小,但峰宽增加,且峰向右偏移,表明颗粒粒度分布变宽,这与表1中的分布宽度数据也是一致的。颗粒粒径分布越窄,峰分布宽度也越小[15],未处理的木薯淀粉的峰分布宽度最小(0.830),随着处理压力的增加,峰的分布宽度明显增加,且处理压力为220 MPa的样品分布宽度最大(2.68)。这可能是由于木薯淀粉经过高速射流处理后,木薯淀粉乳液温度增加[16],引起木薯淀粉分子吸水溶胀和颗粒的聚集[17];另一方面还可能是由于高压导致淀粉的部分糊化,且压力越大,淀粉糊化越明显[18],从而导致粒度增加。这与Kasemwong等[7]的研究结果相似,随着高压微射流处理压力的增加,木薯淀粉的粒径明显增加,是木薯淀粉的部分糊化导致。

图1 高速射流处理木薯淀粉粒径分布Fig.1 Particle size distributions of tapioca starch after HSJ treatment
2.2 微观形态分析
高速射流处理前后木薯淀粉的微观形貌见图2(放大倍数1000倍)。由图2A可以看出,天然木薯淀粉表面光滑呈现不规则形状。当处理压力为60 MPa(图2B)和100 MPa(图2C)时,大部分木薯淀粉颗粒形状保持不变,但是部分颗粒有聚集起来的趋势,这说明低压处理对木薯淀粉结构破坏不明显。当压力为140 MPa(图2D)时,淀粉颗粒表面变得粗糙且有糊状物质粘在颗粒表面。当压力超过180 MPa时(图2E、F),淀粉颗粒表面被破坏明显,且出现片状糊化结构。这些结果表明木薯淀粉在较高压力下高速射流处理,对木薯淀粉颗粒结构破坏明显。同时随着处理压力的增加,淀粉颗粒不断聚集,且木薯淀粉糊化越来越明显,这也证实了之前在粒度分析中的推断。这与Che、Tu等研究蜡质玉米淀粉和木薯淀粉的结果相似[5,19]。

表1 高速射流处理木薯淀粉粒度分析Table 1 Particle size analysis of tapioca starch after HSJ treatment
注:在同一列不同字母表示差异显著(p<0.05);d(0.1)、d(0.5)、d(0.9)代表体积分数分别为10%、50%、90%对应的粒径。
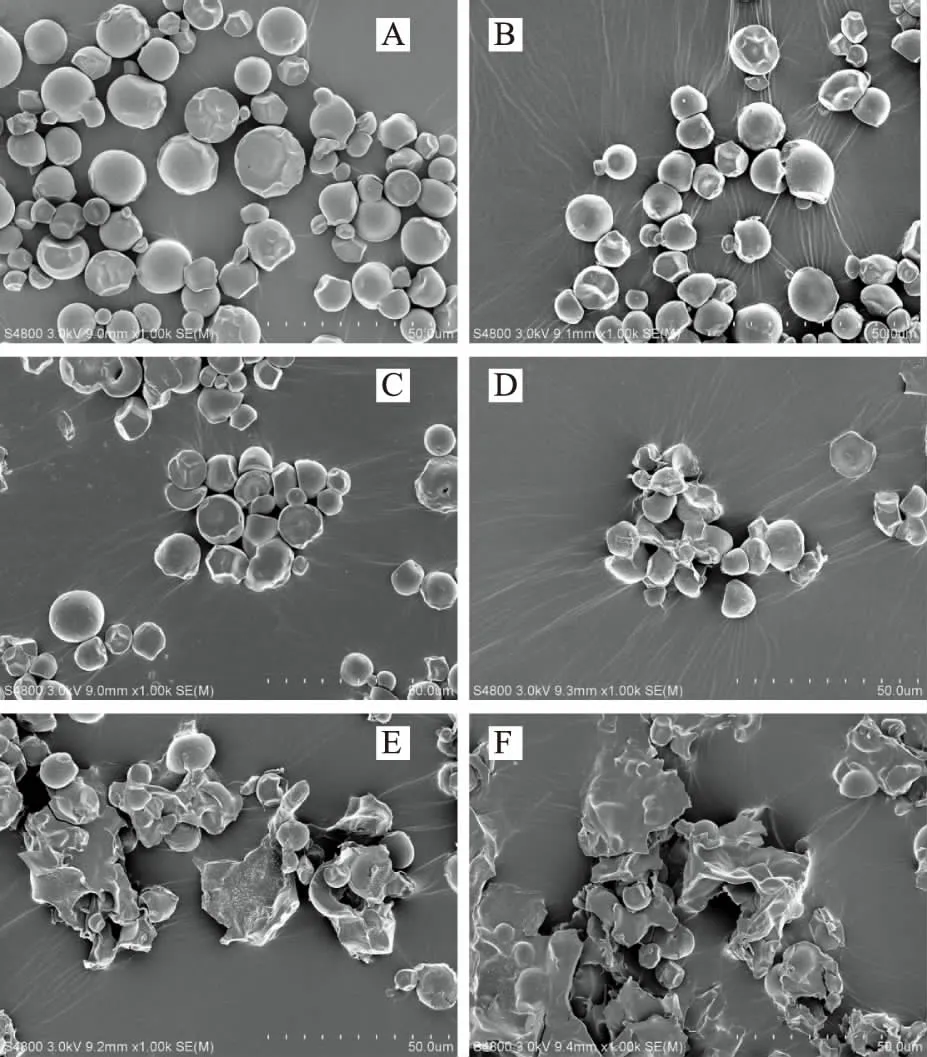
图2 高速射流处理木薯淀粉的扫描电镜照片Fig.2 SEM micrographs of tapioca starch after HSJ treatment 注:A:0 MPa;B:60 MPa;C:100 MPa;D:140 MPa;E:180 MPa;F:220 MPa。
2.3 X-射线衍射分析
高速射流处理前后木薯淀粉X-衍射图如图3所示。X-衍射峰强度及半峰宽变化反映了颗粒结晶度的大小、无定形化程度和晶格畸变等情况。根据淀粉的X-衍射图,可将淀粉分为A、B、C三种类型[20],A型淀粉在2θ值为15、17、18、23 °有强吸收峰,主要为谷物淀粉。B型淀粉在2θ值为5.6、17、22、24 °有强吸收峰;C型为A型和B型的组合[21]。从图3可以看出,天然的木薯淀粉在15.20、17.06、18.10、23.47 °出现强吸收峰,表明其晶体类型为A型;随着高速射流处理压力的增加,晶体类型没有发生改变。但是随着处理压力的增加,吸收峰的强度逐渐降低。这表明淀粉结晶结构的减少,导致结晶度的降低,即结晶度由17.9%(0 MPa)降低到3.1%(220 MPa)(见表2)。Li等研究表明,高静水压处理红豆淀粉随着处理压力增加,吸收峰强度降低。当压力达到600 MPa,吸收峰强度最低[22]。

图3 高速射流处理木薯淀粉的X-射线衍射图Fig.3 The XRD patterns of tapioca starch after HSJ treatment
2.4 高速射流对木薯淀粉冻融稳定性的影响
冻融稳定性是淀粉糊液在冷冻和解冻期间保持水分的能力[23]。高速射流对木薯淀粉冻融稳定性影响如图4所示。从图4可以看出,未经高速射流处理的木薯淀粉表现出最强的冻融稳定性,析水率为5.9%;随着处理压力的增加,木薯淀粉析水率明显增加;当处理压力为220 MPa时,冻融稳定性最差,析水率达52.1%;表明高速射流降低了木薯淀粉的冻融稳定性。这可能是由于高速射流处理对木薯淀粉结构的破坏,空间位阻减少,从而使水分子更容易析出[24]。Li等的研究发现高静水压处理后的红色小豆淀粉糊液的析水率增加[22]。
2.5 高速射流对木薯淀粉溶解度的影响
高速射流对木薯淀粉溶解度影响如图5所示。由图5可以看出,随着高速射流处理压力的增加,木薯淀粉的溶解度增加,即从5.78%(0 MPa)增加到13.82%(220 MPa)。这表明木薯淀粉的溶解度变化对于高压敏感,不同处理压力可得到不同溶解度的淀粉。淀粉的溶解度取决于淀粉来源、颗粒粒径分布、结晶度、糊化程度及直链淀粉脂质复合物[25-26]。高速射流处理提高木薯淀粉的溶解度,可能归因于压力使淀粉颗粒表面结构破坏,降低了淀粉结晶度,从而有利于其与水分子的结合,而增加木薯淀粉的溶解度,这与XRD和SEM分析结果一致。Fu等研究表明高速射流处理次数增加,大米淀粉的溶解度显著增加,从1.85%(0次)到6.20%(2次)[8]。

表2 高速射流处理木薯淀粉的热力学参数和结晶度分析Table 2 The thermal properties parameters and the crystallinity analysis of tapioca starch after HSJ treatment

图4 高速射流处理木薯淀粉冻融稳定性分析Fig.4 Freeze-thaw stability(syneresis) analysis of tapioca starch after HSJ treatment

图5 高速射流处理木薯淀粉溶解度分析Fig.5 Solubility analysis of tapioca starch after HSJ treatment
注:在同一列不同字母表示差异显著(p<0.05)。T0:起始温度;Tp:峰值温度;Tc:终止温度;ΔHg:糊化焓。2.6 高速射流对木薯淀粉DSC曲线的影响
高速射流对木薯淀粉DSC曲线的影响如图6所示。由图6可以看出,所有样品均具有吸热峰且峰强度随着压力的增加逐渐下降。糊化温度、糊化焓在220 MPa达到最小值(见表2)。这可能归因于高速射流处理使得淀粉分子更易与水分子接触,使其溶胀,导致糊化焓值的减小。Wang等发现高压均质处理蜡质玉米淀粉的糊化温度(T0、Tp)和糊化焓值(ΔHg)随着处理压力的增加而降低[27]。由表2可以看出,随着高速射流处理压力的增加,T0(起始温度)、Tp(峰值温度)、Tc(终值温度)以及ΔHg(糊化焓值)逐渐降低,从0 MPa(55.42±0.10、60.30±0.20、73.48±0.40 ℃、2.07±0.01 J/g)减小到220 MPa(50.04±0.20、57.64±0.20、68.05±0.20 ℃、1.47±0.07 J/g),这些结果表明木薯淀粉经过高速射流处理后发生部分糊化,这与SEM观察到的淀粉颗粒部分糊化的结果一致。Blaszczak等研究发现高压均质处理马铃薯淀粉的糊化温度(T0、Tp、Tc)随着处理压力的增加而降低[28]。

图6 高速射流处理对木薯淀粉DSC曲线分析Fig.6 DSC analysis of tapioca starch after HSJ treatment
3 结论
高速射流处理对木薯淀粉的颗粒形貌、淀粉结晶结构、冻融稳定性、溶解性以及DSC曲线有影响。木薯淀粉经较高压力下高速射流处理后,其颗粒结构被严重破坏,呈无规则形态,部分淀粉发生糊化;木薯淀粉溶解度、粒径随着高速射流处理压力的增加而增加,但冻融稳定性降低。木薯淀粉的晶型不受高速射流影响,但结晶度降低。随着高速射流处理压力的增加,起始温度、峰值温度、终止温度及糊化焓逐渐降低。
[1]Hoover R. Composition,molecular structure,and physicochemical properties of tuber and root starches:A review[J].Carbohydrate Polymers,2001,45(3):253-267.
[2]Li Y,Zhang H E,Shoemaker C,et al. Effect of dry heat treatment with xanthan on waxy rice starch[J]. Carbohydrate Polymers,2013,92(2):1647-1652.
[3]Vandeputte G E,Delcour J A. From sucrose to starch granule to starch physical behaviour:A focus on rice starch[J]. Carbohydrate Polymers,2004,58(3):245-266.
[4]邹建,刘亚伟,郑岩,等.交联羟丙基木薯淀粉性质研究[J].食品科学,2006,27(9):79-83.
[5]Che L M,Li D,Wang L J,et al.Effect of high-pressure homogenization on the structure of cassava starch[J]. International Journal of Food Properties,2007,10(4):911-922.
[6]Modig G,Nilssona L,Bergenstahl B,et al. Homogenization-induced degradation of hydrophobically modified starch determined by asymmetrical flow field flow fractionation and multi-angle light scattering[J]. Food Hydrocolloids,2006,20(7):1087-1095.
[7]Kasemwong K,Ruktanonchai U R,Srinuanchai W,et al. Effect of high-pressure microfluidization on the structure of cassava starch granule[J]. Starch/Stärke,2011,63(3):160-170.
[8]Fu Z,Luo S,Bemiller J N,et al. Influence of high-speed jet on solubility,rheological properties,morphology and crystalline structure of rice starch[J]. Starch/Stärke,2015,67(7-8):595-603.
[9]Muramatsu Y,Tagawa A,& Kasai T. Effective thermal conductivity of rice flour and whole and skim milk powder[J]. Journal of Food Science,2005,70(4):279-287.
[10]Xia W,Wang F,Li J,et al. Effect of high speed jet on the physical properties of tapioca starch[J]. Food Hydrocolloids,2015,49:35-41.
[11]黄志成. 菠萝叶纳米纤维素/壳聚糖复合膜的制备及其性能研究[D].湛江:广东海洋大学,2014.
[12]Wu Y,& Seib P L. Acetylated and hydroxypropylated distarch phosphates from waxy barley:paste properties and freeze-thaw stability[J]. Cereal Chemistry,1990,67(2):202-208.
[13]Choi H S,Kim H S,Park C S,et al. Ultra high pressure(UHP)-assisted acetylation of corn starch[J]. Carbohydrate Polymers,2009,78(4):862-868.
[14]Zhang Y J,Liu W,Liu C M,et al. Retrogradation behaviour of high-amylose rice starch prepared by improved extrusion cooking technology[J]. Food Chemistry,2014,158(11):255-261.
[15]Horiba Instruments,Inc(Ed.). A guide book to particle size analysis[M]. Irvine,Californi,2009.
[16]Che L M,Li D,Wang L J,et al. Effect of high pressure homogenization on the structure of cassava starch[J]. International Journal of Food Properties,2007,10(4):911-922.
[17]Jyothi A N,Sasikiran K,Sajeev M S,et al. Gelatinisation properties of cassava starch in the presence of salts,acids and oxidising agents[J]. Starch/Stärke,2005,57(11):547-555.
[18]Blaszczak W,Fornal J,Kiseleva V I,et al. Effect of high pressure on thermal,structural and osmotic properties of waxy maize and Hylon VII starch blends[J]. Carbohydrate Polymers,2007,68(3):387-396.
[19]Tu Z C,Yin Y B,Wang H,et al. Effect of dynamic high-pressure microfluidization on the morphology characteristics and physicochemical properties of maize amylose[J]. Starch/Stärke,2013,65(5-6):390-397.
[20]Herold B,Geyer M,Studman Clifford J. Fruit contact pressure distributions-equipment[J]. Computers and Electronics in Agriculture,2001,32(3):167-179.
[21]Liu D G,Wu Q L,Chen H H,et al. Transitional properties of starch colloid with particle size reduction from micro to nanometer[J]. Journal of Colloid and Interface Science,2009,339(1):117-124.
[22]Li W,Tian X,Liu L,et al. High pressure induced gelatinization of red adzuki bean starch and its effects on starch physicochemical and structural properties[J]. Food Hydrocolloids,2015,45:132-139.
[23]Karim A A,Norziah M H,Seow C C. Methods for the study of starch retrogradation[J]. Food Chemistry,2000,71(1):9-36.
[24]Sui Z,Yao T,Zhao Y,et al. Effects of heat-moisture treatment reaction conditions on the physicochemical and structural properties of maize starch:moisture and length of heating[J]. Food Chemistry,2015,173:1125-1132.
[25]Nunez-Santiago M C,Bello-Perez L A,Tecante A. Swelling-solubility characteristics,granule size distribution and rheological behavior of banana(Musa paradisiaca)starch[J]. Carbohydrate Polymers,2004,56(1):65-75.
[26]Crochet P,Beauxis-Lagrave T,Noel T R,et al. Starch crystal solubility and starch granule gelatinisation[J]. Carbohydrate Research,2005,340(1):107-113.
[27]Wang B,Li D,Wang L J,et al. Effect of high-pressure homogenization on the structure and thermal properties of maize starch[J]. Journal of Food Engineering,2008,87(3):436-444.
[28]W Blaszczak,S Valverde,J Fornal. Effect of high pressure on the structure of potato starch[J]. Carbohydrate Polymers,2005,59(3):377-383.

