香菇多糖积累规律与特性比较
胡 静,雷远征,谭晓妍,秦子芳,但冬梅,宁慧娟,叶彦雄,孙君社,张秀清,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.湖北裕国菇业股份有限公司,湖北随州 441300;3.农业部规划设计研究院,北京 100125)
香菇(Lentinusedodes),属真菌界,担子菌纲,伞菌目,侧耳科,香菇属[1],又名香覃、花菇、香菌[2],是一种药食两用真菌[3],具有重要的医学价值和经济价值。香菇多糖是香菇中主要的活性成分,具有抗肿瘤[4-5]、抗癌[6-7]、抗氧化[8-9]、提高人体免疫力[10]等多重功效,常作为香菇品质评价的重要指标。
目前香菇多采用袋料或段木进行大规模栽培种植[11]。在适宜的管理条件下,香菇一般会出现4~5茬菇,但是由于基质中营养成分流失、生长环境的变化等原因,常常导致不同茬期香菇品质之间出现较大差异,限制了香菇的规范生产及市场发展。张小爽[12]等人分析同一产地不同茬期香菇的营养成分差异,包括水分、灰分、脂肪、蛋白质、氨基酸组成等,得到第三茬香菇总糖含量最高,为不同茬期香菇营养成分评价提供了一定的理论基础。李雪丹[13]等人分析了不同茬期滑子菇中多糖、氨基酸及矿物质等含量的差异,得到第一、二茬滑子菇的营养价值较好。但是在目前的研究中仅分析了不同茬期香菇多糖含量的差异,而对多糖性质方面的分析较少。
本文以不同茬期香菇多糖为考察对象,采用热水浸提法提取香菇多糖,通过苯酚硫酸法及凝胶渗透色谱法[14]对香菇多糖的含量和分子量进行了测定分析,并研究了香菇多糖的抗氧化活性,以期为不同茬期香菇品质研究及后续加工利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
1-3茬香菇样品 湖北裕国菇业有限公司;葡萄糖标准品 纯度≥98%,上海源叶生物科技有限公司;2,2-二苯基-1-苦肼基自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH) Sigma公司;总抗氧化能力测定试剂盒 南京建成生物工程研究所;葡聚糖标准品 中国食品药品检定研究院;浓硫酸、苯酚、三氯化铁、氯仿、邻苯三酚、抗坏血酸、水杨酸等 均为分析纯试剂。
TG16-WS高速离心机 长沙湘仪离心机仪器有限公司;TM-1901型双光束紫外可见光光度计 北京普析通用仪器有限责任公司;RE52CS旋转蒸发仪 上海亚绒生化仪器厂;TYS-100高速多功能粉碎机 浙江省永康市红太阳机电有限公司;BS200S电子天平 北京赛多利斯天平公司;DHG-9240A鼓风干燥箱 上海精宏实验设备有限公司;KQ3200DE型数控超声波清洗器 昆山市超声仪器有限公司;Agilent 1200高效液相色谱仪 安捷伦公司;DZKW-C型恒温水浴锅 北京中科星宇商贸有限公司。
1.2 实验方法
1.2.1 香菇多糖的制备及测定
1.2.1.1 标准曲线的绘制 准确称取10.0 mg烘干至恒重的葡萄糖标准品,用蒸馏水定容至100 mL,配成0.1 mg/mL的标准液。吸取0.1 mg/mL的葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL置于玻璃管中,加蒸馏水补至体积为1.0 mL,继续加入5%的苯酚1.0 mL、浓硫酸5.0 mL,静置10 min后涡旋混匀,待反应液冷却至室温后,于波长490 nm条件下测定其吸光度值,同时做空白对照。以葡萄糖含量(μg)为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线。
1.2.1.2 香菇多糖的制备及含量测定 称取0.5 g粉碎过20目筛的香菇样品,置于50 mL离心管中,加5 mL去离子水及20 mL无水乙醇,涡旋混合均匀,100 W超声提取30 min。提取结束后,4000 r/min离心10 min,弃去上清液,不溶物用10 mL 80%乙醇洗涤、4000 r/min离心10 min。用50 mL去离子水将不溶物转移入圆底烧瓶,100 ℃水浴回流提取2 h,提取结束后冷却、抽滤定容至100 mL,加入4倍体积无水乙醇,4 ℃保存过夜,于4000 r/min离心10 min,取沉淀60 ℃烘干即为香菇多糖样品。取一定量香菇多糖样品加水复溶,按标准曲线绘制方法测定多糖含量[15]。

式中:C为根据标准曲线算出的样品溶液中多糖浓度(mg/mL),V为样品溶液体积(mL),W为样品质量(mg)。
1.2.2 多糖分子量的测定 采用凝胶渗透色谱法(Gel Permeation Chromatography,GPC)测定香菇多糖分子量。色谱条件为:Agilent PL aquageL-OH MIXED-M色谱柱,示差折光检测器,流动相为0.1 mol/L的硝酸钠溶液,流速1.0 mL/min。将不同分子量的葡聚糖标准品(Mw分别为180 Da、9、30、300、2000 kDa)及香菇多糖样品分别进行测定,以保留时间(x)为横坐标,标准品的相对分子质量对数(y)为纵坐标绘制标准曲线,根据标准曲线计算多糖样品的分子量。
1.2.3 抗氧化能力分析 配制多糖溶液浓度为0.5、1.0、1.5、2.0、2.5、3.0 mg/mL,分别测定其Fe3+还原力、DPPH自由基清除能力、OH自由基清除能力、总抗氧化能力(T-AOC)。
1.2.3.1 Fe3+还原力的测定 分别取各浓度多糖溶液200 μL,加入0.2 mol/L pH6.6磷酸缓冲液500 μL、1%铁氰化钾溶液500 μL,混合均匀,50 ℃放置20 min,冷却至室温,加入10%三氯乙酸溶液500 μL,4000 r/min离心10 min,取上清液600 μL,依次加入蒸馏水600 μL和0.1%三氯化铁120 μL,混匀,静置10 min,以蒸馏水作为对照,在700 nm处测定吸光度值[16]。
还原力ΔA=A1-A0
式中:A1为样品组的吸光值;A0为蒸馏水组的吸光值。
1.2.3.2 DPPH自由基清除能力测定 分别取各浓度多糖溶液600 μL与等体积的0. 2 mg/mL的DPPH无水乙醇溶液均匀混合,暗处理30 min后,以蒸馏水为对照,测定其517 nm处吸光值[17]。

式中:A0为600 μL蒸馏水与等体积DPPH反应后的吸光值;A1为600 μL DPPH与等体积蒸馏水反应后的吸光值;A2为600 μL多糖提取液与等体积无水乙醇反应后的吸光值。
1.2.3.3 羟基自由基清除率测定 在离心管中依次加入2 mg/mL硫酸亚铁溶液105 μL,1.5 mg/mL水杨酸-乙醇溶液350 μL,各浓度多糖溶液350 μL、1%的过氧化氢350 μL,混和均匀,37 ℃保温1 h,于526 nm处测定其吸光度值[18]。
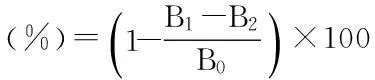
式中:B1为样品组吸光值;B2为无水乙醇溶液代替水杨酸-乙醇溶液的吸光值;B0为蒸馏水代替样品溶液的吸光值。
1.2.3.4 总抗氧化能力(T-AOC)测定 使用T-AOC试剂盒,向离心管中依次加入试剂一溶液0.5 mL、各浓度多糖溶液0.5 mL、试剂二溶液1.0 mL、试剂三溶液0.25 mL,涡旋混匀,37 ℃水浴30 min,随后加入试剂四溶液0.05 mL,放置10 min,于波长520 nm处测定各管吸光度值,同时用蒸馏水做空白实验。
式中:C0为对照组的吸光度;C1为样品组的吸光度;C2为反应液总量,mL;C3为取样量,mL。
1.3 数据处理
采用Excel 2007和SPSS 17.0软件对结果进行作图和统计分析。每组实验至少重复3次(n≥3)。
2 结果与分析
2.1 不同茬期香菇多糖含量分析
根据得到的葡萄糖标准曲线方程y=0.0075x-0.0017(R2=0.9995),计算不同茬期香菇样品中多糖含量。由图1可知,不同茬期香菇多糖含量均在3.0% 以上,其中第一茬香菇多糖含量最高,为5.46%。多糖含量由高到低依次为:第一茬>第二茬>第三茬,且通过统计分析可得,第一茬香菇多糖含量与第二茬、第三茬样品之间存在显著差异(p<0.05)。路芳[19]等人测定了6种不同地区香菇多糖的含量,结果表明吉林黄松甸所产香菇的多糖含量最高,为2.01%,较低于本文香菇样品中多糖含量。

图1 不同茬期香菇多糖含量分析Fig.1 The content of lentinan for different batches 注:不同字母代表差异显著(p<0.05)。
2.2 不同茬期香菇多糖分子量分析
根据得到的标准曲线y=-1.114x+12.79(R2=0.9990),计算不同茬期香菇多糖的分子量。由表1可知,不同茬期香菇多糖为非均一成分,多糖分子量之间存在明显差异。在组分1中,多糖分子量大小依次为第一茬>第二茬>第三茬,其中第一茬香菇多糖分子量为1018 kDa;在组分2中,多糖分子量随着茬期呈现逐渐增高的趋势,第三茬香菇多糖分子量最大,为22.7 kDa。耿安静[20]等人以香菇子实体为原料,测得不同浓度乙醇提取得到的香菇多糖分子量分别为22.67、18.69、6.01 kDa,与本文所得到的香菇多糖组分2中分子量相近。王丽芹[21]采用液体发酵技术培养香菇菌丝体,并测定了发酵液中胞外多糖的分子量,为35.8 kDa。徐晓飞[22]等人测定了6种不同产地香菇多糖的分子量,得到多糖主要组分分子量均在1000 kDa左右,其中东北吉林产地香菇多糖分子量最高,为1653 kDa,与本文所得到的组分1分子量结果基本一致。

表1 不同茬期香菇多糖分子量Table 1 Molecular weight of lentinanfor for different batchs
2.3 不同茬期香菇多糖体外抗氧化活性分析
2.3.1 Fe3+还原力分析 Fe3+还原力是表征天然产物存在抗氧化活性的重要指标。样品的抗氧化能力与其把Fe3+还原为Fe2+的能力呈正相关,还原能力越强则样品的抗氧化能力越强[23]。图2表示不同茬期香菇多糖Fe3+还原力。由图可知,第三茬香菇多糖Fe3+还原力高于第一茬和第二茬香菇多糖。同时随着香菇多糖浓度的增加,其对Fe3+还原力都逐渐增强,说明不同茬期香菇多糖对Fe3+还原力与其浓度呈正相关关系。但总体来说,不同茬期香菇多糖对Fe3+的还原力差别不大,3.0 mg/mL时还原力均在0.3左右。
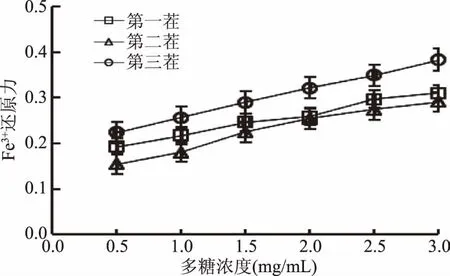
图2 不同茬期香菇多糖Fe3+还原力分析Fig.2 Fe3+ reduction of lentinan for different batches
2.3.2 DPPH自由基清除能力分析 DPPH自由基是少数相对稳定的自由基之一,已被广泛用于评价多糖等抗氧化剂的自由基清除能力[24]。不同茬期香菇多糖对DPPH自由基的清除能力如图3所示。由图可知,香菇多糖对DPPH自由基具有良好的清除能力,并与浓度呈正相关。但不同茬期香菇多糖的清除能力存在差异,由高到低依次为第一茬>第二茬>第三茬。多糖浓度为3.0 mg/mL时,第一茬香菇多糖的清除率显著高于二、三茬,表明第一茬香菇多糖具有更好的转移电子或氢原子的能力。

图3 不同茬期香菇多糖DPPH自由基清除率分析Fig.3 DPPH radical scavenging capacity of lentinan for different batches
2.3.3 OH自由基清除能力分析 OH自由基是公认的自然界中最活泼的自由基,它可以轻易地穿过细胞膜并与细胞内几乎所有的生物大分子(碳水化合物、脂质、蛋白质、DNA)反应,造成细胞损伤从而导致衰老、癌症或其他疾病[25]。由图4可知,浓度为3.0 mg/mL时,第二、三茬香菇多糖具有极高的OH自由基清除能力,达到95.8%和90.2%。而第一茬香菇多糖清除率最低,3.0 mg/mL时仅为49.7%。因此,从清除羟基自由基能力方面讲,第二茬香菇更具有食用价值。另外,邹林武[26]等人发现香菇多糖在2.5 mg/mL时可以清除80%以上的羟基自由基,表明香菇多糖在清除羟基自由基方面的应用价值。
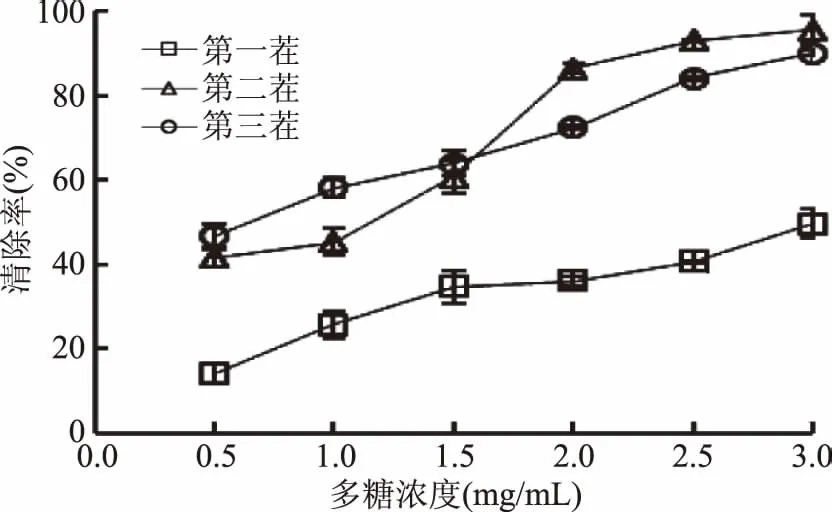
图4 不同茬期香菇多糖羟基自由基清除率分析Fig.4 Hydroxyl radical scavenging capacity of lentinan for different batches
2.3.4 总抗氧化能力分析 总抗氧化能力表征了一个体系中活性大分子的总体抗氧化水平。由图5可知,随着多糖浓度的增加,三个茬期香菇多糖总抗氧化能力都逐渐增强,但不同茬期间总抗氧化能力存在明显差异,其中第三茬香菇多糖总抗氧化能力最高,浓度为3.0 mg/mL时,为1.15 U/mL。但总体来讲,三个茬期香菇多糖在3.0 mg/mL时总抗氧化能力差别不大。
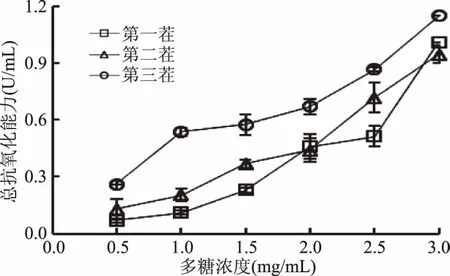
图5 不同茬期香菇多糖总抗氧化活性分析Fig.5 Total antioxidant capacity of lentinan for different batches
3 结论
不同茬期香菇多糖的含量、分子量以及抗氧化能力方面均存在明显差异。多糖含量方面,由高到低依次为第一茬>第二茬>第三茬,最高达5.46%;分子量方面,三个茬期香菇多糖均含有两种多糖组分,且组分一呈现随茬期增加分子量递减的趋势,组分二呈现分子量递增趋势。多糖分子量的变化对其抗氧化活性有一定影响。分析Fe3+还原力、DPPH清除率、羟基自由基清除率和总抗氧化能力四个体外抗氧化指标发现,第一茬香菇多糖具有较高的DPPH清除能力,第二茬香菇多糖具有极高的羟基自由基清除能力。虽然第三茬香菇多糖在Fe3+还原力和总抗氧化能力方面存在一定优势,但与其他两组差别不大。因此,认为第一茬和第二茬香菇具有更高的抗氧化作用。本研究为不同茬期香菇、香菇多糖品质评价及应用提供了一定的理论基础。
[1]Chen L F,Gong Y,Cai Y,et al. Genome sequence of the edible cultivated mushroom Lentinula edodes(Shiitake)reveals insights into lignocellulose degradation[J]. Plos One,2016,11(8):eo160336.
[2]陈文强,乔艳明. 响应面法在香菇液体种生产工艺优化中的应用[J]. 食品工业科技,2015,36(18):290-294.
[3]Zhuang H,Chen Z,Tao F,et al. Characterization of Lentinus edodes,β-glucan influencing theinvitro,starch digestibility of wheat starch gel[J]. Food Chemistry,2017,224:294-301.
[4]王彦硕,黄叶梅,刘红梅,等. 香菇多糖抗肿瘤作用机理分析及临床应用探讨[J]. 医药卫生:文摘版,2016(5):221.
[5]Zhang Y,Gu M,Wang K P,et al. Structure,chain conformation and antitumor activity of a novel polysaccharide from Lentinus edodes[J]. Fitoterapia,2010,81(8):1163-1170.
[6]戴尔珣,汪步海,戴金梁,等. 香菇多糖诱导CIK细胞对肺癌A549细胞杀伤作用的研究[J]. 江苏中医药,2016,48(6):71-74.
[7]冯燕,全吉钟,王冬旭,等. 香菇多糖抗胃癌机制研究[J]. 中国实验诊断学,2011,15(11):1829-1831.
[8]杨溢烁,曾德永,刘艳,等. 香菇多糖体内抗氧化活性研究[J]. 中国食物与营养,2016,22(8):72-74.
[9]You R,Wang K,Liu J,et al. A comparison study between different molecular weight polysaccharides derived from Lentinus edodes and their antioxidant activitiesinvivo[J]. Pharmaceutical Biology,2011,49(12):1298-1305.
[10]黄益丽,廖鑫凯,李清彪,等. 香菇多糖的生物活性[J]. 生命的化学,2001,21(5):371-373
[11]吴学谦,汪奎宏,朱光权,等. 香菇节木栽培基质生物降解规律的研究[J]. 中国食用菌,2002,21(4):13-16.
[12]张小爽,徐晓飞,张丙青,等. 不同潮期香菇营养成分的比较研究[J]. 现代食品科技,2012,28(6):691-694.
[13]李雪丹. 滑子菇不同茬期营养成分的测定及其多糖的提取纯化研究[D]. 保定:河北农业大学,2015.
[14]耿安静,陈健,徐晓飞. GPC法测定香菇多糖的含量及相对分子质量[J]. 现代食品科技,2009,25(4):458-460.
[15]中华人民共和国农业部. NY/T 1676-2008 食用菌中粗多糖含量的测定[S]. 北京:中国农业出版社,2008.
[16]宋思圆,苏平,王丽娟,等. 响应面实验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J]. 食品科学,2017,38(2):283-289.
[17]Nagarajan K,Singh S,Taleuzzaman,et al. Assessment of anti-oxidant potency of small chain glycopeptides using DPPH free
radical scavenging assay[J]. Journal of Pharmacy and Nutrition Sciences,2012,2(2):178-190.
[18]卢化,张义生,郭胜男,等. 银木总黄酮体外抗氧化活性研究[J]. 中国药师,2015(4):555-557.
[19]路芳,王秋香,王月珍. 不同产地香菇中多糖及嘌呤含量情况比较研究[J]. 黑龙江科技信息,2013(7):79.
[20]耿安静. 香菇多糖的制备、结构特性和生物活性的研究[D]. 广州:华南理工大学,2010.
[21]王丽芹. 香菇SD-08菌株多糖及其降解产物的提取、结构及抗氧化抗衰老活性研究[D]. 泰安:山东农业大学,2015.
[22]徐晓飞,张丙青,罗珍,等. 不同产地香菇营养成分的比较研究[J]. 食用菌,2012(2):57-59.
[23]Gao J,Zhang T,Jin Z Y,et al. Structural characterisation,physicochemical properties and antioxidant activity of polysaccharide from Lilium lancifolium Thunb[J]. Food Chemistry,2015,169:430-438.
[24]Song H F,Zhang Q B,Zhang Z S,et al.Invitroantioxidant activity of polysaccharides extracted from Bryopsis plumosa[J]. Carbohydrate Polymers,2010,80(4):1057-1061.
[25]Cheng Z,Zhang Y,Song H,et al. Extraction optimization,characterization and antioxidant activity of polysaccharide from Gentiana scabra bge[J]. International Journal of Biological Macromolecules,2016,93:369.
[26]邹林武,赵谋明,游丽君. 香菇多糖提取工艺的优化及其抗氧化活性研究[J]. 食品工业科技,2013,34(19):177-182.

