污泥热解液与牛粪混合厌氧消化特性研究
杨 敏,陈德珍,戴晓虎 (.同济大学机械学院,热能与环境研究所,上海 20804;2.城市污染控制国家工程研究中心,同济大学环境科学与工程学院,上海 200092)
污泥热解是一种正在快速发展的污泥减量化、无害化和资源化处置方式,是指将污泥在无氧的中低温加热条件下(350~700℃)分解为不冷凝气体、可凝结挥发性物质(包括水,水溶性有机物和不溶于水的有机物)和半焦三相产物的过程[1-2].其中,不冷凝气体的热值较高,可以作为燃气利用;半焦具有孔状结构,可作为廉价的吸附剂或催化剂[3].可凝挥发性物质冷凝形成的热解液,成分复杂,质量接近污泥干质量的1/3,理论上经处理后可做化工原料和燃料,但是由于往往和大量的水蒸汽一起冷凝,最终形成的热解液含水量高、成分复杂,作为化工原料和燃料的实际应用价值非常低.前人对污泥热解液的研究多集中在热解液的制取工况、产率[4],热解油的主要成分、生成机理[5-6],以及如何提高其产率、热值和品质等问题上[7],鲜少关注其最终的利用与处理,仅有少量的蒸馏浓缩[8]等研究报导.实际上,污泥热解液因化合物种类繁多,具有特殊的焦臭味,热值较低,且有一定毒性[9],利用困难;而直接排放有害,需要处置.但因水分含量高,用焚烧手段处理成本高,亟需寻找合适的处理方式才能使热解技术得到广泛应用.
热解液含有大量有机物,具有能量回收价值.如果能采用厌氧消化的方式处理,则既处理了热解液、又回收了高品质的能源.Torri等[10]将400℃热解温度下生成的玉米秸秆热解液去除焦油后与热解炭混合,加入接种液和其他养分,在40℃下进行厌氧发酵,发现热解液抑制了厌氧发酵进程,但热解炭的添加能够降低这种抑制作用.Willner等[11]将木材闪速热解获得的热解油进行了厌氧消化试验,发现它们中的大部分有机组分减少了,包括一些有害成分,如苯酚.Hübner等[12]先对生物质进行厌氧发酵(40℃),再将沼渣进行热解,获得不同温度(330,430, 530℃)的热解液,将其中水相部分循环回到厌氧发酵反应器中,发现水相热解液经厌氧发酵能产生甲烷,且其中的挥发性有机污染物(VOCS)含量也能降低到一定程度;并发现330、430℃热解液的水相部分中COD和TOC的去除率都比530℃高.Fabbri等[13]提出将生物质热解产生的气、液、炭三组分均放入发酵罐进行厌氧发酵的构想,但是没有实施.尽管针对生物质热解液的厌氧发酵的相关研究有所报道,但污泥成分复杂,含N量更高,还存在重金属和含Cl有机物,关于其热解液厌氧发酵处理的研究尚未见报道.
本文首次将污泥热解液与牛粪进行了混合厌氧发酵(55℃)的研究.从热解温度、热解液的成分、厌氧发酵的产气特性、沼液成分变化等方面进行系统分析;以探究污泥热解液进行厌氧发酵处理的可能行,分析热解液中的有机污染物能否被降解,为污泥热解液的处理和利用提供一种新途径.牛粪是厌氧发酵的良好原料,因其自身携带菌种,有良好的发酵性能,可以促进厌氧发酵反应的快速启动[14],因此选为和污泥热解液混合发酵的基础物质.
1 材料与方法
1.1 原料预处理及其特性
为了获得不同热解温度下的污泥热解液进行发酵试验,采用固定床热解炉,通过定量污泥分批多次热解的方式来获取污泥热解液.试验污泥取自上海市嘉定区某污水处理厂,于阳光房内曝晒一周,机械破碎,过筛并保留粒径小于2.36mm的颗粒.每次用量为350g.实验时以氮气为载气,在升温速率15~20℃/min的条件下,设置热解终温分别为250,350,450和550℃,并在终温下停留30min,将挥发分于冰水浴中冷凝来收集热解液(SS-PL,含水);各热解温度下获得的热解液均冷藏于4℃的冰箱中待用.新鲜牛粪取自浙江省某农家自养牛场,过4.75mm筛,放入冰箱4℃冷藏.接种液取自上海市杨浦区曲阳污水处理厂厌氧池.表1为用于制取热解液的污泥特性.表2是用于厌氧发酵的原材料的理化性质.

表1 热解污泥的特性Table 1 Properties of sewage sludge for pyrolysis
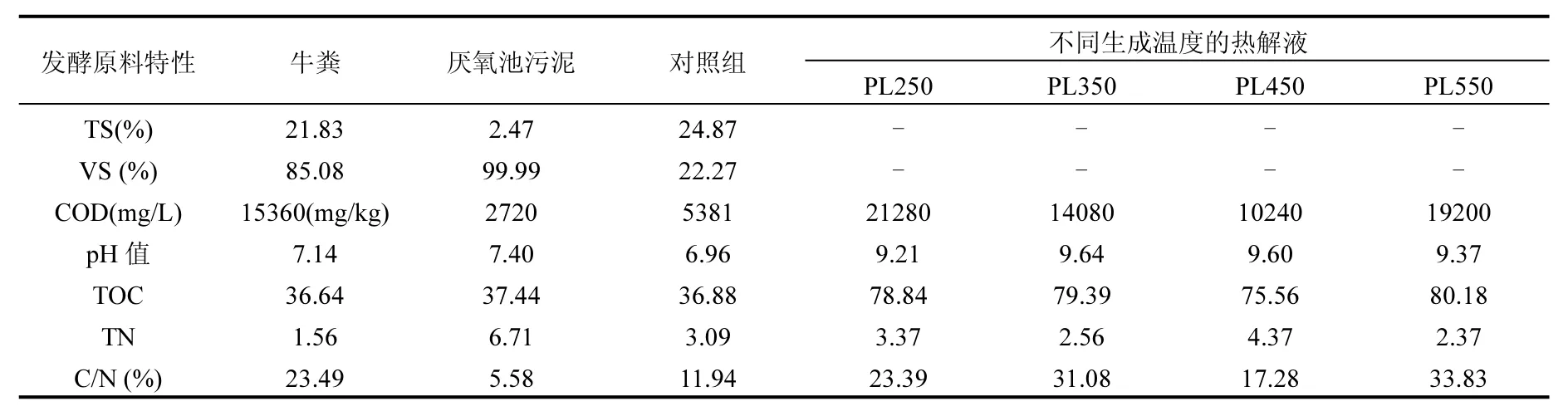
表2 厌氧发酵原材料的特性Table 2 Properties of all materials used in anaerobic digestion
1.2 实验设计与方法
实验研究设3批次,见表3.每批次中各设1个对照组,其中空白对照(BC-0)仅有接种液,牛粪对照组仅牛粪和接种液混合(BC).第一批次考察250~550℃的热解液加入接种液是否能进行厌氧发酵.第二批次以250℃下生成的热解液PL250为例研究不同的热解液/牛粪混合比例对二者混合厌氧发酵的影响.第三批研究不同温度下的热解液与牛粪在一定的混合比例下的厌氧发酵特性,研究热解温度对混合厌氧发酵的影响.每批实验中加入接种液300g,热解液单独发酵时使用量为5g;混合发酵时,牛粪添加量为80g,热解液的添加量因实验研究要素不同而各异,见表3.牛粪与接种液的接种方式是依据F/I为2.0[16]进行配比.F/I是基于发酵原料与接种液的初始挥发性含固量(g VS)之比计算[17],见式(1).

表3 实验工况设计Table 3 Experimental design for the test

图1是厌氧发酵的实验装置.
将原料装入容积为500mL的厌氧发酵反应瓶内,混合均匀,于55℃下进行厌氧消化.总TS约为6.64%.除接种物外,其他各原料的碳氮比都在15~33之间,属于厌氧发酵合适的C/N比[18-19]范围.每组设3个平行样品.实验开始前,先测厌氧瓶的密封性,并用大流量纯氮排空1min,最后将加好料的厌氧瓶放入恒温水浴摇床内,发酵温度设置为(55±1)℃,以加快反应进程.摇床转速为50r/min,每天摇晃12h,并手动摇晃两次,共持续30d.实验第2、6、10、14、18、22、26、30d定时取样测定相关气体和液体指标.

图1 厌氧发酵实验装置Fig.1 Schematic diagram of the anaerobic digestion experiment
1.3 测定指标及方法
污泥热解液用二氯甲烷萃取有机相,经孔径为0.22µm的有机滤膜过滤后,采用GCMS-QP2010型气相色谱质谱联用仪(Shimadzu,Japan)测量分析.各原料的TS和VS均通过烘干减重法测得.pH值采用精密pH计(PHS-3C-01,上海)测得,TOC和TN采用元素分析仪(Elementer Vario EL Ⅲ, Germany)来测定.发酵产生的气体首先通过铝箔采样袋收集,再用蠕动泵(BT100-1L, LongerPump,英国)和湿式气体流量计(LML-1,北京)测量其体积.气体成分采用气相色谱(6890N, Agilent Technologies)测定.在反应过程中对发酵瓶中的液体取样测量其中的有机质变化.样品的可溶解部分先通过离心机(TGLB- 10E,上海)以5000r/min的转速离心15min后取上清液用去离子水稀释,测其总挥发性脂肪酸(TVFA)和溶解性化学需氧量(SCOD).总碱度采用酸碱滴定法测定;总挥发性脂肪酸(TVFA)和各分量的浓度通过先用0.45μm的有机滤膜过滤,再加1/15的磷酸酸化,最后用气相色谱(6890N,Agilent Technologies)来标定测量获得;而溶解性化学需氧量(SCOD)的测定采用重铬酸钾-微波消解器(DL-801W,青岛)消解和硫酸亚铁铵滴定法获得.
2 结果与讨论
2.1 热解液的产量、成分与发酵特性
不同热解终温下的污泥热解液(250、350、450、550℃下产生的热解液分别记为PL250、PL350、PL450和PL550)的产率分别为23.06%,24.52%,26.19%和27.28%,可见随温度升高有所增加,但是总体上增加不多.图2为其主要成分及其含量百分比,随着温度的升高,热解液成分变化明显,尤其是PL250和PL350间差异较大.
总体上,污泥热解液中的成分可划分为含氮化合物(N-containings),含氧化合物(Oxygenates),脂肪族化合物(Aliphatics),单环芳香族化合物(Monoaromatics),多环芳香族化合物(PACs)和杂环及复杂结构的大分子物质等其他类(Others),与此前报道的相似[20].含氮化合物和单环芳香族化合物的含量百分比最高,分别在24.20%~35.39%和33.15%~45.93%范围内,二者之和达70%左右;且随着热解温度的升高,热解液中含氮化合物和含氧化合物的含量总体趋势在不断下降;单环芳香族化合物在不断上升,脂肪族化合物和多环芳香族化合物含量虽然不高,但其总体趋势也是随温度升高而升高的.

图2 不同终温下的污泥热解液主要成分及其含量Fig.2 The main ingredients and their concentration in SS-PLs produced at different pyrolysis temperatures
图3展示了污泥热解液厌氧发酵的产气特性.BC-0组为单接种液的情形,PL250~PL550组分别代表各温度下热解液接种后厌氧发酵的累计产气量.可见,BC-0组产气很少,PL350热解液组的累计产气量最多,达63mL,其他温度下的热解液的累计产气量在46~52mL之间;PL450组相对较少;这是因为热解液中有机物大部分都有一定毒性,PL250热解液主要含大分子物质,难分解,故产气量较少;随热解温度的升高,热解液中小分子有机物增多,但单环和多环芳香类物质的浓度也增加,抑制了发酵.而PL350热解液因脂肪类较少,多环芳香类也较少,易分解物质相对较多,因而产气略多.

图3 热解液接种后的发酵产气特性Fig.3 Cumulative biogas yield of SS-PL digestion
2.2 污泥热解液与牛粪混合发酵的产气效果

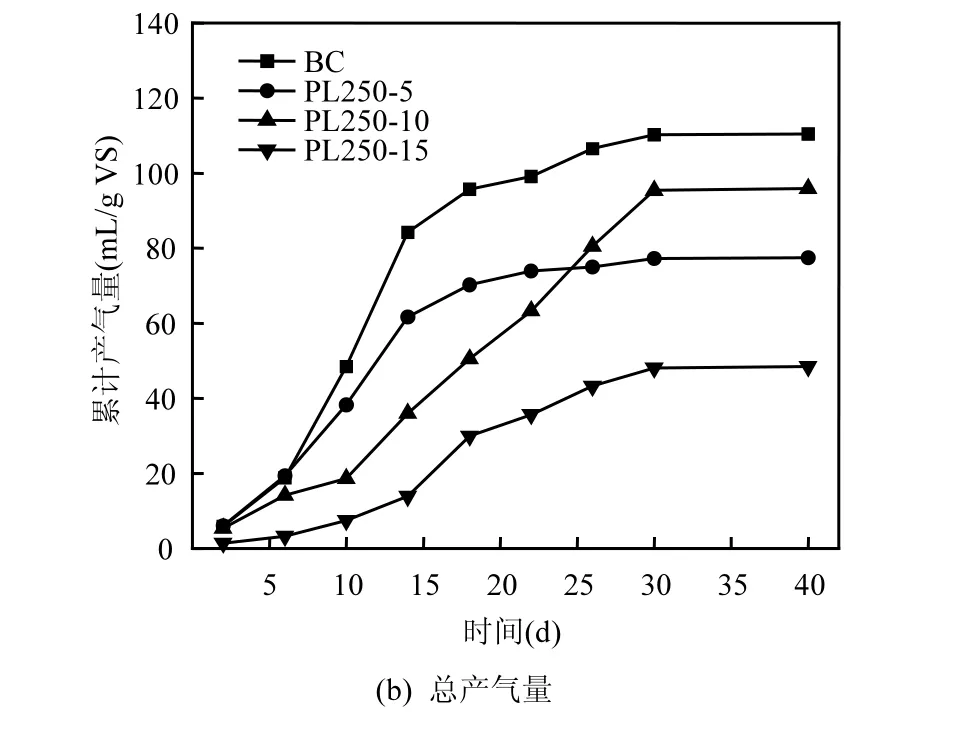
图4 热解液的比例对混合发酵产气的影响Fig.4 The biogas at different PL ratios
因为污泥热解液单独厌氧发酵较难以进行,因此尝试将污泥热解液与牛粪混合厌氧发酵.以PL250为例,当热解液以不同比例和牛粪混合厌氧发酵时,过程中的产气曲线见图4.可见各组产甲烷的基本规律一致:都是先达到一个最高峰,然后下降,后期会出现一个较小的次高峰.
图4(a)中BC组、PL250-5组和PL250-10组均在第14d达到各自的首个产甲烷高峰;而PL250-15组在第18d达到产甲烷高峰,不仅时间滞后,且最高甲烷产率远低于对照组.随着热解液比例的增加,厌氧发酵的最高甲烷产率不断降低,且存在时间上的滞后性.另外,PL250-10组在第10d甲烷产率出现短暂下降,PL250-15组在前14d的甲烷产率都非常低,可见热解液与牛粪的湿重比在10/80~15/80之间时,在发酵初期对甲烷产率有负面影响,热解液抑制了牛粪的厌氧发酵.但是,PL250-10组的第二产甲烷高峰为12.16mL/g VS,明显高于其他组,表明菌种可能适应了热解液,且可能分解了热解液中的有机质.图4(b)是热解液与牛粪混合厌氧发酵的累计产气量.在初始阶段,BC组和PL250-5组累计产气量增加较快,而其它两组累计产气量缓慢增加.产气中后期,BC组和PL250-5组累计产气量增幅变小且趋于停滞,而PL250-10和PL250-15组产气率一直慢速上升,到30d左右才停滞;PL250-10组最终累计产气量超出PL250-5组,但是低于BC组.总体上, PL250热解液对牛粪的厌氧发酵产生抑制作用,且抑制作用随着热解液添加比例的增加而加强,但后期存在菌种适应现象,热解液可能为厌氧发酵提供养分.
图5为热解温度对热解液与牛粪混合发酵产气的影响.图5(a)中PL350-5组和PL550-5组均在第10d达到首个甲烷产率高峰;对照组BC、PL250和PL450均在第14d达到首个甲烷产率高峰.各组第二甲烷产率高峰出现的时间也不尽相同.另外,PL450-5组前10d甲烷产率一直都很低,直到10d以后才增多,在第14~30d产气率维持在9.15~15.76mL/g VS的范围内,后期产率才下降.因此,不同热解温度下得到的污泥热解液对牛粪的厌氧发酵的影响不尽相同:相比对照组BC,PL350-5和PL550-5在甲烷产率达到高峰的时间上提前;且PL350-5组甲烷产率的峰值也最高,其他各组最高甲烷产率均低于BC组.可见,厌氧菌种能够较快适应350℃和550℃的污泥热解液,尤其对350℃热解液有较好的适应能力.
图5(b)显示,PL350组累计产气量曲线一直超过对照组BC的产气量;前10d PL550-5组产气量略高于BC,但是后期降低.其余两组累计产气量一直比BC组低.PL450-5组累计产气量前期增加缓慢,后期则发展迅速,甚至最后略超PL250-5组.PL350-5组综合累计产气量最多,为116.42mL/g VS;BC组次之,为110.36mL/g VS;其余依次为PL550-5组、PL450-5组和PL250-5组.总体上,不同热解温度下得到的热解液的发酵产气特性不同:PL350热解液易于降解产气,而其他温度下的热解液对牛粪发酵均有不同程度的干扰作用.
综上,污泥热解液与牛粪进行混合厌氧发酵时,热解液的加入比例和生成温度对牛粪的厌氧发酵影响各有不同.总体上250℃的热解液中由于含氮化合物和含氧类物质含量较高,对牛粪的厌氧发酵表现出的抑制作用最强;而450℃下的热解液由于单环芳香族化合物含量最高,也对牛粪的厌氧发酵有较强的抑制作用,说明含氮化合物、含氧类物质和单环芳香族化合物可能对产甲烷菌具有毒性或者抑制作用;并且热解液加入量越多,初始阶段对厌氧发酵的抑制作用越强.单环芳香类化合物中的苯酚、多环芳香类化合物和其他复杂有机物的毒性也有报道[9],这些物质对厌氧发酵的菌种既具有毒害作用,同时其分解也依赖于生物菌.本实验证实,350℃下的热解液的组成比例毒性相对较低、更容易被生物菌适应和降解.

图5 热解温度对混合发酵产气的影响Fig.5 The biogas at different pyrolysis temperatures
2.3 pH值的变化
图6表示发酵过程中各组的pH值的变化.该变化趋势与其他常规厌氧发酵[21-22]中正常进行中pH值的变化趋势一致:均为先降低后增加,后期保持稳定,第6~10d时pH值降到最低,最后在第18d及以后保持相对稳定.Elbeshbishy等[22]指出:发酵初期pH值下降的原因是进入了水解和酸化阶段,这种下降的趋势间接导致了初始阶段的总挥发性脂肪酸的增加.在整个发酵过程中,对照组BC的pH值最低谷为5.97,之后又上升到最高峰值8.02,后期维持在7.39~7.46之间.而各实验组的pH值变化幅度比BC组小,基本保持在6.48~7.99之间,可能是因为热解液自身的pH值在9.21~9.64之间,从一定程度上减缓了pH值降低的幅度,也可能抑制了水解和酸化过程的顺利进行.图6(a)中各实验组的水解和酸化时间持续明显比BC组长久,但pH值变化幅度略小;图6(b)中各组的水解酸化时间与BC组接近,但pH值变化幅度也略小于BC组.Mao等[23]通过实验得出,厌氧发酵中酸化阶段最佳pH值为5.5~6.5,甲烷化阶段最佳为6.5~8.2,证明本实验过程中pH值的变化在合理的范围内.

图6 pH值随发酵时间的变化规律Fig.6 Variations of pH with the time
2.4 总挥发性脂肪酸(TVFA)的变化
在厌氧发酵中,总挥发性脂肪酸(TVFA)是很重要的参数,它的含量几乎决定着厌氧发酵是否能够顺利进行.TVFA主要包括乙酸,丙酸,正丁酸,异丁酸,正戊酸和异戊酸,这几种酸总量的变化,尤其是乙酸和丁酸从一定程度决定着厌氧发酵的类型.图7显示总挥发性脂肪酸随着发酵时间的变化规律:随着时间的递增,各组的TVFA含量或者呈现先增大后降低的趋势或者呈现直接下降的趋势.该变化趋势与Elbeshbishy等[22]和Dhar等[24]的研究中VFA的变化趋势相似.图7(a)中,各组初始TVFA为831~1077mg/L,最终TVFA为272~632mg/L,BC组和PL250-5组的TVFA降幅较大,这与前文累计产气量中BC组和PL250- 5组产气较多相呼应.图6(b)中,PL550-5和PL450-5组初始的TVFA含量较高,分别为1528mg/L和1401mg/L,而其余3组的初始TVFA均在850mg/L左右;各组的最终TVFA在254~ 382mg/L之间,TVFA的降幅均较大.发酵前期TVFA量增加是因为要先通过发酵底物的水解,产生可溶性有机物,后续出现VFA的下降是因为甲烷菌将VFA转化为了甲烷和二氧化碳.而PL550-5组和PL450-5组初始TVFA非常高,主要是因为450℃和550℃的热解液中含有部分VFA类物质或者可快速降解为VFA的物质,它们随后的快速降解证明污泥热解液可以被微生物降解.总体上,PL350-5组和PL550-5组与BC组的最终TVFA量持平,说明这两者的TVFA均得到有效降解.
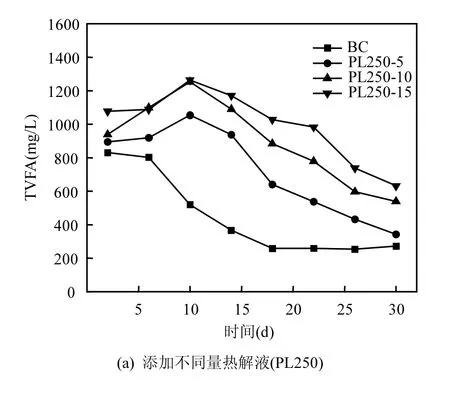
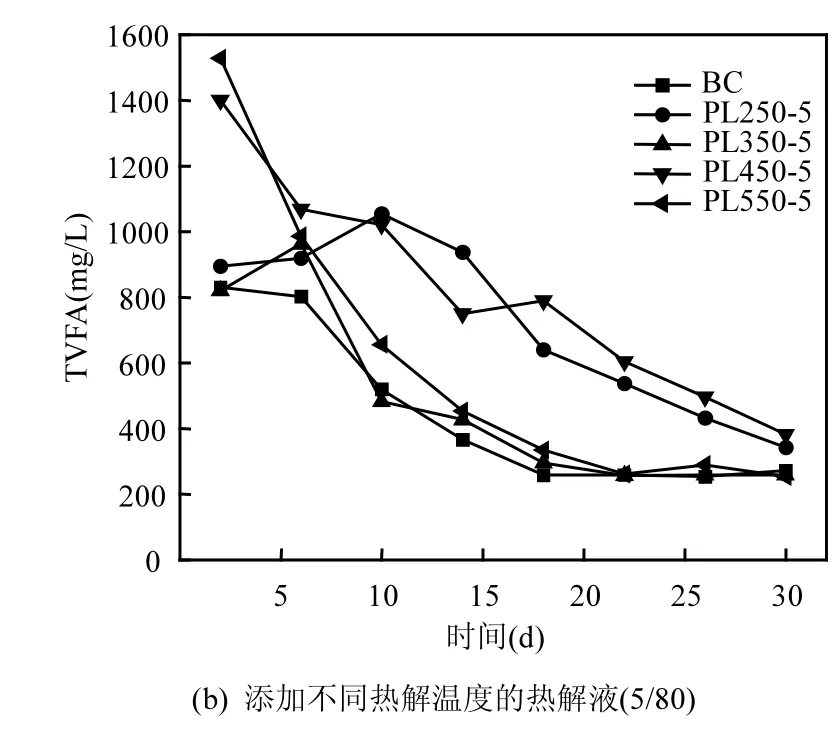
图7 总挥发性脂肪酸随发酵时间的变化规律Fig.7 Variations of total volatile fatty acids in the system
2.5 溶解性化学需氧量(SCOD)的变化
图8为各组溶解性化学需氧量(SCOD)随发酵时间的变化,可见发酵上清液中SCOD的变化没有明显规律.图8(a)中,BC组的SCOD浓度于前14d维持在较低水平;后期浓度增大.PL250-5组的SCOD浓度基本呈现稳定中缓慢下降的趋势,中期略有波动,从初始2097mg/L降至最终的1696mg/L;在第6d出现最低SCOD浓度1248mg/L.PL250-10组的SCOD浓度呈现先增加后降低的趋势;而PL250-15组的SCOD浓度出现多次较大波动,最低为1098mg/L,最高为2560mg/L.整体看来,各组的SCOD浓度维持在1000~2500mg/L之间.不同热解液的混合比例对SCOD的影响并不明显.
图8(b)表示不同热解温度得到的热解液对发酵过程中SCOD变化的影响.各组的初始SCOD浓度有较大差异:PL550-5组和PL450-5组初始值约为BC组和PL350-5组的3倍;而最终SCOD浓度在1408~1856mg/L之间.从整体趋势看来,PL550-5组的SCOD浓度呈现先线性下降后维持稳定的趋势;PL450-5组呈现先急剧下降后在一定范围内波动的趋势.PL250-5组和PL350-5组的SCOD浓度均呈现在一定范围内波动的趋势.总体上,温度对热解液混合发酵的SCOD变化影响较大,最终PL350-5组的SCOD浓度最低.PL550-5组和PL450-5组对应的SCOD快速下降的趋势说明这二者中的有机物也易于降解.

图8 SCOD随发酵时间的变化规律Fig.8 Variations of soluble chemical oxygen demand in the system
3 结论
3.1 250~550℃下产生的污泥热解液接种后能实现厌氧发酵,PL350热解液组产气最多,但是总体上产生的气体量很少.
3.2 以PL250热解液为例研究了热解液与牛粪以不同比例混合的厌氧发酵,发现该温度下的热解液对牛粪的厌氧发酵产生了抑制作用,表现为总产气量和甲烷产率均减少;随着热解液比例的增加,抑制作用增强.
3.3 不同终温获得的4种热解液与牛粪按较小比例混合后厌氧发酵的研究表明:350℃下的热解液PL350与牛粪混合发酵的产气量略高于牛粪单独厌氧发酵,其余温度下的热解液均低于牛粪单独发酵,但是PL550-5组对应的挥发性脂肪酸的相对降解程度最大.
3.4 总体上污泥热解液可与牛粪以较小比例混合实现厌氧发酵处理,从产气量和最终有机物的降解情况来看,PL350最合适与牛粪实现混合厌氧发酵处理.
[1] Fonts I, Azuara M, Gea G, et al. Study of the pyrolysis liquids obtained from different sewage sludge [J]. Journal of Analytical and Applied Pyrolysis, 2009,85(1):184-191.
[2] 李海英,张书廷,赵新华.城市污水污泥热解实验及产物特性 [J].天津大学学报, 2006,39(6):739-744.
[3] Gascó G, Blanco C G, Guerrero F, et al. The influence of organic matter on sewage sludge pyrolysis [J]. Journal of Analytical and Applied Pyrolysis, 2005,74(1):413-420.
[4] 常风民,王启宝,贾晋炜,等.城市污泥两段式催化热解制合成气研究 [J]. 中国环境科学, 2015,35(3):804-810.
[5] 何品晶,邵立明,陈正夫,等.污水厂污泥低温热化学转化过程机理研究 [J]. 中国环境科学, 1998,18(1):39-42.
[6] 奉 华,张衍国,邱 天,等.城市污水污泥的热解特性 [J]. 清华大学学报:自然科学版, 2001,41(10):90-92.
[7] Kim Y, Parker W. A technical and economic evaluation of the pyrolysis of sewage sludge for the production of bio-oil [J].Bioresource Technology, 2008,99(5):1409-1416.
[8] Mohan D, Pittman C U, Steele P H. Pyrolysis of wood/biomass for bio-oil: a critical review [J]. Energy & Fuels, 2006,20(3):848-889.
[9] Cordella M, Torri C, Adamiano A, et al. Bio-oils from biomass slow pyrolysis: a chemical and toxicological screening [J].Journal of Hazardous Materials, 2012,231:26-35.
[10] Torri C, Fabbri D. Biochar enables anaerobic digestion of aqueous phase from intermediate pyrolysis of biomass [J].Bioresource Technology, 2014,172:335-341.
[11] Willner T, Scherer P, Meier D, et al. Vergärung von flash-pyrolyseöl aus holz zu biogas [J]. Chemie Ingenieur Technik,2004,76(6):838-842.
[12] Hübner T, Mumme J. Integration of pyrolysis and anaerobic digestion—use of aqueous liquor from digestate pyrolysis for biogas production [J]. Bioresource Technology, 2015,183:86-92.
[13] Fabbri D, Torri C. Linking pyrolysis and anaerobic digestion(Py-AD) for the conversion of lignocellulosic biomass [J].Current Opinion in Biotechnology, 2016,38:167-173.
[14] Bueno I C S, Cabral Filho S L S, Gobbo S P, et al. Influence of inoculum source in a gas production method [J]. Animal Feed Science and Technology, 2005,123:95-105.
[15] Mei Z, Liu X, Huang X, et al. Anaerobic mesophilic codigestion of rice straw and chicken manure: effects of organic loading rate on process stability and performance [J]. Applied Biochemistry and Biotechnology, 2016,179(5):846-862.
[16] Kafle G K, Bhattarai S, Kim S H, et al. Effect of feed to microbe ratios on anaerobic digestion of chinese cabbage waste under mesophilic and thermophilic conditions: biogas potential and kinetic study [J]. Journal of Environmental Management, 2014,133:293-301.
[17] Kafle G K, Kim S H. Effects of chemical compositions and ensiling on the biogas productivity and degradation rates of agricultural and food processing by-products [J]. Bioresource Technology, 2013,142:553-561.
[18] Zhang C, Xiao G, Peng L, et al. The anaerobic co-digestion of food waste and cattle manure [J]. Bioresource Technology, 2013,129:170-176.
[19] Cavinato C, Fatone F, Bolzonella D, et al. Thermophilic anaerobic co-digestion of cattle manure with agro-wastes and energy crops:comparison of pilot and full scale experiences [J]. Bioresource Technology, 2010,101(2):545-550.
[20] Yu G, Feng Y, Chen D, et al. In situ reforming of the volatile by char during sewage sludge pyrolysis [J]. Energy & Fuels, 2016.
[21] Zhang C, Xiao G, Peng L, et al. The anaerobic co-digestion of food waste and cattle manure [J]. Bioresource Technology, 2013,129:170-176.
[22] Elbeshbishy E, Nakhla G. Batch anaerobic co-digestion of proteins and carbonydrates [J]. Bioresource Technology, 2012,116:170-178.
[23] Mao C, Feng Y, Wang X, et al. Review on research achievements of biogas from anaerobic digestion [J]. Renewable and Sustainable Energy Reviews, 2015,45:540-555.
[24] Dhar H, Kumar P, Kumar S, et al. Effect of organic loading rate during anaerobic digestion of municipal solid waste [J].Bioresource Technology, 2016,217:56-61.

