实时三维超声及斑点追踪技术评价非酒精性肝硬化患者左心房功能
向覃言秋,孙 阳*,王志刚,成 涓>
(1.重庆医科大学附属第二医院超声科,重庆 400010;2.超声分子影像重庆市重点实验室,重庆 400010)
肝硬化患者可因心肌异常而致左心功能障碍[1],静息状态下临床症状隐匿,但于外科手术等应激状态下可发生心血管并发症,甚至心力衰竭[2];早期发现肝硬化患者左心功能异常可及时治疗并避免心力衰竭等不良预后。本文采用实时三维超声心动图(real-time three-dimensional echocardiography, RT-3DE)及二维斑点追踪(two-dimensional speckle tracking imaging, 2D-STI)技术定量评价不同程度肝硬化患者左心房形态、功能改变。
1 资料与方法
1.1 一般资料 收集2017年2月—7月我院确诊为非酒精性肝硬化患者60例(肝硬化组),男51例,女9例,年龄23~79岁,平均(49.5±11.4)岁;均经临床、实验室、影像学检查明确诊断为肝硬化,其中乙型肝炎性肝硬化50例,隐源性肝硬化3例,丙型肝炎性肝硬化2列,原发性胆汁淤积性肝硬化2例,自身免疫性肝硬化1例,自身免疫性肝炎并原发性胆汁淤积性肝硬化1例,肝豆状核变性1例;排除酒精性肝硬化患者。所有患者均无原发性心肺疾病、代谢综合征(高血压、糖尿病等)、甲状腺功能亢进、中重度贫血、心包积液及左侧胸腔积液等;根据患者Child-Pugh肝功能分级,分为A级、B级、C级三个亚组,每亚组20例。选取同期性别、年龄匹配的健康志愿者16名(对照组),男12名,女4名,年龄20~65岁,平均(39.9±12.4)岁;均无肝肾疾病、心肺疾病,无高血压、糖尿病病史,体格检查及心脏超声检查未见异常,窦性心率。本研究经医院伦理委员会批准,所有受试者均知情同意。
1.2 仪器与方法 采用Philips iE33超声诊断仪,配备二维探头S5-1(频率2.0~3.5 MHz)及三维探头X3-1(频率1~5 MHz)。
1.2.1 常规超声及M型超声检查 采用常规超声于胸骨旁左心室长轴切面测量左心房前后径(LAD1),于心尖四腔心切面测量左心房左右径(LAD2)及左心房上下径(LAD3);采用M型超声测量左心室舒张末内径(left ventricular end-diastolic diameter, LVEDD)、左心室收缩末内径(left ventricular end-systolic diameter, LVESD),室间隔厚度(interventricular septum thickness, IVST)及左心室后壁厚度(left ventricular posterior wall thickness, LVPWT),计算左心室射血分数(left ventricular ejection fraction, LVEF)。
1.2.2 PWD及TDI 采用PWD于心尖四腔心切面测量二尖瓣舒张期早期峰值流速(E)、二尖瓣舒张晚期峰值流速(A),计算E/A值。TDI:于心尖四腔心切面将取样容积置于二尖瓣环房间隔侧及二尖瓣环侧壁处,测量二尖瓣舒张早期运动速度(Em)及舒张晚期运动速度(Am),计算Em/Am及E/Em值。
1.2.3 2D-STI 在标准心尖四腔心、二腔心及三腔心切面获取连续3个心动周期图像,于QLAB工作站进行图像分析。于TMQA模式下描绘左心房心内膜边界,获得左心房各节段时间—应变(应变率)曲线(图1),计算左心房整体收缩期、舒张早期和舒张晚期平均峰值应变(mSs、mSe、mSa)、左心房整体收缩期、舒张早期和舒张晚期平均峰值应变率(mSRs、mSRe、mSRa)及左心房僵硬度(left atrial stiffness, LASt),LASt=E/(Em×mSs)。
1.2.4 RT-3DE检查 于四腔心切面观察图像,待心内膜显示清晰、心率平稳后储存连续3个心动周期的图像。于3DQA模式下,在左心房放置3个垂直交叉的参考平面,于第1帧及第7帧图像进行描点标记及容积跟踪,获得左心房时间—容积变化曲线,读取左心房容积(left atrial volume, LAV)。于曲线峰值点读取左心房最大容积(LAVmax),波谷点读取左心房最小容积(LAVmin),对照心电图于P波起始点读取左心房收缩前容积(LAVpre)。计算左心房功能参数:左心房总射血分数(left atrial total emptying fraction, LATEF)=(LAVmax-LAVmin)/LAVmax×100%,左心房主动射血分数(left atrial active ejection fraction, LAAEF)=(LAVpre-LAVmin)/LAVpre×100%,左心房被动射血分数(left atrial passive ejection fraction, LAPEF)=(LAVmax-LAVpre)/LAVmax×100%,左心房扩张指数(left atrial expansion index, LAEI)=(LAVmax-LAVmin)/LAVmin。

图1 以2D-STI技术于心尖两腔心切面测量左心房应变 A.对照组; B.肝硬化组
1.3 统计学方法 采用SPSS 17.0统计分析软件,计量资料用±s表示。采用独立样本t检验比较肝硬化组与对照组临床资料,多组间比较采用单因素方差分析,两两比较采用LSD检验。2组间性别比较采用χ2检验。LASt与左心房功能、结构参数的相关性采用Spearman相关性分析。P<0.05为差异有统计学意义。
2 结果
肝硬化组与对照组性别、年龄、体质量指数、收缩压、舒张压及脉压差异均无统计学意义(P均>0.05),心率差异有统计学意义(P<0.001,表1)。
2.1 常规超声参数 对照组、Child-Pugh A级、B级、C级各亚组间LAD1、LAD2、LAD3、LVEF、E/Em、Em/Am总体差异均有统计学意义(P均<0.05);各亚
组与对照组间LVEDD、LVESD、IVST、LVPWT、E/A差异均无统计学意义(P均>0.05),两两比较结果见表2。
2.2 RT-3DE及应变参数 对照组、Child-Pugh A级、B级、C级亚组间LAVmax、LAVpre、LAVmin、LATEF、LAEI、mSs、mSRs、LAPEF、mSe、mSRe、LAAEF、mSa、mSRa及LASt总体差异均有统计学意义(P均<0.05),两两比较结果见表3。
2.3 相关性分析 对照组及肝硬化组LASt与LAEI(r=-0.34,P<0.01)、mSs(r=-0.65,P<0.01)、mSRs(r=-0.44,P<0.01)、LAPEF(r=-0.33,P<0.01)、mSe(r=-0.38,P<0.01)、mSRe (r=-0.47,P<0.01)呈负相关;与LATEF(r=0.17,P=0.14)、LAVmax(r=0.09,P=0.46)、LAVpre(r=0.19,P=0.19)、LAVmin(r=-0.06,P=0.61)、LAAEF(r=0.21,P=0.10)、mSa(r=-0.21,P=0.85)、mSRa(r=0.19,P=0.99)无相关性。
3 讨论
既往研究[3]多关注肝硬化患者左、右心室改变,对左心房形态、功能改变的报道较少。肝硬化患者由于内脏及外周血管舒张,使有效血容量不足,交感神经系统激活,甲肾上腺素水平升高使心肌细胞收缩功能受损,诱导心肌细胞重塑[4]。肾素-血管紧张素-醛固酮系统活性升高,钠水潴留致容量负荷加大,心肌细胞代偿性肥大,左心室舒张顺应性受损[5-6];且肝硬化患者肝功能受损,细胞内毒素灭活减少、炎症因子增加均可降低心肌细胞反应性使其发生纤维化,提示肝硬化患者心房肌纤维化及左心室舒张功能减低为其左心房功能障碍的主要原因。
本研究结果表明肝硬化患者静息状态下心率加快,提示可能存在高循环动力综合征,导致心输出量不断增加,肝硬化患者静息LVEF随疾病程度加重而升高,与Pagourelias等[7]研究结果一致。本研究肝硬化组LAD1、LAD2、LAD3、LAVmax、LAVpre、LAVmin随肝硬化程度加重逐渐增大,提示其左心房容积增大趋势与肝硬化受损程度一致。肝硬化患者左心室舒张顺应性受损,左心室高充盈压力使左心房血液流入受阻,左心房内残留血量增多,导致心房容积增大。E/Em可准确评价左室舒张顺应性[8-9]。本研究中E/Em升高,提示随肝硬化程度进展,左心室舒张功能受损加重。
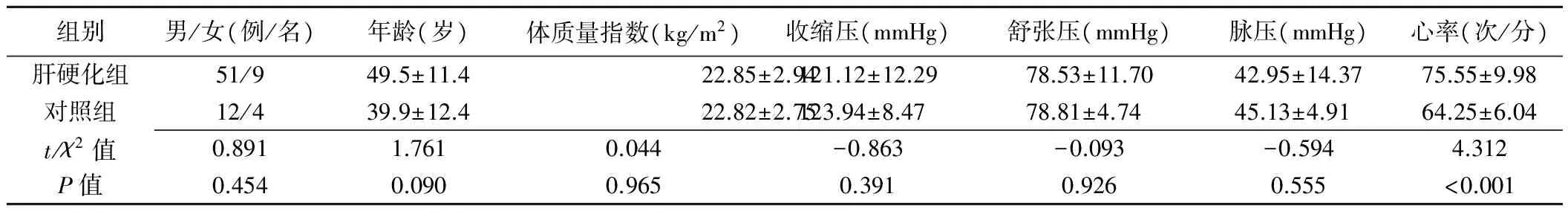
表1 2组基本资料比较
表2 各亚组与对照组间常规超声参数比较(±s)

表2 各亚组与对照组间常规超声参数比较(±s)
组别LAD1(mm)LAD2(mm)LAD3(mm)LVEF(%)LVEDD(mm)LVESD(mm)Child⁃PughA级亚组36.49±4.42∗38.57±3.76∗50.55±6.17∗69.66±5.05∗ 46.15±7.4828.20±4.20Child⁃PughB级亚组38.28±5.12∗40.07±6.09∗51.10±4.90∗69.81±5.17∗47.85±5.9828.98±4.91Child⁃PughC级亚组38.44±4.98∗40.69±5.47∗51.82±8.37∗73.56±6.79∗#◆47.99±4.8528.13±3.51对照组30.24±3.5735.14±3.5743.37±5.1765.86±5.0544.93±5.5528.13±4.25F值12.0764.4349.1066.1461.0380.679P值<0.0010.006<0.0010.0010.3810.568组别IVST(mm)LVPWT(mm)E/AEm/AmE/EmChild⁃PughA级亚组9.27±0.819.81±1.351.26±0.351.14±0.32∗8.34±1.69∗Child⁃PughB级亚组9.81±1.639.87±1.151.19±0.321.00±0.35∗8.38±2.64∗Child⁃PughC级亚组9.97±1.379.83±2.441.18±0.300.94±0.37∗8.79±1.79∗对照组9.32±1.249.32±0.911.31±0.391.40±0.355.79±2.05F值0.9550.4520.5356.2847.213P值0.4190.7170.6600.001<0.001
注:*:与对照组比较,P<0.05;#:与Child-Pugh A级亚组比较,P<0.05;◆:与Child-Pugh B级亚组比较,P<0.05
表3 各亚组与对照组间RT-3DE及应变参数比较(±s)

表3 各亚组与对照组间RT-3DE及应变参数比较(±s)
组别LAVmax(ml)LAVpre(ml)LAVmin(ml)LATEF(%)LAEImSsmSRsChild⁃PughA级亚组42.17±11.69∗28.69±7.14∗ 16.37±6.02∗61.06±9.19∗ 1.82±0.59∗30.57±5.37∗ 2.47±0.49∗Child⁃PughB级亚组46.10±12.07∗32.08±9.08∗18.91±4.32∗66.43±8.03∗2.11±0.67∗#31.03±4.63∗2.61±0.53∗Child⁃PughC级亚组50.01±15.33∗#38.97±12.33∗#◆20.38±9.38∗60.54±11.10∗◆1.84±0.71∗24.48±4.16∗#◆1.70±0.26∗#◆对照组29.31±7.1919.97±3.9012.76±1.8654.33±2.531.22±0.1427.53±0.932.19±0.46F值8.96113.4833.1585.9866.81310.1688.078P值<0.001<0.0010.0320.001<0.001<0.001<0.001组别LAPEF(%)mSemSReLAAEF(%)mSamSRaLAstChild⁃PughA级亚组30.34±7.6011.03±2.67-1.74±0.49 44.31±11.26∗-2.47±1.07∗-2.62±0.82∗0.29±0.12∗Child⁃PughB级亚组25.87±7.86∗10.05±2.40∗-1.59±0.39∗53.25±9.87∗#-2.69±0.97∗-2.73±0.52∗0.30±0.89∗Child⁃PughC级亚组20.14±7.82∗#9.19±2.01∗#-1.43±0.37∗#49.15±11.87∗-1.83±0.66#◆-2.16±0.45#◆0.37±0.97∗#◆对照组31.55±5.0311.92±1.35-1.90±0.3734.27±3.18-1.52±0.31-2.17±0.360.23±0.48F值7.8405.2344.23611.9487.2634.9216.155P值<0.0010.0030.008<0.001<0.0010.0040.001
注:*:与对照组比较,P<0.05;#:与Child-Pugh A级亚组比较,P<0.05;◆:与Child-Pugh B级亚组比较,P<0.05
左心房通过“储备”、“通道”、“辅泵”三大功能潜在调控左心室的充盈[10]。本研究显示肝硬化不同时期左心房受损程度不同,Child-Pugh A级、B级亚组LAEI、mSs、mSRs较对照组升高(P均<0.05),表明代偿期及轻度失代偿期肝硬化患者“储备”功能明显增强,左心房容积增大,以增加左心房内血流量,维持左心室充盈压的动态平衡;Child-Pugh C级亚组mSs、mSRs较对照组减低(P均<0.05),表明重度失代偿期患者“储备”功能减低,随左心房容积进一步增大,心肌纤维化致“储备”功能失代偿。
本研究结果显示Child-Pugh A级亚组LAPEF、mSe、mSRe与对照组差异无统计学意义(P均>0.05),B级、C级亚组减低(P均<0.05),提示随着肝硬化程度加重,左心房“管道”功能降低。在左心室收缩期即左心房舒张早中期,左心房作为肺静脉与左心室间的管道辅助左心室充盈。肝硬化患者心肌肥厚、顺应性下降,舒张早期肺静脉与左心室间压差降低,心室对心房的抽吸作用减弱,导致左心房“管道”功能减低。
本研究中Child-Pugh A级、B级亚组LAAEF、mSa、mSRa较对照组升高(P均<0.05),C级亚组mSRa、mSa低于A级、B级亚组,LAAFE低于B级亚组(P均<0.05),提示在左心室舒张功能受损早中期,代偿期及轻度失代偿期患者“辅泵”功能增强,重度失代偿期“辅泵”功能减低。随着左心房“管道”功能降低,左心房内残留血容量增多,左心房压持续增高;为维持正常心输出量,左心房主动射血能力升高。在重度失代偿期,随心房肌细胞进一步拉长,发生心肌纤维化,左心房重构,使主动射血功能失代偿。
本研究中LASt与LAEI、mSs、mSRs、LAPEF、mSe、mSRe均呈负相关(P均<0.01),提示LASt同左心房的“储备”、“通道”功能关系密切,与罗田田等[11]研究结果一致;LASt与LAVmax、LAVpre、LAVmin均无明显相关(P均>0.05),提示左心房容积增大不能作为独立指标评价左心房纤维化及左心室舒张功能降低,与D'Ascenzi等[12]及Sampaio等[13]研究结果相符。
总之,肝硬化患者左心房功能受损与肝硬化严重程度相关;RT-3DE联合2D-STI技术可准确评估其左心房形态及功能变化。
[1] Wiese S, Hove JD, Møller S. Cardiac imaging in patients with chronic liver disease. Clin Physiol Funct Imaging, 2017,37(4):347-356.
[2] Naqvi IH, Mahmood K, Naeem M, et al. The heart matters when the liver shatters! Cirrhotic cardiomyopathy: Frequency, comparison, and correlation with severity of disease. Prz Gastroenterol, 2016,11(4):247-256.
[3] Chen Y, Chan AC, Chan SC, et al. A detailed evaluation of cardiac function in cirrhotic patients and its alteration with or without liver transplantation. J Cardiol, 2016,67(2):140-146.
[4] Hammami R, Boudabbous M, Jdidi J, et al. Cirrhotic cardiomyopathy: Is there any correlation between the stage of cardiac impairment and the severity of liver disease? Libyan J Med, 2017,12(1):1283162.
[5] Kazankov K, Holland-Fischer P, Andersen NH, et al. Resting myocardial dysfunction in cirrhosis quantified by tissue Doppler imaging. Liver Int, 2011,31(4):534-540.
[6] Altekin RE, Caglar B, Karakas MS, et al. Evaluation of subclinical left ventricular systolic dysfunction using two-dimensional speckle-tracking echocardiography in patients with non-alcoholic cirrhosis. Hellenic J Cardiol, 2014,55(5):402-410.
[7] Pagourelias ED, Sotiriou P, Papadopoulos CE, et al. Left ventricular myocardial mechanics in cirrhosis: A speckle tracking echocardiographic study. Echocardiography, 2016,33(2):223-232.
[9] Sampaio F, Pimenta J, Bettencourt N, et al. Systolic and diastolic dysfunction in cirrhosis: A tissue-Doppler and speckle tracking echocardiography study. Liver Int, 2013,33(8):1158-1165.
[10] 梁俊媚,徐艳燕,王璆,等.左心房容积追踪技术评价高尿酸血症患者左心房重构.中国医学影像技术,2016,32(1):57-62.
[11] 罗田田,张萍,任建丽,等.实时三维超声和二维斑点追踪成像对不同时期心房颤动患者左房结构和功能的评价.临床心血管病杂志,2016,32(5):475-479.
[12] D'Ascenzi F, Pelliccia A, Natali BM, et al. Increased left atrial size is associated with reduced atrial stiffness and preserved reservoir function in athlete's heart. Int J Cardiovasc Imaging, 2015,31(4):699-705.
[13] Sampaio F, Pimenta J, Bettencourt N, et al. Left atrial function is impaired in cirrhosis: A speckle tracking echocardiographic study. Hepatol Int, 2014,8(1):146-153.
《中国医学影像技术》投稿须知(三)
7赠刊及稿酬论文见刊后,本刊将向第一作者邮寄两本赠刊。本刊按国家规定向作者支付稿酬,为一次性稿酬,纸质载体、光盘载体及网络版形式形式刊载文章的稿酬合并计算。如第一作者变更通信地址,请及时更改注册信息同时邮件通知编辑部。
8本刊邮箱cjmit@mail.ioa.ac.cn
9本刊网址www.cjmit.com
10地址北京市海淀区北四环西路21号(中科院声学所)大猷搂502室,《中国医学影像技术》期刊社,邮政编码100190。电话:010-82547901/2,传真:010-82547903

