囊性少突胶质细胞瘤MRI表现
蒋 健,刘建莉,张学凌,白亮彩,董 莉,周俊林*>
(1.兰州大学第二医院放射影像中心,2.病理科,甘肃 兰州 730030)
2016年WHO中枢神经系统肿瘤分类中,将少突胶质细胞肿瘤(oligodendroglial tumors, OG)分为少突胶质细胞瘤(oligodendroglioma, OD)和间变性少突胶质细胞瘤(anaplastic oligodendroglioma, AOD)[1]。OG可发生钙化和囊变,但发生显著囊变者相对少见。有研究[2]认为囊性少突胶质细胞瘤(cystic oligodendroglioma, COD)是OG的一种特殊形态学类型,以单发或多发的完全囊性或大囊伴类结节样实性成分为形态特征,较难与囊性星形细胞瘤(cystic astrocytoma, CA)鉴别。本研究回顾性分析10例COD的MRI表现,探讨其影像学特征。

图1 患者男,19岁,WHO Ⅱ级OD A.T2WI示右侧侧脑室内完全囊性病变,内见液平及低信号分隔,病变周缘未见明显水肿; B. 增强T1WI示囊壁及分隔局限性强化; C.病理检查示瘤细胞胞质透亮,胞核圆形、卵圆形,核居中(HE,×20)

图2 患者女,57岁,WHO Ⅲ级AOD A.T2WI示双侧颞枕叶多发完全囊性病变,病变周缘见中、重度水肿; B.DWI(b=1 000 s/mm2)示部分囊壁呈稍高信号; C.病理检查示瘤细胞弥漫成片排列,瘤细胞核小、居中,有核周空晕,异型、坏死明显(HE,×20)

图3 患者男,27岁,WHO Ⅱ级OD A.T2WI示右侧额叶-基底核完全囊性病变,肿瘤囊壁光滑,囊液信号均匀,瘤周无水肿,囊壁前缘嵴样突起,颅脑CT平扫证实为钙化; B.T1WI增强示囊壁无强化; C.病理检查示胞浆透亮,核圆形的少突胶质细胞成片分布,微血管枝芽状增生(HE,×20)
1 资料与方法
1.1 一般资料 收集2013年3月—2017年6月于我院经手术病理证实的10例COD患者,男6例,女4例,年龄19~57岁,中位年龄35.5岁;临床主要表现为头痛、抽搐及乏力等。纳入标准:肿瘤形态符合完全囊性或大囊伴类结节样实性成分,组织学表现符合OG镜下及免疫组化特点;排除部分囊变的囊实性肿瘤。
1.2 仪器与方法 采用Siemens Verio 3.0T超导型MR扫描仪,平扫序列包括轴位/矢状位SE-T1W(TR 550 ms,TE 12 ms)、轴位FSE-T2W(TR 2 200 ms,TE 90 ms),轴位液体衰减反转恢复(fliud attenuated inversion recovery, FLAIR)T2W(TR 9 000 ms,TE 110 ms,TI 2 371 ms),FOV 320 mm×320 mm,矩阵256×256,轴位层厚5 mm,层间距1.5 mm,矢状位层厚8.0 mm,层间距2.0 mm。DWI采用SE-EPI序列,加频率选择脂肪抑制技术,TR 4 000 ms,TE 100 ms,层厚9 mm,层间距1 mm,FOV 260 mm×260 mm,矩阵256×192,在x、y、z轴3个方向上施加扩散梯度(b值=0、1 000 s/mm2)。对比剂为Gd-DTPA 0.1 mmol/kg体质量,流率3 ml/s,获得轴位、矢状位和冠状位增强T1WI。10例中,8例接受颅脑MR平扫及增强检查,1例仅接受颅脑MR增强检查,1例仅接受颅脑MR平扫检查。
1.3 图像分析 由2名高年资神经影像学医师采用盲法分析所有图像,意见不一致时经协商统一。观察内容包括肿瘤部位、数目、形态、囊壁及囊内结构信号特征(常规序列及DWI、增强后强化特点等)、瘤周水肿及钙化等。
2 结果
2.1 MRI表现 10例中,8例病灶位于幕上,其中7例位于大脑半球,1例位于侧脑室(图1);2例病灶位于幕下小脑蚓部。9例为单发病灶,1例为多发病灶(图2)。4例病变呈完全囊性(图3),3例呈大囊伴类结节病变,3例为多房囊性病变。7例病灶囊壁光滑、规则,3例囊壁局部凹陷、毛糙。6例病灶FLAIR序列图像中囊液信号高于脑脊液信号,囊内合并出血时可见液-液平面(图1A);3例出血致囊液信号不均。本组仅1例囊壁为DWI稍高信号,其余9例囊壁及囊液为等或低信号。3例病灶可见钙化。瘤周水肿轻度9例,中、重度水肿1例。增强扫描中,3例病灶实性成分明显强化,3例病灶囊壁呈明显环形强化(图4A),仅1例囊壁呈局灶性强化,2例无强化。
2.2 病理及免疫组化 10例COD均经手术病理证实,其中3例为WHO Ⅱ级OD,7例为WHO Ⅲ级AOD。本组中多发、明显环形强化病例均为WHO Ⅲ级AOD。WHO Ⅱ级肿瘤镜下见瘤细胞胞质透亮,胞核圆形、卵圆形,核居中(图1C、3C);WHO Ⅲ级肿瘤镜下见瘤细胞弥漫成片排列,瘤细胞核小,居中,有核周空晕,异型、坏死明显,周边血窦较丰富(图4B)。免疫组化提示Olig2(+~++),Ki-67(阳性细胞约1%~30%)。
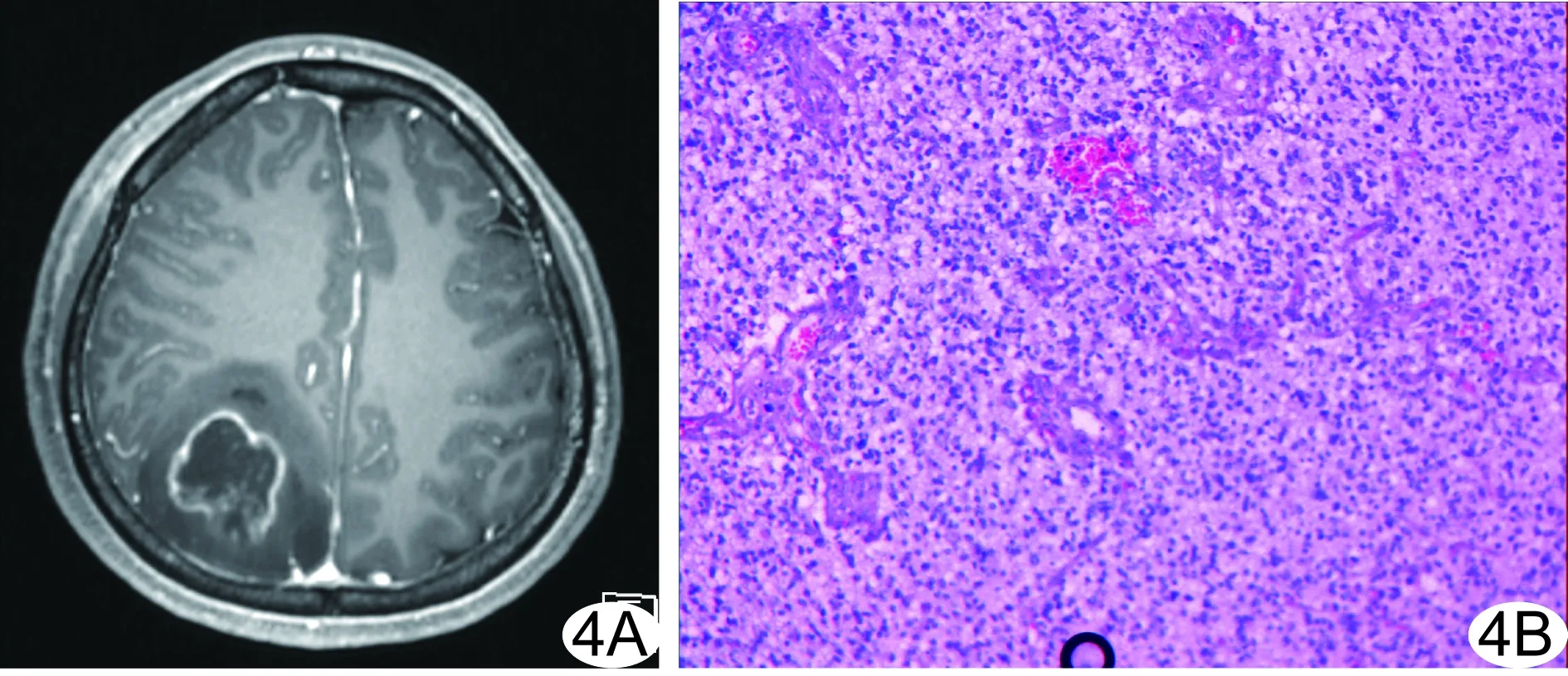
图4 患者女,25岁,WHO Ⅲ级AOD A.增强T1WI示右顶叶完全囊性病变,囊壁明显不规则环形强化,边缘毛糙、局部凹陷,病变周缘见轻度水肿; B.病理检查示瘤细胞弥漫成片排列,瘤细胞核小、居中,有核周空晕,异型明显,部分细胞胞浆丰富、透明,周边血窦较丰富,可见栅状坏死(HE,×20)
3 讨论
OG属于弥漫胶质瘤,好发于额叶皮层下白质并向皮层延伸,可发生于白质纤维走行区域[3];主要发生于成年人,峰值年龄为40~60岁,OD发病年龄较AOD略轻[3],而COD平均发病年龄可能较OD更小[2,4];临床症状缺乏特异性,以癫痫症状起病多见,与肿瘤累及额颞叶皮层相关。本组患者中位年龄为35.5岁,5例累及额、颞叶,符合上述特征。增强检查中OG病灶强化是影响肿瘤预后的独立危险因素,此类患者生存率降低、复发危险率及恶变概率增大[5]。对胶质瘤增强机制的研究[6]表明,毛细血管壁细胞间紧密连接渗透性增加、吞饮小泡和窗孔样结构跨细胞运输增加、基底膜不连续和血管周围间隙增大等病理生理学改变均可增加对比剂外渗,使肿瘤强化;而COD强化机制还与内皮细胞增生[7]、囊壁发生增殖性肿瘤细胞浸润[2]相关。有学者[8]发现,部分AOD肿瘤血管壁发育不完整,通透性增加,致肿瘤明显强化。本组强化病灶镜下可见间质有较多小血管增生,周边血窦较丰富,提示其具有富血管特征;而环形强化可能与肿瘤生长速度较快,内部乏氧致肿瘤坏死有关[9]。本组中未强化病例可能与小血管壁广泛钙化或缺失内皮细胞增生有关,也有研究[2]认为因囊壁主要由增生性胶质细胞组成而不强化。
有研究[10]认为COD囊肿形成机制主要与血脑屏障破坏有关,高级别肿瘤分泌可溶性因子破坏毛细血管壁细胞间紧密连接,肿瘤微血管进入胞间连接、内皮细胞窗孔等均可破坏血脑屏障[11]。Lohle等[12]报道,COD囊壁及周围存在海绵样水肿组织,且血脑屏障破坏、血浆蛋白漏出致囊腔内囊液血浆蛋白含量显著增加,并参与囊肿形成。Li等[13]发现肿瘤相关血管生成和微血管外渗可能是COD囊肿形成的主要原因。另外,瘤周水肿、胶质瘤内微血栓、微出血可在瘤周及肿瘤内形成缺血、缺氧环境,从而导致微囊;随着病程进展,微囊逐渐增大、融合,最终形成大囊[11]。在分子水平,水通道蛋白-4(AQP4)表达增加、肿瘤细胞血管内皮生长因子及其受体增加等均可参与囊液积聚、囊肿形成[11]。本组病例包括完全囊性病变、单囊伴类结节病变及多房囊性病变,提示肿瘤囊变程度、囊肿形成状况可能因病程而不同,其影像学表现存在多样性和复杂性。有研究[3]发现约60%~90%的COD 1号染色体短臂(1p)和19号染色体长臂(19q)缺失。 2016年WHO中枢神经系统分类提出分子时代中枢神经系统肿瘤诊断的新概念,但目前采用影像学检查尚无法准确诊断完整1p/19q基因型肿瘤与1p/19q联合缺失型肿瘤。
目前主要依靠病理检查鉴别诊断OD与AOD,影像学可提供辅助信息。本组3例明显环形强化病例为AOD,同时1例OD表现为囊壁及分隔局限性明显强化,提示AOD可能出现强化的概率更高,但无法通过强化或强化率等强化程度指标[14]明确区分肿瘤级别。动态增强MR可定量评估OG的微血管通透性,且OD与AOD的转移常数和每单位体积组织的血管外细胞外间隙体积存在差异[15]。DWI上OG通常扩散不受限[14],本组仅1例囊壁为DWI稍高信号,其余9例囊壁及囊液为等或低信号,信号缺乏特异性。已有研究[16]表明,由于AOD细胞密度高于OD,故其平均ADC值低于OD,但AOD的血管源性水肿、坏死也会表现为高信号,从而影响ADC值准确性,致OD与AOD间出现一个ADC值重叠区,影响鉴别[3]。本组病例因肿瘤囊变显著,囊壁菲薄致测量囊壁ADC值困难,故未能测值比较。瘤周水肿、钙化、灌注参数对肿瘤级别判断无明确意义[17],本组中9例轻度瘤周水肿病灶及3例钙化病灶的病理分级涵盖WHO Ⅱ级OD及WHO Ⅲ级AOD,提示两种影像学征象存在重叠,无法鉴别肿瘤级别。MRS可检测有丝分裂和坏死代谢产物,判断肿瘤级别可能优于增强检查等[18]。
COD需与以下疾病相鉴别:①囊性星形细胞瘤:以毛细胞型星形细胞瘤为主,好发年龄为5~15岁,有强化壁结节的囊性肿块,边界清,周围无水肿,约20%肿瘤可见钙化,但出血不常见;②节细胞肿瘤:好发于儿童及青少年,颞叶多见,于FLAIR序列常呈低信号,而COD囊液信号多高于脑脊液信号[2]。
本研究的局限性:样本量较小,结果可能存在偏倚,后续研究需进一步观察不同基因型肿瘤预后的差异。
综上所述,COD术前准确诊断较难,其MRI表现有一定特点,对于发生于幕上表浅部位、纯囊或伴有结节和/或分隔的大囊性病变应考虑到本病可能。
[1] 白洁,程敬亮,高安康,等.2016年WHO中枢神经系统肿瘤分类解读.中华放射学杂志,2016,50(12):1000-1005.
[2] 史宏璐,王光彬,赵斌,等.囊性少突胶质细胞瘤的MRI特征及分析.中华放射学杂志,2013,47(7):613-616.
[3] Smits M. Imaging of oligodendroglioma. Br J Radiol, 2016,89(1060):20150857.
[4] Inbasekaran V, Natarajan M. Cystic oligodendroglioma. Indian Pediatr, 1984,21(12):984-986.
[5] Chaichana KL, McGirt MJ, Niranjan A, et al. Prognostic significance of contrast-enhancing low-grade gliomas in adults and a review of the literature. Neurol Res, 2009,31(9):931-939.
[6] Shibata S, Fukushima M, Mori K. Ultrastructure of capillary permeability in human brain tumors. 2: Mechanisms of contrast enhancement in gliomas. No Shinkei Geka, 1986,14(3 Suppl):311-316.
[7] Nataf F, Tucker ML, Varlet P, et al. Oligodendrogliomas: Historical background of classifications. Neurochirurgie, 2005,51(3-4 Pt 2):219-227.
[8] 李少朋,钱银锋,余永强,等.少突-星形细胞肿瘤的CT和MRI表现.中国医学影像技术,2011,27(6):1125-1128
[9] 肖翔,林洁,许乙凯,等.脑室内少突神经胶质瘤CT和MRI表现:与病理对照(6例报告).中国医学影像技术,2013,29(8):1258-1262.
[10] Schneider SW, Ludwig T, Tatenhorst L, et al. Glioblastoma cells release factors that disrupt blood-brain barrier features. Acta Neuropathol, 2004,107(3):272-276.
[11] Adn M, Saikali S, Guegan Y, et al. Pathophysiology of glioma cyst formation. Med Hypotheses, 2006,66(4):801-804.
[12] Lohle PN, Verhagen IT, Teelken AW, et al. The pathogenesis of cerebral gliomatous cysts. Neurosurgery, 1992,30(2):180-185.
[13] Li HJ, Han HX, Feng DF. Rapid increase in cystic volume of an anaplastic astrocytoma misdiagnosed as neurocysticercosis: A case report. Oncol Lett, 2016,12(4):2825-2827.
[14] White ML, Zhang Y, Kirby P, et al. Can tumor contrast enhancement be used as a criterion for differentiating tumor grades of oligodendrogliomas? AJNR Am J Neuroradiol, 2005,26(4):784-790.
[15] Jia Z, Geng DY, Liu Y, et al. Low-grade and anaplastic oligodendrogliomas: Differences in tumour microvascular permeability evaluated with dynamic contrast-enhanced magnetic resonance imaging. J Clin Neurosci, 2013,20(8):1110-1113.
[16] Al-Okaili RN, Krejza J, Wang S, et al. Advanced MR imaging techniques in the diagnosis of intraaxial brain tumors in adults. Radiographics, 2006,26(Suppl 1):S173-S189.
[17] Khalid L, Carone M, Dumrongpisutikul N, et al. Imaging characteristics of oligodendrogliomas that predict grade. AJNR Am J Neuroradiol, 2012,33(5):852-857.
[18] Xu MS, See SJ, Ng WH, et al. Comparison of magnetic resonance spectroscopy and perfusion-weighted imaging in presurgical grading of oligodendroglial tumors. Neurosurgery, 2005,56(5):919-924.
消息
《中国医学影像技术》作者投稿请登录本刊网站(www.cjmit.com)主页,点击左上角“作者登录”进入,第一次投稿需完成作者注册;专家审稿请点击“审稿登录”进入。
为了便于广大作者、读者查阅本刊文献,本站提供从1985年起的过刊和现刊的全文检索。

