MRI及DTI评估大鼠血管性认知障碍
魏 琳,黄明明,曹笑婉,肖 雁,余 晖*
(1.贵州省人民医院放射科,贵州 贵阳 550002;2.贵州医科大学附属医院影像科,贵州 贵阳 550004;3.贵州医科大学分子生物实验室,贵州 贵阳 550004)
血管性认知障碍(vascular cognitive impairment, VCI)指由脑血管疾病引起的不同程度认知损害,程度从轻微认知损害至血管性痴呆(vascular dementia, VD)[1-2],严重影响老年人的生活质量。目前关于VCI的发病机制尚未明确,多数研究[2-3]认为发生VCI的主要原因包括脑小血管病、多发脑梗死、关键部位脑梗死、出血/微出血、血管病变、严重低灌注、遗传性血管病变。通常临床可确诊VD时患者大脑神经元已发生严重损害,因此早期诊断、干预VCI可有效缓解疾病进展。目前,有关VCI的研究多为单中心临床研究,且各研究结果存在争议,VCI患者的异常影像学指标所对应的微观病理变化尚不清楚。本研究采用MRI、DTI观察VCI大鼠海马体积的变化及全脑微观白质的损伤情况,探讨诊断早期VCI的影像学指标。
1 材料与方法
1.1 实验动物与材料 雄性SD大鼠30只,体质量200 g,由贵阳医学院实验动物中心提供[合格证号:SCXK (黔)2012-0001]。DMS2- Morris水迷宫(中国医学科学院药物研究所);Philips Achieva 3.0T X-Series超导MRI扫描仪;5 cm 4通道3.0T小动物射频线圈(苏州众志医疗科技有限公司);小动物手术器械。
1.2 模型建立与行为学实验 对30只大鼠适应性喂养2周后放入水迷宫进行定位航行实验,从池壁4个起始点的任一点将小鼠面向池壁放入水池,共5天,记录小鼠找到平台的时间和游泳路径;于第6天进行空间探索实验,撤除原平台,将大鼠任选1个入水点放入水中,记录大鼠2 min内跨越原平台的次数。完成所有训练后将学习、记忆能力相近的大鼠随机分为模型组(n=20)与对照组(n=10)。
对模型组大鼠于建模前12 h停饲、4 h停饮。采用10%水合氯醛进行腹腔注射麻醉(300 mg/kg体质量)后,做颈后正中切口,分离第1颈椎两侧翼孔,电凝双侧椎动脉后缝合;术后第2天分离双侧颈总动脉,血管夹夹闭双侧颈总动脉30 min,制造大鼠全脑急性缺血性改变。对对照组大鼠重复以上手术,但不进行血管处理,即假手术处理。对建模及假手术处理造成死亡的大鼠予以剔除,并补足2组相应的大鼠数目。对模型组大鼠分别于术后2周及1、3、5个月再次进行水迷宫实验,评估其认知能力变化。
1.3 MR检查 建模或假手术处理后2周及1、3、5个月对2组大鼠均行常规MRI及DTI扫描。采用10%水合氯醛进行腹腔注射麻醉(300 mg/kg体质量)。将大鼠头部固定于动物专用线圈。常规T2W序列:FOV 3.5 cm×3.5 cm,矩阵 256×128,层厚1 mm,层间距0,扫描层数20层,TR 5 800 ms,TE 80 ms。DTI:FOV 3.5 cm×3.5 cm,矩阵256×128,梯度方向数30,TR 5 000 ms,TE 26 ms,TR 6 000 ms,TE 90 ms,层厚1 mm,层间距0,b=0、800 s/mm2,NEX 4,梯度方向6。
1.4 图像分析 于T2WI上手动勾画代表海马面积的ROI(图1A),读出像素并计算面积,面积=(像素×35×35)/(256×128)mm2,而后利用Matlab 程序计算海马体积。于DTI图像分别勾画海马位置(图1B),选取单片海马定量描述FA值变化,同时采用FA值分布频数图描述海马整体FA值变化情况。采用origin 7.0软件制图。对所有DTI原始图像均先行涡流校正,任意选取一只大鼠DTI图像中b=0的图像,手动剥离大脑,经插片处理后作为配准的参考图像,采用SPM Coregister进行图像配准,对配准后的图像进行3倍于像素的高斯平滑处理,FA 阈值为0.15。

图1 海马MR图像 A.T2WI上海马体积所取的位置; B.DTI上海马所取的位置
1.5 病理学检查 完成最后的MR扫描后处死大鼠并取出其大脑,以10%甲醛溶液固定,脱水,石蜡包埋并切片,进行HE和尼氏染色,光镜下观察其形态学变化。
1.6 统计学分析 采用SPSS 17.0统计分析软件。计量资料以±s表示,2组间比较采用独立样本t检验及重复测量方差分析,以P<0.05为差异有统计学意义。
表1 2组大鼠水迷宫实验结果比较(±s)

表1 2组大鼠水迷宫实验结果比较(±s)
组别逃避潜伏期(s)空间探索实验第1次穿越平台时间(s)穿越平台次数(次)模型组(n=20) 术后2周39.15±9.48∗21.37±7.04∗2.10±1.12∗ 术后1个月46.05±10.88∗#26.73±11.08∗#1.45±0.89∗# 术后3个月48.31±10.48∗#29.03±13.87∗#1.35±0.99∗# 术后5个月56.46±6.74∗#△$34.53±11.25∗#△1.10±1.07∗#△对照组(n=10)16.59±9.088.79±3.814.40±1.78F值49.6712.217.34P值<0.001<0.0010.002 注:∗:与对照组比较,P<005;#:与模型组术后2周比较,P<005;△:与模型组术后1个月比较,P<005;$:与模型组术后3个月比较,P<005
2 结果
2.1 行为学观测结果 模型组不同时间点大鼠的学习和记忆能力损害随着术后时间延长而加重,见表1。与对照组比较,模型组术后2周、1个月、3个月及5个月大鼠逃避潜伏期明显延长(P均<0.05),第1次穿越平台时间明显延长(P均<0.05),穿越平台次数明显减少(P均<0.05)。
2.2 MR T2WI海马ROI结果分析 模型组大鼠术后2周、1个月海马体积与对照组差异无统计学意义(P均>0.05);与对照组比较,模型组大鼠术后3、5个月海马体积明显萎缩(P均<0.05),见图2。
2.3 DTI基于体素分析方法(voxel-based analysis, VBA)及ROI结果分析 模型组大鼠术后2周、1个月海马区FA值与对照组差异均无统计学意义(P均>0.05);与对照组相比,模型组大鼠术后3、5个月海马区FA值明显减低(P均<0.05),见图3。
模型组大鼠术后2周未见FA值显著下降的区域,术后1个月FA值显著下降的区域主要为左侧丘脑、扣带、右侧岛叶、双侧额叶皮层、纹状体、胼胝体,术后3个月FA值显著下降的区域主要为双侧丘脑、双侧纹状体、额叶皮质、右侧海马、前连合、胼胝体、岛叶、嗅束,术后5个月FA值显著下降的区域主要为双侧海马、额叶、顶叶、丘脑、双侧纹状体、前联合、胼胝体和扣带,见图4~7。

图2 2组大鼠术后不同时间点海马体积比较 (*:与对照组比较,P<0.05)
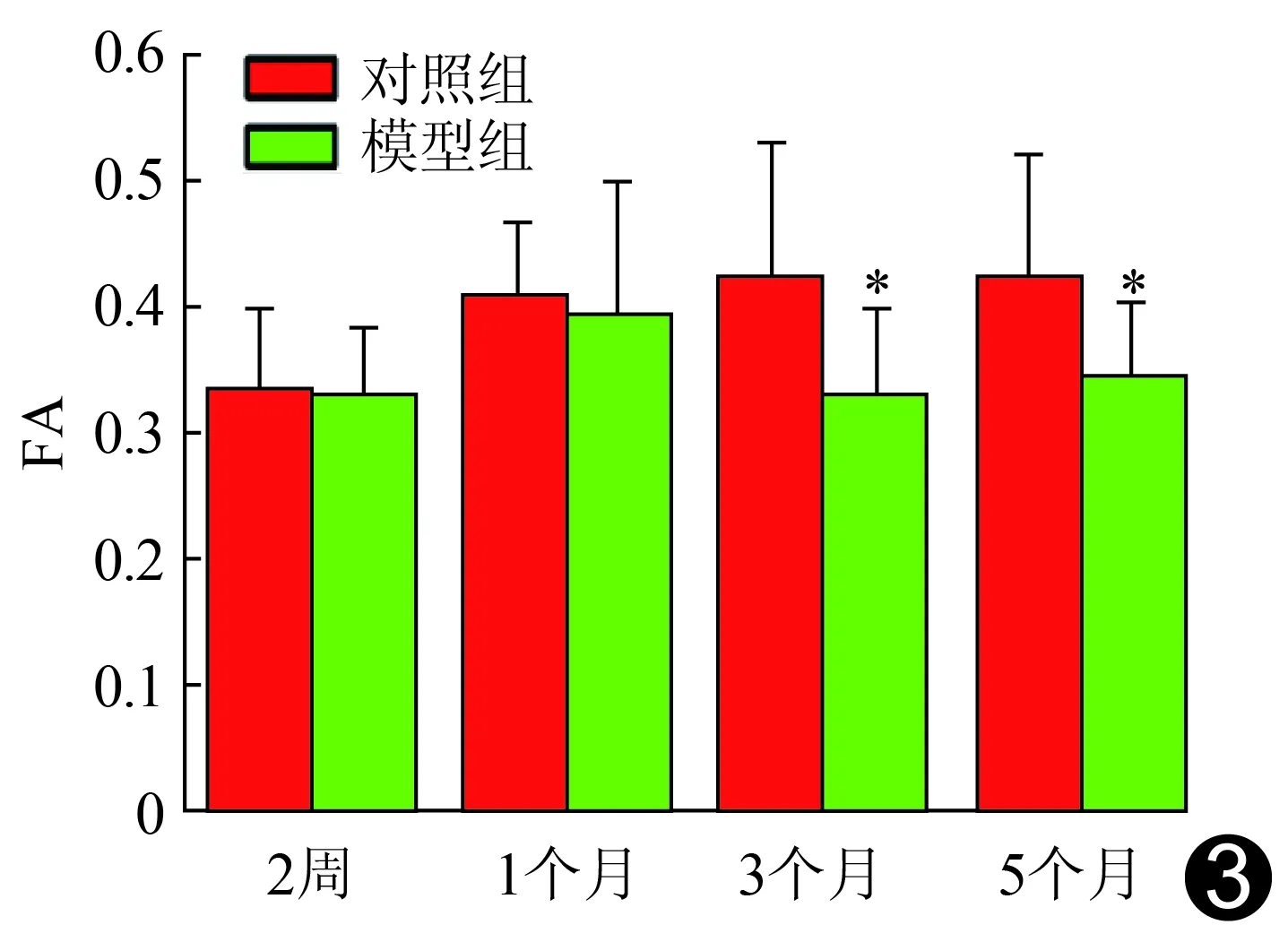
图3 2组大鼠术后不同时间点海马区FA值比较 (*:与对照组比较,P<0.05)
2.4 VCI大鼠脑海马区病理学变化 HE染色结果显示模型组大鼠海马区锥体细胞排列紊乱,数量减少,结构模糊,神经元出现核固缩,空泡化明显(图8A);尼氏染色结果显示模型组海马神经元细胞水肿,空泡变性,细胞胞浆内尼氏体颜色浅淡、轮廓模糊,数目减少,部分细胞内尼氏体溶解、消失(图8B)。
3 讨论
研究[4-6]显示,大脑长期慢性低灌注可导致动物发生认知功能障碍、皮层下白质损害、海马神经元损伤及脑小血管病变等,因此动物大脑长期反复慢性低灌注模型是复制VCI的较理想动物模型。本实验采用的改良四血管法是国际公认的VCI建模方法之一,其制作过程与VCI的发病机制接近,小血管病变明显,建模后病理变化及海马损伤显著[4-6]。Deng-Bryant等[7]研究显示,Morris水迷宫实验可用于检测大鼠的认知能力。本实验通过Morris水迷宫实验发现,与对照组相比模型组大鼠的学习和记忆能力明显降低,表明建模成功;且模型组术后2周、1个月、3个月、5个月大鼠的学习和记忆能力随着术后时间的延长而损害加重,提示此模型诱导产生了慢性持续性缺血性改变。

图4 模型组大鼠术后2周基于体素的FA值分析图 未见FA值显著下降的区域
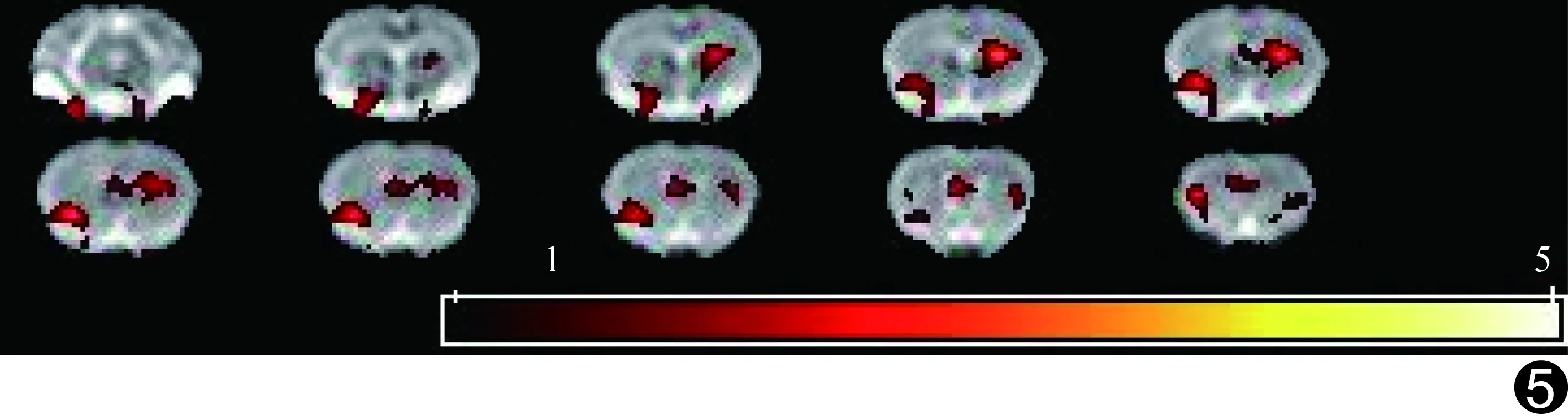
图5 模型组大鼠术后1个月基于体素的FA值分析图 FA值显著下降的区域主要为左侧丘脑、扣带、右侧岛叶、双侧额叶皮层、纹状体、胼胝体
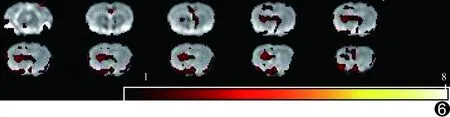
图6 模型组大鼠术后3个月基于体素的FA值分析图 FA值显著下降的区域主要为双侧丘脑、双侧纹状体、额叶皮质、右侧海马、前连合、胼胝体、岛叶、嗅束

图7 模型组大鼠术后5个月基于体素的FA值分析图 FA值显著下降的区域主要为双侧海马、额叶、顶叶、丘脑、双侧纹状体、前联合、胼胝体和扣带
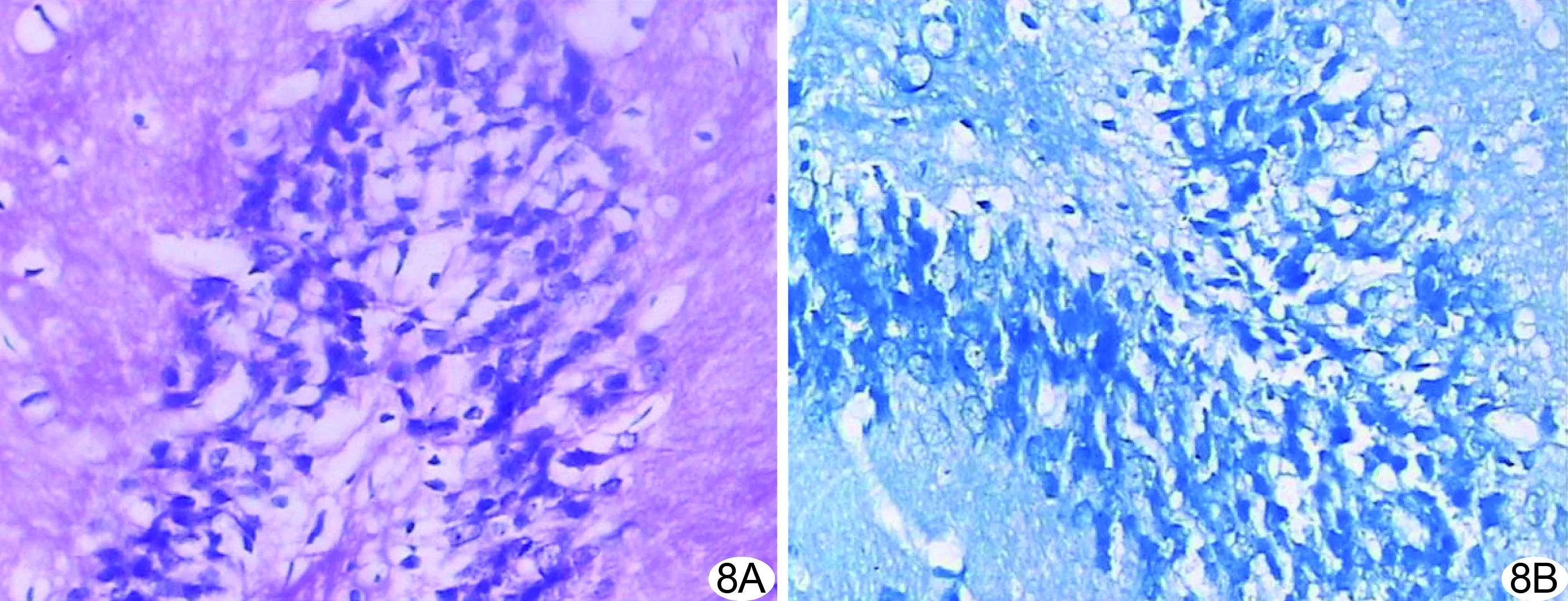
图8 模型组大鼠海马区病理变化 A.HE染色(×200); B.尼氏染色(×200)
VCI患者常伴不同程度的皮质萎缩,以颞叶海马萎缩为著[8-9]。动物实验[10]也显示VCI动物模型存在明显海马损伤,并导致认知能力受损,且认知能力下降程度与海马组织受损伤的体积有关。因此,本研究将海马作为ROI进行研究。本研究显示,与对照组比较,模型组大鼠3、5个月海马体积明显萎缩且海马区FA值明显减低(P均<0.05),提示海马体积的减小与白质的损伤有关;且随着时间的延长,海马组织损伤越重,认知能力下降越明显。本研究观察海马区病理组织学的变化,可见海马区锥体细胞排列紊乱、结构模糊,尼氏小体溶解、消失,与DTI显示FA值下降相符,进一步证实认知能力下降与海马区神经元损伤有关。
Soria等[11]通过动物研究发现,与假手术组比较,模型组动物梨状体、额叶、岛叶皮质区、海马、丘脑、纹状体和视神经道等FA值显著减少,相应学习与记忆功能显示受损。Choi等[12]通过DTI分析发现VCI患者认知能力下降,白质的超微结构损害逐步加重。本研究中,术后1个月模型组大鼠大脑即出现多部位FA值下降且FA值下降早于海马体积变化,提示FA值下降更有助于评估早期VD;术后1个月额叶FA值下降提示额叶微观白质发生了损害。研究[12]表明额叶-皮质下环路与VCI认知及执行功能有关,这一环路纤维发生破坏会导致认知及执行功能障碍。Fu等[13]研究发现VCI患者胼胝体FA值较对照组显著下降,胼胝体损害可导致记忆力和人格异常改变。本研究中模型组大鼠术后1、3、5个月VBA均可显示胼胝体损伤。扣带皮质是执行功能神经中枢的高级调控结构,其纤维损伤也可影响认知能力,本研究也发现模型组大鼠扣带损伤。此外,本研究还发现模型组大鼠模型丘脑、纹状体区域FA值下降,且随着时间延长,范围逐渐扩大,提示丘脑与纹状体损伤可能与认知能力的下降有关。
本研究的局限性为对VCI大鼠仅进行MRI与DTI扫描。多种功能MRI如磁共振波谱、磁敏感加权成像、动脉自旋标记等可从不同角度对疾病进行研究,对理解疾病的发病机制有帮助,还有待进一步补充。
总之,本研究发现,T2WI和DTI观察大鼠海马体积以及微观白质变化,有助于早期诊断VCI。全脑VBA分析可发现VCI大鼠脑内多个区域FA值下降,且随认知障碍程度加重,损伤范围逐渐扩大,其中额叶、丘脑、胼胝体、纹状体、扣带等区域与认知能力下降有关;FA值下降早于海马体积变化,提示FA值可作为早期诊断VCI及评估严重程度的观察指标。
[1] Raz L, Knoefel J, Bhaskar K, et al. The neuropathology and cerebrovascular mechanisms of dementia. J Cereb Blood Flow Metab, 2016,36(1):172-86.
[2] Jiwa NS, Garrard P, Hainsworth AH. Experimental models of vascular dementia and vascular cognitive impairment: A systematic review. J Neurochem, 2010,115(4):814-828.
[3] Hainsworth AH, Brittain JF, Khatun H. Pre-clinical models of human cerebral small vessel disease: Utility for clinical application. J Neurol Sci, 2012,322(1/2, SI):237-240.
[4] Gooch J, Wilcock DM. Animal models of vascular cognitive impairment and dementia (VCID). Cell Mol Neurobiol,2016,36(2):233-239.
[5] Sarti C, Pantoni L, Bartolini L, et al. Cognitive impairment and chronic cerebral hypoperfusion: What can be learned from experimental models. J Neurol Sci, 2002,203:263-266.
[6] Lee JS, Im A, An YS, et al. Chronic cerebral hypoperfusion in a mouse model of Alzheimer's disease: An additional contributing factor of cognitive impairment.Neurosci Lett, 2011,489(2):84-88.
[7] Deng-Bryant Y, Leung LY, Caudle K, et al. Cognitive evaluation using morris water maze in neurotrauma. Methods Mol Biol, 2016,1462:539-551.
[8] 李秋雨,沈智威,杨忠现,等.基于体素的形态测量学观察两种亚型血管性认知障碍患者脑灰质萎缩的差异.中国医学影像技术,2013,29(8):1267-1271.
[9] Yoon CW, Seo SW, Park JS, et al. Cerebellar atrophy in patients with subcortical-type vascular cognitive impairment. The Cerebellum, 2013,12(1):35-42.
[10] Juma WM, Lira A, Marzuk A, et al. C-reactive protein expression in a rodent model of chronic cerebral hypoperfusion. Brain Res, 2011,1414(4):85-93.
[11] Soria G, Tudela R, Marquez-Martin A, et al. The ins and outs of the BCCAo model for chronic hypoperfusion: A multimodal and longitudinal MRI approach. PLoS One, 2013,8(9):e74631.
[12] Choi S, Yoon D, Park JS, et al. Diffusion tensor imaging and cognition in patients with subcortical vascular cognitive impairment. Alzheimers Dement, 2011,7(4):752-752.
[13] Fu JL, Zhang T, Chang C, et al. The value of diffusion tensor imaging in the differential diagnosis of subcortical ischemic vascular dementia and Alzheimer's disease in patients with only mild white matter alterations on T2-weighted images. Acta Radiol, 2012,53(3):312-317.
三线表的规范格式
▲表序和表题:表序即表格的序号,一篇论文中如只有1个表格,则表序编为表1,表题即表格的名称,应准确得体并能确切反映表格的特定内容且简短精练。
▲项目栏:指表格顶线与栏目线之间的部分,栏目是该栏的名称,反映了表身中该栏信息的特征或属性。
▲表身:三线表内底线以上,栏目线以下的部分叫做表身,是表格的主体表身内的数字一般不带单位,百分数也不带百分号,均归并在栏目中表身中不应有空项,如确系无数字的栏,应区别情况对待,在表注中简要说明,不能轻易写“0”或画“-”线等填空,因“-”可代表阴性反应,“0”代表实测结果为零。
▲表注:必要时,应将表中的符号标记代码,以及需要说明的事项,以最简练的文字,横排于表题下作为表注也可附注于表下。

