葛根素与葛根多肽对小鼠酒精性肝损伤的治疗作用研究
张林松 徐卫东 石继伟 李 静 张逸帆 高建花 赵 敏
(1.镇江市食品药品监督检验中心,江苏镇江212000; 2.江苏大学药学院,江苏镇江212013)
酗酒的主要后果是酒精性肝损伤(ALD),它是慢性肝病的病因之一。ALD的早期表现主要为酒精性脂肪肝,常常继发更严重的酒精性肝硬化[1]。至今,对此病仍缺乏有针对性的治疗用药。葛根是豆科多年生落叶藤本植物野葛Pueraria lobata(Willd.)Ohwi的干燥根,主要含异黄酮类、三萜皂苷类、香豆素类等多种成分,但以葛根素的含量为最高[2],具有抗氧化、抗肿瘤、抗心律失常、降压、调节免疫、解酒等广泛的药理作用[3]。而葛根多肽鲜有人关注。本研究制作小鼠ALD模型,观察葛根提取物葛根素与葛根多肽对ALD模型小鼠的治疗作用。
1 实验材料
1.1 动物 清洁级昆明种小鼠(实验动物合格证号:201703331),雌雄各半,体重18~24g,由江苏大学实验动物中心培育;鼠饲料、垫料、鼠笼及实验动物房由江苏大学实验动物中心提供。实验用鼠置于(22±2)℃、每日光照时长约12h的动物笼中,可自由采食、饮水。
1.2 药物与试剂 葛根(亳州市佰世信中药饮片有限公司,产地:广西);碱性蛋白酶(Alcalase,2.4L,丹麦诺维信有限公司);谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆固醇(CHOL)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)测定试剂盒(南京市建成生物工程研究所);白酒(红星二锅头,56°,北京红星股份有限公司);水飞蓟宾葡甲胺溶液(原料购自江苏中兴药业有限公司,加水配成5mg/mL溶液);葛根素溶液(原料购自江苏天晟药业有限公司,加水配成5mg/mL溶液)。
1.3 仪器 MD SpectraMax190自动酶标仪(美国MD公司);U410超低温冰箱(三洋电器集团);ALPL-2LD冷冻干燥机(博医康实验仪器有限公司);pHS-3C精密pH/mV计(上海理达仪器厂);UV-7504单光束紫外-可见分光光度计(日本,岛津)。
2 实验方法
2.1 葛根多肽溶液的制备 将葛根饮片置烘箱中60℃干燥24h,冷却后粉碎,过四十目筛,置干燥器中保存备用。称取2kg葛根粉末置于容器中,加入50mmol/L pH=9的Tris-HCl缓冲液20000mL,充 分搅拌,然后置50℃水浴提取2h并浸泡过夜;取提取液5000r/min离心10min,上清液抽滤,合并抽滤液,用浓盐酸调pH至3,静置2h,再5000r/min离心10min,弃去上清液,合并沉淀,置-70℃环境下冷冻48h,真空冷冻干燥,即得葛根蛋白粉末,保存于干燥器中备用。取葛根蛋白粉末用无水乙醇洗净后,自然干燥备用。将上述葛根蛋白粉25g置于250mL烧杯中,加入用0.5mol/L盐酸或0.5mol/L氢氧化钠调pH至9.0的硼酸钠缓冲溶液100mL,搅匀,置于50℃水浴锅中静置20min使蛋白充分溶解,加入4g碱性蛋白酶(酶活力:3500U/g),再放入水浴锅(温度为61℃)中反应2h,反应过程中使用0.1mol/L氢氧化钠维持pH不变。反应完成后,沸水浴10min以灭活碱性蛋白酶,水浴降至室温,加入15%三氯乙酸100mL,搅匀,并用0.5mol/L盐酸或0.5mol/L氢氧化钠调pH至7.0,静置半小时,4000r/min离心10min,取上清液,即得5mg/mL葛根多肽溶液。
2.2 造模、给药与取材 取小鼠90只,随机分为正常组、模型组、阳性对照组(水飞蓟宾葡甲胺,0.5mg/kg)和葛根素低、中、高剂量组(0.25、0.5、1.5mg/kg)以及葛根多肽低、中、高剂量组(0.25、0.5、1.5mg/kg),每组10只。除正常组外,其余各组小鼠模仿人类饮酒-发病-治疗-再饮酒的过程[4]:每日1次连续4d灌胃白酒(0.12mL/10g),建立肝损伤模型;停酒2d后各给药组连续5d给予相应剂量的药品,每日1次,灌胃;第12天,再次给酒(0.12mL/10g)。次日,乙醚麻醉无痛取血,3000r/min离心取血清,用生化试剂盒检测;处死小鼠,取出肝脏,用PBS漂洗后,将肝样品去除胆囊,冻存于生理盐水中,以备进行损伤评估。
2.3 小鼠血清ALT、AST、CHOL、HDL、LDL检测 按照试剂盒说明,采用酶标仪检测和紫外分光光度计法测定小鼠血清ALT、AST、CHOL、HDL、LDL含 量,检测结果以mmol/L表示。
2.4 肝组织评分方法 采用5分制,按照损伤程度将鼠肝大叶分为五个等级进行评分[5]。0分:鼠肝肿胀、苍白,出现大量白色坏死点;1分:鼠肝肿胀,出现一定白色坏死点;2分:鼠肝出现少量白色坏死点;3分:鼠肝无明显坏死点,但表面不光滑;4分:鼠肝表面大部分光滑,但尚有少量粗糙带;5分:鼠肝红润,表面光滑。
表1 各组小鼠血清中ALT、AST、CHOL、HDL、LDL的含量变化(±s)
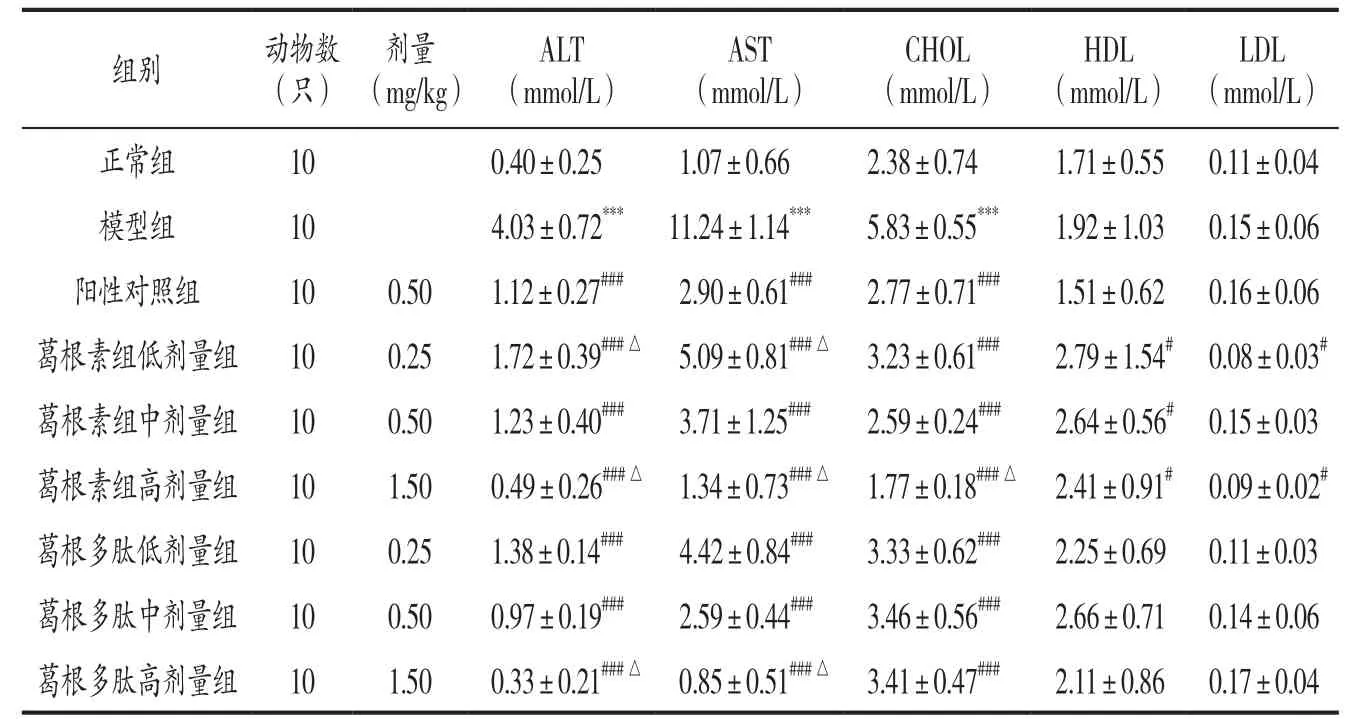
表1 各组小鼠血清中ALT、AST、CHOL、HDL、LDL的含量变化(±s)
注: 与正常组比较,***P<0.001 ;与模型组比较,#P<0.05,###P<0.001 ;与阳性对照组比较,△P<0.05。
正常组 10 0.40±0.25 1.07±0.66 2.38±0.74 1.71±0.55 0.11±0.04模型组 10 4.03±0.72*** 11.24±1.14*** 5.83±0.55*** 1.92±1.03 0.15±0.06阳性对照组 10 0.50 1.12±0.27### 2.90±0.61### 2.77±0.71### 1.51±0.62 0.16±0.06葛根素组低剂量组 10 0.25 1.72±0.39###△ 5.09±0.81###△ 3.23±0.61### 2.79±1.54# 0.08±0.03#葛根素组中剂量组 10 0.50 1.23±0.40### 3.71±1.25### 2.59±0.24### 2.64±0.56# 0.15±0.03葛根素组高剂量组 10 1.50 0.49±0.26###△ 1.34±0.73###△ 1.77±0.18###△ 2.41±0.91# 0.09±0.02#葛根多肽低剂量组 10 0.25 1.38±0.14### 4.42±0.84### 3.33±0.62### 2.25±0.69 0.11±0.03葛根多肽中剂量组 10 0.50 0.97±0.19### 2.59±0.44### 3.46±0.56### 2.66±0.71 0.14±0.06葛根多肽高剂量组 10 1.50 0.33±0.21###△ 0.85±0.51###△ 3.41±0.47### 2.11±0.86 0.17±0.04
2.5 统计学方法 所有实验计量资料数据采用SPSS 19.0统计分析软件进行统计学处理,以(x-±s)表示,组间比较采用单因素方差分析。
3 实验结果
3.1 各组小鼠血清ALT、AST、CHOL、HDL、LDL含量比较 见表1。与正常组比较,模型组小鼠ALT、AST、CHOL含量显著增加(P<0.001),HDL、LDL含量变化不显著(P>0.05)。与模型组比较,水飞蓟宾葡甲胺和葛根素、葛根多肽各剂量均能显著降低模型小鼠血清ALT、AST、CHOL含量(P<0.001),葛根素各剂量能显著提高HDL含量(P<0.05),葛根素低、高剂量能显著降低LDL含量(P<0.05)。高剂量葛根素和葛根多肽降低ALT、AST含量和高剂量葛根素降低CHOL含量效果与阳性药物相比更加显著(P<0.05)。
3.2 各组小鼠肝组织损伤评分比较 正常组小鼠肝脏组织红润,表面光滑;模型组小鼠肝脏组织肿胀、苍白,出现大量白色坏死点;阳性对照组小鼠肝脏组织表面大部分光滑,无明显坏死点;葛根素组和葛根多肽各剂量组小鼠肝脏组织损伤均有不同程度的减轻。模型组小鼠肝脏组织损伤评分明显低于正常组(P<0.001),各给药组评分均明显高于模型组(P<0.05,P<0.01,P<0.001),见表2。
4 讨论
酒精性肝损伤的确切发病机制尚不明确,目前研究认为其发病机制主要为机体反复多次过量摄入酒精,酒精在体内蓄积后,可能引起氧化应激、脂质过氧化、代谢、营养紊乱等一系列复杂反应,进而引起肝组织中甘油三酯含量聚积,胆固醇合成加强,并引起相应载脂蛋白含量的改变,从而导致肝细胞功能损伤[6-7]。酒精性肝脏脂肪变性及相关血清指标改变是酒精性肝损伤的早期表现[8]。
水飞蓟宾葡甲胺作为临床上常用的治疗酒精性肝损伤的药物,主要通过抗自由基活性,清除活性氧和对抗脂质过氧化,抑制一氧化氮的产生,降低磷脂酶活性,保护肝细胞,促进肝细胞修复、再生,调节免疫等发挥作用[9]。
临床常用血清学指标ALT、AST主要反映肝细胞损伤程度[10-11],其数值与肝细胞受损程度成正比。本实验结果表明,葛根素、葛根多肽均可在一定程度上降低由酒精导致的ALT、AST水平升高,高剂量的效果甚至优于阳性对照药水飞蓟宾葡甲胺,说明葛根素和葛根多肽均对肝脏细胞有一定的保护作用,且存在一定的量效关系。
酒精性肝损伤的另一显著特征是血脂代谢异常,表现为总胆固醇(CHOL)、载脂蛋白(HDL、LDL)等的变化。本实验结果表明,葛根素、葛根多肽均可不同程度地降低总胆固醇CHOL水平,升高HDL水平,有一定的量效关系。但在LDL水平方面,只有葛根素能有效降低其水平。说明葛根素、葛根多肽可改善乙醇诱导小鼠肝脏损伤造成的脂代谢异常,具体的干预机制还有待进一步研究。
表2 各组小鼠肝脏组织损伤评分比较(±s)
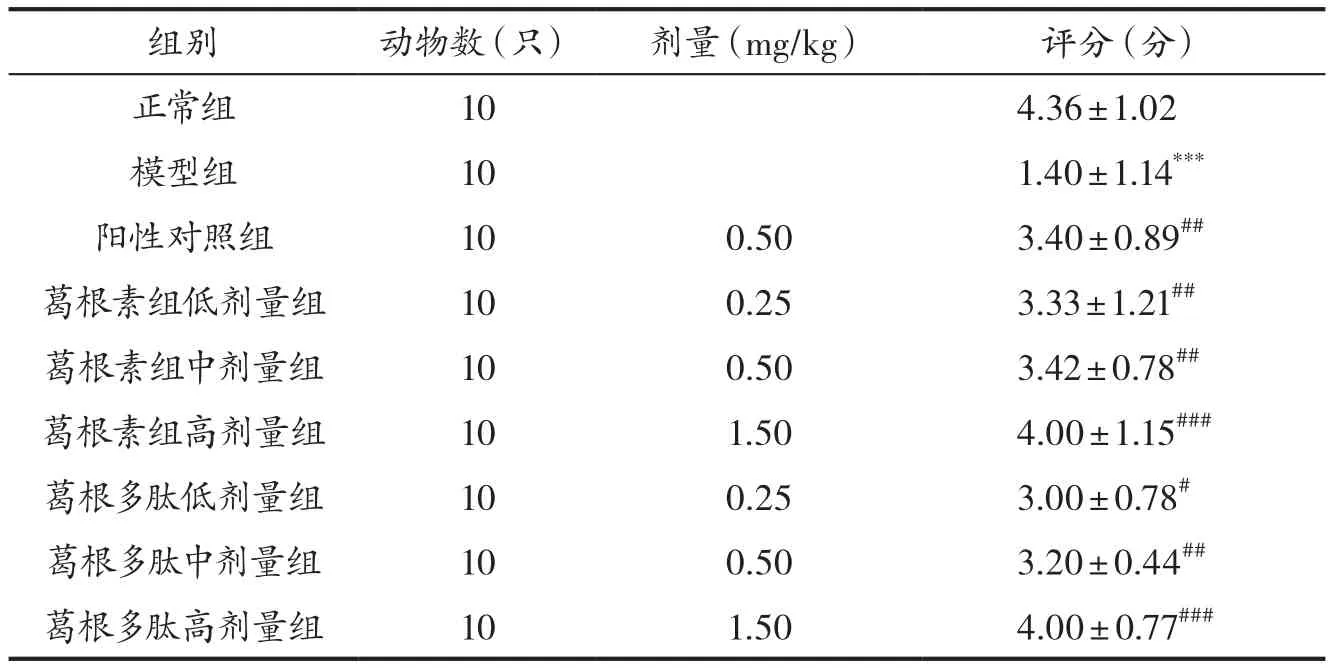
表2 各组小鼠肝脏组织损伤评分比较(±s)
注: 与 正 常 组 比 较,***P<0.001;与 模 型 组 比 较,#P<0.05,##P<0.01,###P<0.001。
组别 动物数(只) 剂量(mg/kg) 评分(分)正常组 10 4.36±1.02模型组 10 1.40±1.14***阳性对照组 10 0.50 3.40±0.89##葛根素组低剂量组 10 0.25 3.33±1.21##葛根素组中剂量组 10 0.50 3.42±0.78##葛根素组高剂量组 10 1.50 4.00±1.15###葛根多肽低剂量组 10 0.25 3.00±0.78#葛根多肽中剂量组 10 0.50 3.20±0.44##葛根多肽高剂量组 10 1.50 4.00±0.77###
[1] TORRUELLAS C,FRENCH S W,MEDICI V.Diagnosis of alcoholic liver disease[J].World J Gastroenterol,2014,20(33):11684.
[2] 迟霁菲.葛根化学成分和质量控制方法研究[D].沈阳:沈阳药科大学,2006.
[3] 伟唯,江培.葛根素药理作用研究进展[J].黑龙江医药,2014,27(1):51.
[4] LÍVERO F A,MARTINS G G,QUEIROZ TELLES J E,et al.Hydroethanolic extract of Baccharis trimera ameliorates alcoholic fatty liver disease in mice[J].Chem Biol Interact,2016,260:22.
[5] 吕丽莉,黄伟,于晓,等.不同柴胡组分对大鼠肝毒性与氧化损伤机制影响的研究[J].中国中药杂志,2009,34(18):2364.
[6] O'SHEA R S,DASARATHY S,MCCULLOUGH A J,et al.Alcoholic liver disease[J].Hepatology,2010,51(1):307.
[7] LIEBER C S.Alcoholic fatty liver:its pathogenesis and mechanism of progression to inflammation and fibrosis[J].Alcohol,2004,34(1):9.
[8] MADDREY W C.Alcohol and the liver:An overview[M].1n Alcoholic liver disease,ed. Hall P,London:Edward Amold,1995:3.
[9] 赵子刚.水飞蓟宾葡甲胺治疗酒精肝的作用机制[J].浙江临床医学,2009,11(5):491.
[10] NALPAS B,VASSAULT A,CHARPIN S,et al.Serum mitochondrial aspartate aminotransferase as a marker of chronic alcoholism:diagnostic value and interpretation in a liver unit[J].Hepatology,1986,6(4): 608.
[11] YYAANNGG LL,,LLAABBOORRIITTOORRYY DD OO..TThhee vvaalluuee ooff aassppaarrttaattee aammii--notransferase mitochondrial isoenzyme in scrum to patients with alcoholic liver diseases[J].International Journal of Laboratory Medicine,2016,39(18):2576.

