耐盐碱刺槐离体再生快繁体系的建立与优化
王兴翠,林桂玉,乔 宁,曹帮华
(1. 潍坊科技学院 蔬菜花卉研究所,山东 寿光 262700;2. 山东农业大学 生态与环境重点实验室,山东 泰安 271018)
为提高耐盐碱刺槐的快繁效率,满足沿海及滨海盐碱地区绿化要求,以耐盐碱刺槐无性系“W009”和“W038”为试材,研究不同条件对耐盐碱刺槐试管苗分化和生根的影响.结果表明:两刺槐茎尖初代接种不定芽萌发率均好于茎段,“W009”离体茎尖不定芽萌发的最适培养基为MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1,茎段不定芽萌发的最适培养基为MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;而适合“W038”离体茎尖和茎段不定芽萌发的最适培养基则为MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;适合“W009”不定芽增殖的培养基为MS+6-BA 1.0 mg·L-1+NAA 0.05 mg·L-1,“W038”不定芽增殖的培养基为MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1;“W009”最适生根培养基为:1/2 MS+0.1 mg·L-1IBA + 0.2 mg·L-1NAA+1.0 g·L-1活性炭;“W038” 最适生根培养基为:1/2 MS+0.3 mg·L-1IBA + 0.2 mg·L-1NAA+1.0 g·L-1活性炭.
耐盐碱刺槐;快繁再生;分化;生根
刺槐(RobiniapseudoacaciaL.),又名洋槐,由于其具有适应性强、生长快、抗盐、抗旱性较好等特点,在内陆盐碱地及滨海盐碱地大面积种植,为盐碱地区土壤理化性质的改良及沿海城市的绿化起到了很大作用[1-2].近年来,土地贫瘠及盐碱化严重制约了滨海地区生态工程建设和经济的发展,随着工业化进程的加快及黄河三角洲高效生态经济区发展的迫切要求,刺槐作为一种耐盐碱和绿化、观赏于一体的植物日益受到重视[3-4].传统的刺槐繁殖方法多采分蘖、根插,播种育苗移栽为主,但其繁殖系数低、速度慢,且易产生性状分离[5].植物组织培养技术是刺槐优良无性系快速繁殖的重要手段之一,尤其在目前城市园林绿化和生态建设对苗木需求加大的情况下,具有更重要的实践意义.通过茎尖、茎段、叶、形成层等组织或细胞的离体培养[6-10],可在短期内获得大量优良的刺槐苗木,而不同外植体[11-14]、植物生长调节物质[15-16]、树龄、琼脂用量[17-18]等因子都会产生一定影响.总结前人研究结果得出,不同刺槐品种无论在丛生芽直接诱导分化还是经愈伤组织诱导分化所需的激素配比及浓度不同,说明不同的基因型其无性系的建立及优化存在差异,因此针对不同刺槐品种材料有必要进行再生体系的建立及优化.为此,笔者对部分优良速生耐盐碱刺槐组织培养及植株再生的关键调控因子进行研究,建立优质高频稳定快繁体系,以期为沿海地区耐盐碱刺槐苗木的周年生产供应提供参考.
1 材料与方法
1.1 材 料
供试材料为从山东省东营市黄河三角洲实生刺槐林筛选的耐盐性较强的“W009”、“W038”2个刺槐无性系,将其田间种植选取当年生健壮枝条的半木质化嫩茎及幼嫩茎尖为试验材料.试验所用植物生长调节剂NAA、6-BA、IBA均为Sigma生物试剂进口分装产品;70%乙醇为95%乙醇(AR)稀释配制,由天津市北辰方正试剂厂生产;升汞溶液由贵州省铜仁化学试剂厂生产的HgCl2(AR)无菌水配制而成; MS培养基由杭州百思生物技术有限公司生产.
1.2 试验设计与方法
1.2.1 外植体的表面灭菌
将试验材料剪取顶部约1.5 cm幼嫩茎尖,其余部分切成1.5 cm左右的带腋芽茎段,自来水冲洗1 h后,在超净工作台上分别用70%的乙醇表面消毒(40,60 s),无菌水冲洗3~4次后,再用0.1% HgCl2加2~5滴吐温80消毒(4,6 min),最后用无菌水冲洗4~5次并用消毒滤纸吸干表面水分,接种到不加激素的MS培养基上进行培养.每处理3次重复,每个重复20瓶,为防止交叉感染每瓶接种1个外植体, 10 d后统计成活率和污染率,选择最佳外植体.
1.2.2 初代培养
根据1.2.1试验结果,幼嫩茎段经最佳消毒处理后,接种到MS+6-BA(0,0.5,1.0 mg·L-1)+NAA(0.05,0.1,0.2 mg·L-1)+琼脂7 g·L-1+蔗糖30 g·L-1的MS培养基上.每个处理接种30个外植体,重复3次.20 d后统计腋芽的萌发率及萌发芽的生长状况.
1.2.3 不定芽的继代增殖培养
将获得的无菌苗材料切成约1.0 cm的茎段,转接入MS+6-BA(1.0,2.0,3.0 mg·L-1)+NAA(0.05,0.1,0.2 mg·L-1)+蔗糖30 g·L-1+琼脂7 g·L-1的继代培养基上.每个处理接种30个外植体,重复3次.30 d后统计不定芽分化率和增殖系数,筛选刺槐丛生芽诱导最佳激素配方.
1.2.4 生根培养
将分化培养28 d的健壮丛生芽切分成单株(长度约1 cm),分别接种于附加不同浓度的NAA(0.2,0.5 mg·L-1)和6-BA(0,0.1 mg·L-1)的MS和1/2 MS的生根培养基上诱导生根.每个处理接种30个不定芽,3次重复.培养20 d后,观察生根情况并统计生根率、生根条数,选择最佳浓度配比的培养基.在此基础上,添加不同浓度活性炭(0~5 g·L-1),研究其对刺槐丛生芽生根的影响.
1.2.5 培养条件
以上试验,培养基均添加7 g·L-1琼脂,30 g·L-1蔗糖,调节pH为5.8,于121 ℃高压灭菌21 min.在 (25±2) ℃、光照条件为2 000 lx、光照周期为16 h· d-1的条件下进行培养.
1.2.6 数据统计与分析
污染率(%)=已污染的外植体数/接种外植体个数×100%;萌发率(%)=萌发腋芽的外植体数/接种外植体个数×100%;分化率(%)=已分化的外植体数/接种外植体总数×100%;增殖系数=不定芽分化总数/外植体个数;生根率(%)=已生根不定芽个数/不定芽接种个数×100%;株平均根数=总根数/生根的不定芽个数.
试验所得数据采用Excel和DPS数据处理系统进行分析[19],显著性检验采用邓肯氏新复极差法.
2 结果与分析
2.1 外植体灭菌时间的选择
以茎尖和带腋芽的茎段作为最初外植体,接种到初始培养基后随时观察外植体污染情况,经70%乙醇和0.1%升汞经不同消毒时间组合处理后,茎段和茎尖作为外植体的污染率和成活率见表1所述.
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
由表1可见,茎段和茎尖作为外植体其污染率和成活率有显著差别.以“W009”为例,随着消毒时间的延长,茎尖和茎段污染率均呈现下降趋势,但其成活率也随之降低,虽然带腋芽茎段污染率较茎尖低,但综合成活率选择,茎尖为最佳外植体选择,70%乙醇处理40 s + 0.1%升汞处理5 min消毒效果最好,成活率达到90.0%.不同消毒灭菌处理“W038”得到的结果与“W009”的有相似的趋势,但茎尖在70%乙醇处理60 s + 0.1%升汞处理3 min消毒后成活率达最高88.3%.
2.2 激素配比对刺槐初代培养不定芽萌发的影响
外植体在初代培养基培养约7 d后腋芽开始萌动,呈现嫩绿色,茎基部膨大随后产生愈伤组织,12 d后腋芽基部周围产生数量不等的丛生芽.附加低浓度的6-BA和NAA 有利腋芽的萌发,但6-BA/NAA值较低时,茎基部产生的愈伤组织较大,而较高浓度的6-BA和NAA腋芽萌发受阻,且对其生长造成影响.培养后期发现,分裂素浓度越高,虽然愈伤组织产生较少,但外植体基部肿胀程度随分裂素浓度的增加而增大,玻璃化现象越严重,叶片呈现透明程度越明显.表2列出了激素的不同配比对刺槐初代培养不定芽诱导萌发的影响.
表2 激素配比对刺槐初代培养不定芽诱导萌发率的影响 %

品种激素/(mg·L-1)茎尖茎段NAA0.020.050.10.20.020.050.10.2W0096-BA0.561.1cdCD77.8aA64.4cC52.2fEF58.9deC70.0abB65.6cBC50.0hE1.058.9deD71.1bB75.6aAB40.0hI60.0dC66.7bcB72.2aA55.6efgCDE1.550.0fFG56.7eDE58.9deD45.6gGH52.2ghDE54.5fgCDE57.8defCD43.3iF2.034.4iJ38.9hIJ40.0hI41.1hHI33.3kH37.8jGH40.0ijFG33.3kHW0386-BA0.561.1eDE72.2bAB60.0eEF50.0ghH56.7efDE65.6bB61.1cdBCD54.4fE1.065.6dCD68.9cBC76.7aA47.8ghHI60.0de64.4bcBC72.2aA45.6gF1.551.1gGH55.6fFG46.7hHI43.3iIJ56.7efDE65.6bB61.1cdBCD54.4fE2.026.7lL34.4kK38.9jJK37.8jK27.8iH43.3gF36.7hG25.6iH
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
由表2可知,随着6-BA和NAA浓度的增加,刺槐初代培养不定芽的萌发率基本呈现先增高后降低的趋势,激素浓度越大外植体萌发率越低,对不定芽的伤害越大,表现为不定芽瘦弱呈黄绿色.耐盐碱刺槐无性系“W009”离体茎尖不定芽萌发的激素配比在6-BA 和NAA组合分别为 0.5 mg·L-1+0.05 mg·L-1和1.0 mg·L-1+0.1 mg·L-1时没有显著性差异,第1种组合激素用量较少且不定芽萌发率高;激素配比为6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1时,最有利于茎段不定芽的萌发,萌发率为72.2%;适合“W038”离体茎尖和茎段不定芽萌发的最佳激素配比则为6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1.
2.3 激素配比对刺槐不定芽增殖的影响
通过观察,附加较低浓度的6-BA 和NAA,耐盐碱刺槐无性系“W009”无菌苗色泽鲜绿且生长旺盛,随着NAA浓度的升高,外植体基部愈伤组织体积也随之增大;“W038”不同处理同前者有相似的表现,但附加较高浓度的6-BA和NAA,各处理随着培养时间的增加不同程度地出现生长衰弱、叶片变黄脱落的现象.由表3~4可以看出,继代培养中较低浓度的6-BA对刺槐不定芽增殖作用显著,随着NAA浓度的增加,刺槐不定芽分化率和增殖系数则呈现相反的趋势.耐盐碱刺槐无性系“W009”不定芽分化率和增殖系数在6-BA浓度为1.0 mg·L-1,NAA 浓度为0.05 mg·L-1时均最大,分别为88.9%和3.5;而“W038”不定芽分化率和增殖系数在6-BA浓度为2.0 mg·L-1,NAA 浓度为0.1 mg·L-1时均最大,分别为76.7%和3.8;当6-BA浓度为3.0 mg·L-1,NAA 浓度为0.2 mg·L-1时,两耐盐碱刺槐无性系不定芽分化率及增殖系数均达到最低值.
表3 激素配比对刺槐不定芽分化率的影响 %

品种激素/(mg·L-1)6-BA1.02.03.0W009NAA0.0588.9aA84.4bB74.4dC0.181.1cB74.4dC60.0fE0.265.6eD66.7eD57.8fEW038NAA0.0572.2bAB61.1dDE60.0dEF0.165.6cCD76.7aA68.9bcBC0.251.1fGH55.6eFG46.7gH
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
表4 激素配比对刺槐不定芽增殖系数的影响 %

品种激素/(mg·L-1)6-BA1.02.03.0W009NAA0.053.5aA3.0bAB1.7fgF0.12.9bBC2.7bcBCD1.5gF0.22.4cdCDE2.3deDE1.9efEFW038NAA0.053.1bBC3.4bAB2.3cdDEF0.12.6cCD3.8aA2.1deDEF0.22.1deEF2.6cCDE1.7eF
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
2.4 培养基、激素配比和添加活性炭对刺槐不定芽生根的影响
在生根培养中,经观察耐盐碱刺槐无性系“W009”在附加0.1 mg·L-1IBA + 0.2 mg·L-1NAA的MS培养基上培养至第8 天时开始诱导生根,而“W038”在附加0.3 mg·L-1IBA + 0.2 mg·L-1NAA的MS培养基上培养至第9天时开始诱导生根,且诱导产生的不定根均生长迅速,部分有侧根,苗生长正常;10 d后可以看到两耐盐碱刺槐所有处理组合均诱导无菌苗生根,但随着激素浓度的增大,各处理试管苗的生根表现为缓慢、发根量变少、根细弱,生根率下降,且试管苗茎基部有愈伤组织产生.前期诱导过程中两耐盐碱刺槐无性系生根数急速上升(至诱导20 d),后期时间主要以根的生长为主,整体呈现急快-平缓趋势(图1).
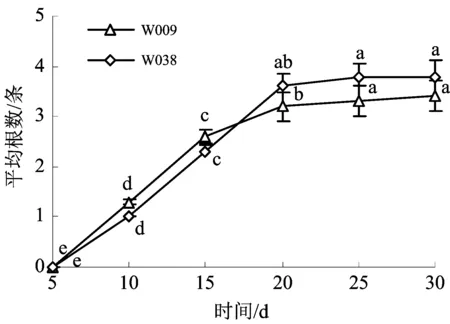
图中数值后不同小写字母表示处理间差异达显著水平(p≤0.05).图1 不同时间刺槐不定芽诱导生根情况
同时可以看出(表5),NAA和IBA 配合使用的生根效果明显优于单独使用NAA的效果.以MS为基本培养基,耐盐碱刺槐无性系“W009”和“W038”最佳生根浓度分别为NAA 0.2 mg·L-1+0.1 mg·L-1IBA和NAA 0.2 mg·L-1+0.3 mg·L-1IBA,生根率分别为76.7%和82.2%.以1/2 MS为基本培养基,最佳激素浓度配比诱导生根,发现不定根生长迅速,根系发育好,且生根率和生根条数较MS培养基高,耐盐碱刺槐无性系“W009”和“W038” 生根率和生根条数分别达80.0%、3.9条和83.3%、4.5条.由此得出,两耐盐碱刺槐无性系最佳生根培养基分别为1/2 MS+0.1 mg·L-1IBA + 0.2 mg·L-1NAA 和1/2 MS+0.3 mg·L-1IBA +NAA 0.2 mg·L-1.

表5 激素配比和培养基对刺槐不定芽生根的影响
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
不同浓度活性炭(AC)对刺槐不定芽生根的影响状况见表6所列.由表6看出,将两耐盐碱刺槐的丛生芽切分成单株后接种于附加蔗糖30 g·L-1+琼脂7 g·L-1和不同浓度活性炭的最佳生根培养基上诱导生根.观察发现,一定量的活性炭更有利于刺槐不定芽生根,不定芽茎基部基本无愈伤组织产生,侧根增多,但随着活性炭浓度的增大,刺槐生根率呈现下降趋势,且植株生长衰弱、株高降低.两耐盐碱刺槐均在添加1.0 g·L-1的活性炭的生根培养基上诱导生根效果最好,生根率和平均生根数均较高,分别为88.9%、4.8条和99.3%、5.7条.

表6 不同浓度活性炭(AC)对刺槐不定芽生根的影响
注:表中每列数值后不同大写字母表示处理间差异达极显著水平(p≤0.01),不同小写字母表示处理间差异达显著水平(p≤0.05).
3 讨 论
3.1 外源激素对耐盐碱刺槐不定芽分化和生长的影响
在植物离体培养中,外源细胞分裂素、生长素对不定芽的诱导和生长发育具有重要作用.Vain[20]证明植物生长调节剂在诱导苗再生方面的作用比植物激素本身更有效,生理活性更强.秦爱光等[21]研究发现,在6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1组合时,刺槐分化的不定芽最多,单个外植体分化芽数和有效芽数也最高.此外,刺槐不定芽增殖过程中,在培养基中加入一定配比的6-BA、IBA再配合加入TDZ及水解乳蛋白等更容易获得不定芽,不定芽的分化率高[5].笔者的研究结果表明,耐盐碱刺槐无性系“W009”在MS培养基中附加6-BA 0.5 mg·L-1、NAA 0.05 mg·L-1有利于刺槐不定芽的诱导和增殖;而“W038”在MS培养基中附加6-BA 2.0 mg·L-1、NAA 0.1 mg·L-1利于不定芽的诱导及增殖.
3.2 培养基及激素配比对刺槐不定芽生根的影响
相关研究表明,生根培养对基本培养基的类型要求不严,但培养基若富含N、P、K盐会抑制根的发生,因此,需将含盐浓度应适当稀释或降低至更低水平[22].此外,有研究还表明在生根培养基中适当加大生长素的浓度,不用或少用细胞分裂素生根效果好;生长素浓度过高时容易引起愈伤组织化和抑制根的生长[21,23].田琳琳等[24]研究得出,IBA可以快速诱导无刺桅杆槐和无刺槐生根,最佳生根培养基均为1/2MS+IBA 0.05 mg·L-1.而对于匈牙利速生刺槐NAA的生根影响大于IBA,在NAA 0.2 mg·L-1+IBA 0.1 mg·L-1时不定芽生根情况较好[21].笔者的试验研究结果表明,最佳诱导生根激素配比条件MS培养基较1/2 MS培养基两耐盐碱刺槐不定芽的生根率和根生长情况均较差,这与李云等[25]对刺槐生根研究的结果相似.此外,耐盐碱刺槐无性系“W009”生根诱导试验结果与秦爱光等[21]的研究结果基本一致,但“W038”则在NAA 0.2 mg·L-1+IBA 0.3 mg·L-1时诱导不定芽生根情况较好.
3.3 添加活性炭对刺槐生根的影响
在植物组织生根培养过程中,加入一定量(0.1%~0.5%)的活性炭对诱导生根作用明显,它可以提供生根的暗环境,同时还能防止褐变,提高培养基内可溶性蛋白和总糖的含量,但活性炭浓度过高时,则会抑制生根[5];此外,培养基加入活性炭,能够促进小麦试管苗外植体正常发育[22].无性系“W009”刺槐形成层愈伤组织分化不定芽生根过程中添加活性炭能显著改善生根质量,生根的最佳培养基为 1/2MS+NAA 0.2 mg·L-1+IBA 0.3 mg·L-1+AC 0.5 g·L-1 [5].该试验研究发现:添加活性炭在一定范围内对刺槐不定芽生根有促进作用,当活性炭浓度为1 g·L-1时,刺槐生根最好;浓度过高表现为生根率下降,虽然根长增加,但根变细,这可能与下列情况有关,即刺槐在再生快繁体系建立不同途径中,外源生长调节物质在外植体内的积累改变了刺槐不定芽内源激素的含量;不同浓度的活性炭其吸附能力的不同改变了不同途径中培养基中的生长调节物质和营养物质.
刺槐不定芽增殖及生根情况见图1所示.

a: “W009”不定芽分化增殖; b1: “W009”未添加AC诱导生根时试管苗生长情况; b2: “W009”未添加AC诱导生根时根的生长情况; c1: “W009”添加1.0 g/LAC诱导生根时试管苗生长情况; c2: “W009”添加1.0 g/LAC诱导生根时根的生长情况; A: “W038”不定芽分化增殖; B1: “W038”未添加AC诱导生根时试管苗生长情况; B2: “W038”未添加AC诱导生根时根的生长情况; C1: “W038”添加1.0 g/LAC诱导生根时试管苗生长情况; C2: “W038”添加1.0 g/LAC诱导生根时根的生长情况.图1 刺槐不定芽增殖及生根情况
4 结束语
消毒效果与刺槐外植体及杀毒时间有关,刺槐不定芽的分化、增殖及生根与基本培养基类型、激素水平及配比、是否添加活性炭等密切相关:两刺槐无性系茎尖初代接种不定芽萌发率均好于茎段;MS+6-BA 1.0 mg·L-1+NAA 0.05 mg·L-1有利于“W009”不定芽的增殖,MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1有利于“W038”不定芽的增殖;“W009”最适生根培养基为:1/2 MS+0.1 mg·L-1IBA + 0.2 mg·L-1NAA+1.0 g·L-1活性炭;“W038” 最适生根培养基为:1/2 MS+0.3 mg·L-1IBA + 0.2 mg·L-1NAA+1.0 g·L-1L活性炭.
[1] 杨建伟, 梁宗锁, 韩蕊莲. 不同土壤水分状况对刺槐的生长及水分利用特征的影响[J]. 林业科学, 2004, 40 (5): 93-98.
[2] 卢兴霞, 刘艳, 杨静慧, 等. 种植国槐和刺槐对滨海盐碱地理化性质的影响[J]. 北方园艺, 2016 (4): 64-67.
[3] 张亚玲, 田小伟, 曹锋军. 刺槐在景观绿化中的应用[J]. 国土绿化, 2009 (2): 47-48.
[4] 张璐, 孙向阳, 尚成海, 等. 津滨海地区盐碱地改良现状及展望[J]. 中国农学通报, 2010, 26 (18): 180-185.
[5] 韩义. 刺槐遗传转化受体系统建立及转RpNHX1基因[D]. 泰安: 山东农业大学林学院, 2014.
[6] RÉDEI K, OSVTH-BUJTS Z, BALLA I. Clonal approaches to growing black locust (Robiniapseudoacacia)in Hungary: a review [J]. Forestry, 2002, 75 (5): 547-552.
[7] EWAKD D, ULRICH K, NAUJOKS G, et al. Induction of tetraploid poplar and black locust plants using colchicine: chloroplast number as an early marker for selecting polyploidsinvitro[J]. Plant Cell, Tissue and Organ Culture, 2009, 9 (3): 353-357.
[8] HAN K H, KEATHLEY D E, GORDON M P. Cambial tissue culture and subsequent shoot regeneration from mature black locust (RobiniapseudoacaciaL. )[J]. Plant Cell Reports, 1993, 12 (4): 185-188.
[9] KAMLESH K, SEHGAL R N, DEEPAK S. Effect of explants type on the micro propagation ofRobiniapseudoacaciaL. [J]. India Journal of Forestry, 1995, 18 (1): 47-52.
[10] ARRILLAGA I, MERKLE S A. Regenerating plants from in vitro culture of black locust cotyledon and leaf explants[J]. Hort Science, 1993, 28 (9): 942-945.
[11] 姜丹, 胡瑞阳, 隋依含, 等. 刺槐子叶的不定芽诱导及植株再生[J]. 东北林业大学学报, 2012, 40 (10): 12-18.
[12] 习洋, 胡瑞阳, 王欢, 等. 刺槐未成熟合子胚的体细胞胚胎发生和植株再生[J]. 林业科学, 2012, 48 (1): 60-69.
[13] 李允菲. 刺槐、红花槐花药培养研究[D]. 北京: 北京林业大学生物科学与技术学院, 2013.
[14] 任云辉, 陈梦如, 冯明, 等. 刺槐下胚轴不定芽诱导及植株再生[J]. 东北林业大学学报, 2015, 43 (11): 9-13.
[15] 王莉, 李春燕, 邢震, 等. 培养基激素配比及琼脂用量对四倍体刺槐组培苗生根的影响[J]. 林业科技, 2004, 29 (2): 1-2.
[16] NAGAR D S, JHA S K, JANI J. Direct adventitious shoot bud formation on hypocotyls explants inMillettiapinnata(L. )Panigrahi-abiodiesel producing medicinal tree species[J]. Physiology and Molecular Biology of Plants, 2015, 21 (2): 287-292.
[17] HAN K H, KEATHLEY D E, DAVIS J M, et al. Regeneration of a transgenic woody legume (RobiniapseudoacaciaL., black locust)and morphological alterations induced by Agrobacterium rhizogenes-mediated transformation[J]. Plant Science, 1993, 88 (2): 149-157.
[18] OLIVEIRA S C, NUNES A C P, CARVALHO C R, et al. In vitro polyploidization from shoot tips ofJatrophacurcasL.: a biodiesel plant [J]. Plant Growth Regulation, 2013, 69 (1): 79-86.
[19] 唐启义. DPS数据处理系统[M]. 北京: 科学出版社, 2010: 105-110.
[20] VAIN P. Intron-mediated enhancement of gene expression in maize (ZeamaysL. )and bluegrass (PoapratensisL. )[J]. Plant Cell Rep, 1996, 15 (7): 489-494.
[21] 秦爱光, 罗晓芳. 匈牙利速生型刺槐遗传转化再生体系的建立[J]. 林业科学, 2006, 22 (5): 128-129.
[22] 姬玉梅, 王岭. 活性炭对小麦试管苗继代培养的影响[J]. 江苏农业科学, 2013, 4 (12): 47-48.
[23] 刘芳伊. 单叶刺槐和百子莲组培快繁体系建立[D]. 保定: 河北农业大学园艺学院, 2013.
[24] 田琳琳, 赵梁军. 无刺桅杆槐和无刺槐再生体系的研究[J]. 中国农业大学学报, 2010, 15 (4): 39-44.
[25] 李云, 王树芝. NAA和IBA对四倍体刺槐试管苗生根影响及不定根发育过程解剖观察[J]. 林业科学, 2004, 40 (3): 75-80.

