2型猪链球菌 RevS基因敲除突变株生物学特征及致病性研究
孙 雯,郑 峰
(1.扬州科技学院 医学院,江苏 扬州 225000;2.中国人民解放军南京军区 军事医学研究所,江苏 南京 210002)
比较2型猪链球菌(S.suis2) ΔRevS突变株和 05ZY/H33 野生株生物学特性及致病性的差异.首先,通过吸光值测定和革兰染色比较 △RevS突变株和 05ZY/H33 野生株的生长速度和菌体形态.分别对 Balb/c 及 ICR(CD1)小鼠腹腔注射 109CFU·mL-1的05ZY/H33 菌液,评估两种品系小鼠对S.suis2 的易感性.分别对 Balb/c 小鼠腹腔注射 2.5×109,5.0×108,1.0×108,2.0×107,4.0×106CFU·mL-1的05ZY/H33 菌液,采用Reed法计算半数致死量.对 Balb/c 小鼠腹腔注射 5.0×108CFU·mL-1的 ΔRevS突变株和 05ZY/H33 野生株菌液,观察野生株和突变株对小鼠的影响.对仔猪耳缘静脉注射 109CFU·mL-1的 05ZY/H33 野生株和 ΔRevS突变株菌液,观察野生株和突变株对仔猪的影响.体外生物学特征分析表明,与野生株相比,突变株的生长速率和形态染色并未发现显著变化;Balb/c小鼠对S.suis2 05ZY/H33 的敏感性高于 ICR(CD1)小鼠,05ZY/H33 对Balb/c小鼠的 LD50为 4.2×107CFU·mL-1.Balb/c 小鼠攻毒试验结果显示,ΔRevS对小鼠的致病性明显减弱.仔猪攻毒试验结果显示,野生株和突变株都引发仔猪全部死亡,但 ΔRevS引发仔猪死亡时间较晚.△RevS突变株保持了菌株的基本生物学特征,但对小鼠和仔猪两种动物模型的致病作用差异较大.
猪链球菌2型(S.suis2);二元调控转导系统;生长曲线;动物模型;半数致死量
猪链球菌(Streptococcussuis)属于链球菌属中的二级人兽共患病原菌,按其荚膜多糖抗原性不同分为1~34型和1/2型共35种血清型,其中2型猪链球菌(S.suis 2)不仅可致猪患严重疾病,如关节炎、败血症、脑膜炎及心内膜炎等,还能感染人致死[1].1998 年和2005年我国江苏海安和四川资阳都分别暴发了极其恶劣的S.suis2感染人的疫情,200多例患者出现链球菌中毒休克综合征(streptococcal toxic shock syndrome,简称STSS),病死率高达 60%~80%,引发紧急公共卫生事件[2].北京基因组所 Chen 等对2005年四川疫区从STSS患者组织中分离到S.suis2 05ZY/H33 和从健康猪组织中分离到的无毒株 05HAS68 进行了全基因组测序和功能注释[3],结果显示,05ZY/H33 中有15个二元信号转导系统(TCSTSs)在病原菌感染宿主的过程中,TCSTSs 操纵细菌对宿主的识别及多种毒力因子的表达[4].
笔者课题组试图通过基因敲除、动物模型构建及基因芯片等方法系统研究 TCSTSs 在S.suis2 05ZY/H33中的致病作用.吴涛等[5]已对S.suis2 05ZY/H33 中其中一对 TCSTSs 编码基因RevS(2090rr)进行了敲除,成功构建了RevS基因敲除突变株(即 △RevS),为深入研究RevS在S.suis2 致病中的功能,笔者比较了 △RevS突变株和 05ZY/H33 野生株的生物学特性,并建立小鼠和仔猪两种动物致病模型来比较 △RevS突变株和 05ZY/H33 野生株的毒力.
1 材料和方法
1.1 材 料
S.suis2 05ZY/H33 野生株分离于2005年四川资阳疫区,RevS敲除突变株(ΔRevS)由中国人民解放军南京军区军事医学研究所流行病所前期制备;THB(Todd-Hewitt Broth)培养基、壮观霉素抗生素购买于青岛海博生物公司;Balb/c 小鼠(4周龄,(20±1) g,雌性,SPF 级别,合格证号:2016YNB224)、ICR(CD1)小鼠(4周龄,(20±1) g,雌性,SPF 级别,合格证号:2016YNI220)和仔猪(3周龄,(20±1) kg,SPF 级别,合格证号:2016YNP122)购买于扬州大学农学院实验动物中心;10% 犊牛血清购买于 Difco 公司.
1.2 方 法
1.2.1 生长速率比较
平板划线法分别在 THB 琼脂培养上接种培养 05ZY/H33 野生株和 △RevS突变株,分别挑取 05ZY/H33 野生株和 △RevS突变株若干单菌落接种于 THB 培养液(不含壮观霉素和含壮观霉素)中,37 ℃ 培养过夜,测定 600 nm处的OD600值作为活菌计数.用 THB 培养液将 05ZY/H33 野生株和 △RevS突变株菌液稀释成相同浓度后,分别接种于 THB 培养液中,每隔1 h分别取两种菌液测定 OD600,然后以细菌培养时间为横坐标,以 OD600为纵坐标,比较两种菌株生长曲线的差别(每个菌株设3管重复,计算平均值).
1.2.2 革兰染色比较
根据上述绘制的细菌生长曲线,分别将05ZY/H33野生株和 △RevS突变株接种于THB 培养液(含10% 犊牛血清)中培养至对数期,对这两种菌液分别进行挑菌、干燥固定和革兰染色,用光学显微镜观察两种细菌的染色形态.
1.2.3 不同品系小鼠敏感性试验
将S.suis2 05ZY/H33 野生株以划线法接种于脱纤维羊血 THB 琼脂平板上,37 ℃ 培养 18 h,挑取若干单菌落接种于THB 培养液(含10% 犊牛血清)中 37 ℃ 培养 24 h,稀释(1∶50)后转接于THB 培养液(含10% 犊牛血清) 37 ℃ 再培养 8 h.血细胞计数器进行活菌记数,确定具体菌量.计数后的菌液分别对 Balb/c 小鼠及 ICR(CD1)小鼠各20只进行腹腔注射 0.5 mL 菌液,另取 Balb/c 及 ICR(CD1)小鼠各20只腹腔注射无菌 THB 作为空白对照.每日4次观察小鼠精神状况和临床表现,并做记录.选取症状严重的小鼠,尾静脉采血,进行细菌血培养.
1.2.4 Balb/c 小鼠半数致死量(LD50)测定
按上述方法处理S.suis2 05ZY/H33 野生株菌液,血细胞计数器进行活菌记数后,用 THB 培养液(含10% 犊牛血清)进行5倍比稀释,共稀释4次,形成 2.5×109,5.0×108,1.0×108,2.0×107,4.0×106CFU·mL-15个浓度梯度.选取60只 Balb/c 小鼠,随机等分成6组,1~5组分别腹腔注射 2.5×109,5.0×108,1.0×108,2.0×107,4.0×106CFU·mL-15个稀释度的菌液,每只 0.5 mL;第6组注射无菌 THB 液体培养基,每只 0.5 mL,作为空白对照组.每天观察4次,连续观察两周,做记录.采用 Reed-Muench 计算法[15]计算细菌对 Balb/c 小鼠的半数致死量LD50.
1.2.5 05ZY/H33和 ΔRevS对 Balb/c 小鼠攻毒试验
按上述方法分别处理 05ZY/H33 野生株和 ΔRevS突变株菌液,分别用血细胞计数器进行活菌计数,使用无菌 THB 培养液(含血清)分别对野生株和突变株菌液进行稀释,使菌液浓度大于 1.0×108CFU·mL-1.选取30只 Balb/c 小鼠,随机等分成3组,第1组小鼠腹腔注射稀释后的 05ZY/H33 野生株菌液,每只 0.5 mL,第2组小鼠腹腔注射稀释后的 ΔRevS突变株菌液,每只 0.5 mL;第3组小鼠腹腔注射相同体积的 THB 作为空白对照组.每天观察4次,连续观察两周,做记录.选取症状严重的小鼠,尾静脉采血,进行细菌血培养.
1.2.6 05ZY/H33和 ΔRevS对仔猪攻毒试验
按上述方法处理处理S.suis2 05ZY/H33 野生株菌液,血细胞计数器进行活菌计数,将菌液离心浓缩后用灭菌 THB 培养液(含血清)重悬,分别稀释成 1×1010,1×109,1×108,1×107CFU·mL-1几个不同浓度,然后分别对仔猪耳缘静脉注射进行预实验,发现当 05ZY/H33 野生株菌液浓度为 1×109CFU·mL-1时,仔猪的临床症状最接近临床发病仔猪症状,故采用 1×109CFU·mL-1作为仔猪攻毒浓度.分别将 05ZY/H33 野生株和 ΔRevS突变株的菌液浓度调整至大于 1.0×109CFU·mL-1.购买的18只仔猪,随机分成3组.第1组仔猪耳缘静脉注射 109CFU·mL-1的 05ZY/H33 野生株菌液,每只1 mL;第2组仔猪耳缘静脉注射 109CFU·mL-1的 ΔRevS突变株菌液,每只1 mL;第3组为空白对照,每只耳缘静脉注射灭菌 THB 1 mL.每日4次观察仔猪的临床表现及死亡情况.对死亡仔猪立即进行解剖,无菌采集肝脏、心血组织进行细菌分离培养及鉴定.
2 结 果
2.1 生长速率比较
05ZY/H33 野生株和 △RevS突变株生长曲线如图1所示.

图1 05ZY/H33 野生株和 △RevS突变株与的生长曲线
图1显示,两者生长速率相近,分别经历3 h迟缓期后进入对数生长期,培养10 h后进入稳定期.
2.2 革兰氏染色
分别挑取对数生长期的 05ZY/H33 野生株和 △RevS突变株菌液进行涂片、干燥、固定和革兰染色、油镜观察,结果见图2.

图2 05ZY/H33 野生株(A)和 △RevS突变株(B)革兰染色镜检
图2显示,两者均为革兰染色阳性链状排列球菌,差别不大.
2.3 不同品系小鼠对 S. suis 2 05ZY/H33 的敏感性
血细胞计数器活菌记数显示,此次攻毒的细菌浓度约为 2.5×109CFU·mL-1.Balb/c 实验组和空白组、ICR(CD1)实验组和空白组小鼠的临床表现见表1.图3中可看出 Balb/c 小鼠对S.suis2 05ZY/H33 的敏感性明显高于 ICR(CD1)小鼠(p<0.05),故将选择 Balb/c 小鼠作为动物模型.发病小鼠尾静脉血细菌培养和鉴定结果确定组织标本中的细菌是S.suis2 05ZY/H33,提示腹腔中的S.suis2 能够进入小鼠血循环.

表1 攻毒后 Balb/c 和 ICR(CD1)小鼠临床表现

图3 Balb/c 和 ICR(CD1)小鼠攻毒后死亡情况
2.4 Balb/c小鼠半数致死量(LD50)计算
参考 Reed-Muench 法计算得出S.suis2 05ZY/H33 对 Balb/c 小鼠的半数致死量(LD50)为 4.2×107CFU(见表2).

表2 Balb/c小鼠死亡情况
2.5 05ZY/H33 和 ΔRevS对 Balb/c 小鼠攻毒试验比较
通过5倍比稀释,活菌记数显示,05ZY/H33 与 ΔRevS菌液浓度为 5.0×108CFU·mL-1达到半数致死量(见图4).

图4 Balb/c小鼠死亡情况
由图4可以看出, 05ZY/H33 实验组小鼠全部死亡,ΔRevS实验组小鼠1只死亡(p<0.05),空白对照组小鼠没有死亡.两组发病小鼠尾静脉血细菌培养和鉴定结果确定组织标本中的细菌分别是 05ZY/H33 野生株和ΔRevS突变株,提示两组细菌均可通过腹腔进入小鼠血循环.
2.6 05ZY/H33 和 ΔRevS对仔猪攻毒试验比较
通过预实验发现,当 05ZY/H33 菌液浓度为 1×109CFU·mL-1时,仔猪的临床症状最接近临床发病仔猪症状,故将 05ZY/H33 与 ΔRevS菌液浓度调整为 1.0×109CFU·mL-1.05ZY/H33 实验组仔猪、ΔRevS实验组仔猪和空白组仔猪的临床表现见表3所列.05ZY/H33野生株和ΔRevS突变株对仔猪攻毒的成活结果如图5所示.

表3 攻毒后仔猪临床表现
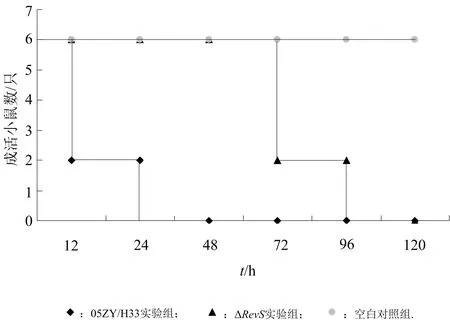
图5 05ZY/H33 野生株和 ΔRevS突变株对仔猪攻毒试验比较
由图5可以看出,05ZY/H33 实验组和 ΔRevS实验组仔猪全部死亡,空白对照组仔猪没有死亡,但 05ZY/H33 实验组仔猪 48 h 全部死亡,ΔRevS实验组仔猪 96 h 出现死亡,120 h 全部死亡.解剖、组织器官细菌培养及鉴定显示,死亡仔猪的腹股沟和肠系膜淋巴结严重肿大并出血,肠壁点状出血,肺、肝、肾淤血,脾脏边缘坏死.野生株和突变株均在死亡仔猪的淋巴结、心、肺、肾、肝、脾及脑脊液等部位存在.
3 讨 论
笔者通过比较 △RevS突变株和 05ZY/H33 野生株的生长速度和革兰染色特性,发现两种菌株没有明显差异,因此RevS基因的缺失可能不会影响S.suis2 的基本生物学特性.
国外报道提到,不同品系的小鼠对致病性S.suis的敏感性不同,即使同一品系的小鼠其敏感性也不一定相同[6-7].Kataoka 等[8-9]指出 ICR(CD1)小鼠对S.suis的敏感性较差,Gottschalk M 的观点则完全相反[10],这可能是由于小鼠饲养环境和菌株来源的差异所致.鉴于国内外均有 Balb/c 小鼠和 ICR(CD1)小鼠对S.suis较敏感的报道[11-12],且两者均属于国内常用实验小鼠,故在该研究中选取 Balb/c 小鼠和 ICR(CD1)小鼠这两种品系测试对S.suis2 05ZY/H33 的敏感程度.结果显示,该攻毒实验中,Balb/c 小鼠比 ICR(CD1)小鼠表现出对 05ZY/H33更敏感的特点.这可能是因为 ICR(CD1)小鼠的生长速度快,随着日龄的增加,敏感性变化较大,而 Balb/c 小鼠生长速度缓慢,在一段时间内敏感性则较为稳定.
笔者接着选取 Balb/c 小鼠作为模型动物,并参考了 Beaudoin[13]建立的标准化猪链球菌小鼠致病模型,攻毒前对 Balb/c 小鼠的日龄、05ZY/H33 菌株培养时间、培养基中是否添加血清等细节进行参数评估,最终得出最佳攻毒方案.评估显示,培养时间对细菌毒力影响较大,这与Beaudoin等[13]的报道一致.相比于 PBS,用 THB 培养液对细菌稀释效果更好.此外,培养基中添加 10% 的犊牛血清,细菌毒力会更强.之前多数小鼠模型的建立者认为小鼠能够模拟猪或人的感染,从而有效区分S.suis强、弱毒株,Vecht 研究小组[14]却发现,猪链球菌对小鼠和猪的致病性有时完全不同,小鼠和猪的器官损伤差异也较大,并推测S.suis对动物的致病性存在宿主差异性,小鼠模型的可信度并不高.鉴于小鼠模型比较经济方便,可以将小鼠和猪这两种动物模型相结合,更加可行也可信[15].笔者研究的 Balb/c 小鼠攻毒试验结果显示,攻毒剂量为5.0×108CFU·mL-1时,05ZY/H33 实验组小鼠在 24 h 内全部死亡(而在 Balb/c 小鼠半数致死量测定时,小鼠在 96 h 内全部死亡,这可能是小鼠个体差异性所致),ΔRevS突变株只导致了1只小鼠的死亡,提示在 Balb/c 小鼠模型中RevS可能与S.suis2 的致病相关.此外,攻毒剂量随着实验动物的种类、大小、年龄等特性的不同而随之变化,鉴于国内外学者所建立的S.suis2 仔猪感染模型的攻毒剂量大多在 1.0×107~1.0×1010CFU·mL-1范围内,笔者首先在仔猪模型预实验中比较了 107,108,109,1010CFU·mL-14个不同浓度,最终发现 1.0×109CFU·mL-1较为合适.仔猪攻毒试验结果显示,05ZY/H33 野生株和 ΔRevS突变株在仔猪致病性上存在相似性,最终都导致仔猪全部死亡.但 05ZY/H33 野生株毒力较强,能引发仔猪在未表现出显著临床症状前急速死亡,而 ΔRevS突变株毒力相对较弱,引发仔猪 96 h 才出现死亡,120 h 全部死亡,临床症状明显.
综上所述,ΔRevS突变株对小鼠和仔猪两种动物模型的致病作用差异较大.这可能是由于宿主的差异导致S.suis2 感染过程中涉及的毒力成分及应对的宿主应答方式不同[16],在相关文献中也有报道.其次,攻毒方式的不同也可能导致 ΔRevS突变株对小鼠和仔猪两种动物致病性的差异,由于S.suis是一种条件致病菌,只有当猪免疫力下降或应激状态下才会感染此菌[17],研究者尝试了多种攻毒方式模拟S.suis的天然感染状态,但结果却不理想[18].S.suis2 中的 RevS与产气荚膜梭菌(C.perfringens)中VirR/S氨基酸序列同源性很高,VirR/S 在C.perfringens中可全面调控溶血素、蛋白酶、磷脂酶C、胶原酶、唾液酸酶、血凝素等多种毒力因子的表达[19].由于S.suis2 中也含有上述类似成分,推测RevS在S.suis2 中也参与这些毒素组分的调控[20].
动物模型可直观评价病原菌中致病因子的作用,但鉴于S.suis动物模型存在有效性的争议,该试验结果中两种动物模型的致病表现有必要进行深入探讨.笔者课题组下一步将利用基因芯片技术研究RevS编码基因敲除后对S.suis2中其他毒力蛋白转录的影响,寻找 RevS的调控基因,为揭示S.suis2 感染过程中涉及的分子致病机制提供思路.
[1] ZHANG Y Y, DING D D, LIU M L, et al. Effect of the glycosyltransferases on the capsular polysaccharide synthesis ofStreptococcussuisserotype 2[J]. Microbiological Research, 2016, 185 (1): 27-37.
[2] TANG J, WANG C, FENG Y, et al. Streptococcal toxic shock syndrome caused byStreptococcussuisserotype 2[J]. PLoS Med, 2006, 3 (2): 151-155.
[3] CHEN C, TANG J, DONG W, et al. A glimpse of streptococcal toxic shock syndrome from comparative genomics ofS.suis2 Chinese isolates[J]. PLoS ONE, 2007, 2 (3): 315-320.
[4] LAZAR A N R, ALLOOD E M, DEVESON L D, et al. Perturbation of the two-component signal transduction system, BprRS, results in attenuated virulence and motility defects inBurkholderiapseudomallei[J]. BMC Genomics, 2016, 17 (1): 331-336.
[5] WU T, CHANG H, TAN C, et al. The orphan response regulator RevSC21 controls the attachment ofStreptococcussuisserotype 2 to human laryngeal epithelial cells and the expression of virulence genes[J]. FEMS Microbiology Letters, 2009, 292 (2): 170-181.
[6] GE G A, VAN S S, BUYS H, et al. Pneumococcal colonization and invasive disease studied in a porcine model[J]. BMC Microbiology, 2016, 16 (1): 102-108.
[7] MANDANICI F, GOMEZ G L, GARIBALDI M, et al. A surface protein ofStreptococcussuisserotype 2 identified by proteomics protects mice against infection[J]. Journal of Proteomics, 2010, 73 (12): 2365-2369.
[8] KATAOKA Y, YAMASHITA T, SUNAGA S, et al. An enzyme-linked immunosorbent assay (ELISA) for the detection of antibody againstStreptococcussuistype 2 in infected pigs[J]. The Journal of Veterinary Medical Science, 1996, 58 (4): 369-372.
[9] KATAOKA Y, YOSHIDA T, SAWADA T. A 10 year survey of antimicrobial susceptibility ofstreptococcussuisisolates from swine in Japan[J]. Journal of Veterinary Medical Science, 2000, 62 (10): 1053-1057.
[10] TURGEON P L, HIGGINS R, GOTTSCHALK M, et al. Antimicrobial susceptibility ofStreptococcussuisisolates[J]. The British Veterinary Journal, 1994, 150 (3): 263-269.
[11] BERTHELOT H F, GOTTSCHALK M, MORVAN H, et al. Dilemma of virulence ofStreptococcussuis: Canadian isolate 89-1591 characterized as a virulent strain using a standardized experimental model in pigs[J]. Canadian Journal of Veterinary Research, 2005, 69 (3): 236-240.
[12] VECHT U, STOCKHOFE Z N, TETENBURG B J, et al. Murine and pig models ofStreptococcussuistype 2 infections are incompatible[J]. Advances in Experimental Medicine and Biology, 1997, 418 (11): 827-829.
[13] BEAUDOIN M, HIGGINS R, HAREL J, et al. Studies on a murine model for evaluation of virulence ofStreptococcussuiscapsular type 2 isolates[J]. FEMS Microbiology Letters, 1992, 78 (23): 111-116.
[14] Vecht U, Stockhofe-Zurwieden N, Tetenburg B J, et al. Virulence ofStreptococcussuistype 2 for mice and pigs appeared host-specific[J]. Veterinary Microbiology, 1998, 58 (1): 53-60.
[15] LI J, XIA J, TAN C, et al. Evaluation of the immunogenicity and the protective efficacy of a novel identified immunogenic protein, SsPepO, ofStreptococcussuisserotype 2[J]. Vaccine, 2011, 29 (38): 6514-6519.
[16] WANG Y, ZHANG W, WU Z F, et al. Reduced virulence is an important characteristic of biofilm infection ofStreptococcussuis[J]. FEMS Microbiology Letters, 2011, 316 (1): 36-43.
[17] TARRADAS C, BORGE C, LUQUE I, et al. Suilysin production byStreptococcussuisstrains isolated from diseased and healthy carrier pigs in Spain[J]. Veterinary Record, 2001, 148 (14): 183-184.
[18] JOBIN M C, MARTINE G, GRENIER D. Cloning, purification, and enzymatic properties of dipeptidyl peptidase IV from the swine pathogenStreptococcussuis[J]. J Bacteriol, 2005, 187 (22): 795-799.
[19] WANG H H, SHEN X D, ZHAO Y, et al. Identification and proteome analysis of the two-component VirR / VirS system in epidemicStreptococcussuisserotype 2[J]. FEMS Microbiol Lett, 2012, 333 (2): 327-335.
[20] CHEUNG J K, KEYBURN A L, CARTER G P, et al. The VirSR two-component signal transduction system regulates NetB toxin production in Clostridium perfringens[J]. Infection and Immunity, 2010, 78 (7): 3064-3072.

