生物膜中活性菌株的分离纯化及抑藻活性研究
唐桂明,丛巍巍,王 科,于雪艳,张华庆,吕 钊,桂泰江
(1.大连辽南船厂,辽宁大连 116041;2.海洋涂料国家重点实验室,海洋化工研究院有限公司,山东青岛 266071)
0 引言
海洋是生命的摇篮,给人类提供了丰富的资源和能源,与人类的生活早已密不可分。但在人类开发和利用海洋资源的过程中,海洋中的污损生物[1]给航运、海水养殖以及海洋工程等带来巨大的安全隐患和经济损失。它们的附着污损会加速船体及浸海设施的腐蚀[2];增加船舶的航行阻力[3-4];增大燃油消耗[5];导致二氧化碳排放量增加和全球温室效应加剧;堵塞养殖网箱[6]以及冷却水管道;使海洋仪器仪表失灵;影响舰艇航速以及声纳装置的侦查性能[7];削弱军舰的战斗力等。并且外来物种的入侵对海洋生态的破坏也是难以估量的,据世界自然保护联盟(IUCN)2014年报告中称,世界上90%以上的生态系统都曾遭受过外来物种入侵,外来物种的入侵导致了全球20%脊椎动物的灭绝,每年给全球造成数千亿美元的损失[8]。迄今为止,涂覆防污涂料仍然是众多防止海洋生物附着的方法中最为经济和有效的措施。
传统防污涂料[9]通过砷、汞、铅等重金属的释放,在涂层周围产生毒性环境,对污损海生物进行趋避毒杀。其释放的重金属在海洋中难以降解,随着生物链的传递,在海洋生物体内蓄积。在取得良好防污效果的同时,亦给海洋生态造成难以修复的创伤。为此,各国纷纷出台相应的公约及环保法规以限制防污毒剂的使用,并要求对含防污剂的防污涂料进行海洋环境风险评估,提高了此类防污涂料的市场准入门槛。现阶段市场的主流技术产品——无锡自抛光防污涂料,以氧化亚铜[10]作为主防污剂,其含量高达30%~50%,据统计,每年约有几百万升以铜类防污剂为主的防污毒料释放到海洋中,它们会在海洋,特别是海港中大量积聚,影响海生物呼吸并致其死亡,从而破坏生态环境。因此环境友好型防污剂的开发和使用凸显其重要性。近年来,从天然产物[11]中提取次级代谢物等活性物质作为有毒防污剂的替代产品的探索一直没有停止脚步。本研究以青岛海域生物膜中分离纯化的活性菌株作为受试菌株,考察其对藻类的抑制附着行为,为环境友好型防污剂的研发提供基础指导。
1 试验仪器及材料
1.1 试验仪器
LDZX-50FBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂;GXZ-3100型光照培养箱,宁波江南仪器厂;SIGMA离心机,德国;CASY快速细胞活力分析仪,德国Innovatis公司。
1.2 试剂
氯化钠(NaCl),分析纯,天津科密欧化学试剂开发中心;氯化钾(KCl),分析纯,国药集团化学试剂有限公司;磷酸氢二钠(Na2HPO4),分析纯,天津广成化学试剂有限公司;磷酸二氢钾(KH2PO4),分析纯,国药集团化学试剂有限公司。
1.3 试验生物
海洋微藻中肋骨条藻(Skeletonema costatum):硅藻门、中心纲、圆筛藻目、骨条藻科、骨条藻属。中肋骨条藻是一种广温广盐的海洋浮游硅藻,它广泛分布于世界各大洋的近海海域,对近岸海域初级生产力以及海洋生态系统的稳定具有重要作用[12]。中肋骨条藻是我国沿海近岸海域浮游植物常见优势种类[13],其赤潮也频繁发生。因此本研究将其作为试验生物。
1.4 活性菌株
通过对防污涂料样板表面生物膜进行分离纯化,共获得6种活性菌株,如表1所示。
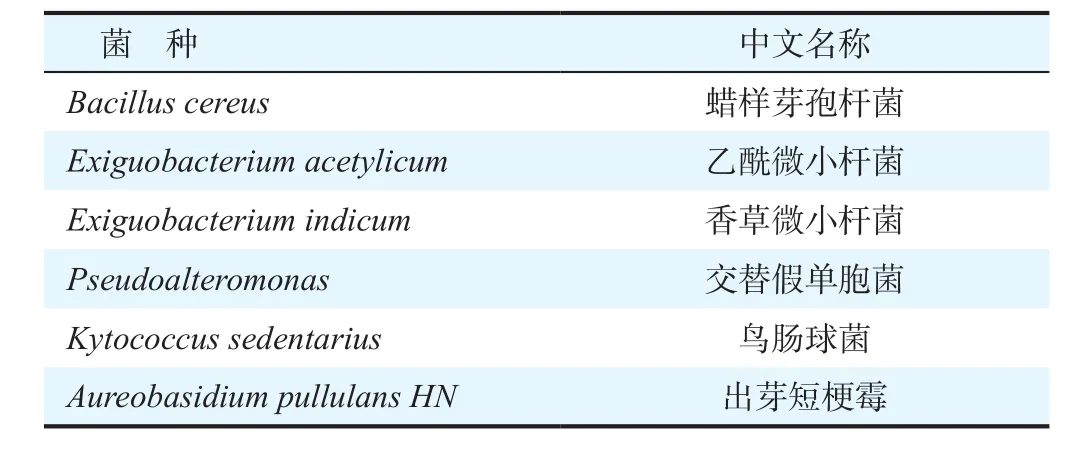
表1 筛选活性菌株Table 1 Choice of active strains
2 CASY缓冲溶液的配制
分别称取8.00 g NaCl、0.20 g KCl、3.58 g Na2HPO4、0.24 g KH2PO4溶解于1 L蒸馏水中,待完全溶解后,采用0.22 µm醋酸纤维膜对缓冲溶液进行过滤,得到CASY缓冲溶液,并将其置于4~25℃下保存[14]。
3 试验方法
3.1 f/2营养液的制备及上清液的获得
先对试验所用锥形瓶、容量瓶等玻璃仪器进行酸处理,再用蒸馏水将其冲洗干净后,进行高压灭菌(120℃,0.2 MPa,20 min)。试验过程中所用海水经0.45 µm醋酸纤维膜过滤后,再进行高压灭菌(120℃,0.2 MPa,20 min),待冷却后,配制成f/2营养液。
将培养好的6种细菌发酵液分别装入50 mL离心管中,于8 000 r/min转速下离心20 min,离心静置后收集上清液。
3.2 抑藻试验[15]
将长势良好的中肋骨条藻藻种接种到5 L玻璃容器中,容器中含有4 L f/2营养液海水,置于光照培养箱中进行扩大化培养,其中培养温度为(20±1)℃,光照强度为4 000 Lx,明暗周期为12 h∶12 h。在藻细胞处于指数生长期时,将藻液以相同体积(100 mL)转移到已经灭菌处理过的250 mL锥形瓶中,将6种细菌发酵液及离心得到的上清液按不同体积加入到上述藻液中,达到各设置的梯度浓度,见表2,每个梯度浓度设置3个平行样。摇匀后置于光照培养箱中培养,定时取样,用CASY快速细胞活力分析仪测定藻种的密度。
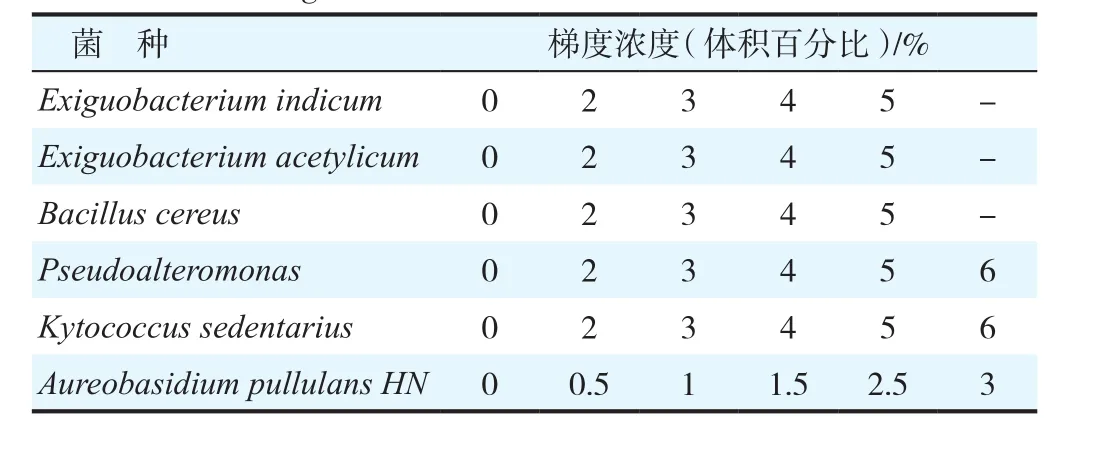
表2 抑藻试验发酵液梯度浓度设置Table 2 The determined concentration of fermentation broth for algae inhibition test
4 试验结果
试验过程中分别制备了6种细菌发酵液以及上清液,考察其对中肋骨条藻的生长抑制作用,结果见图1。由图1可见,Exiguobacterium indicum发酵液(图1a)浓度低于3%时,对中肋骨条藻生长产生促进作用;浓度为4%时,前90 h处于促进藻生长状态,90 h时达到最大值后开始抑制生长;浓度为5%时,始终处于抑制中肋骨条藻生长的状态。Exiguobacterium indicum上清液(图1b)在浓度为2%的前70 h内,对中肋骨条藻生长的促进以及抑制作用不是很明显,但在70 h之后,对其生长产生明显的抑制作用;而浓度高于2%时,均处于抑制藻类生长的状态。
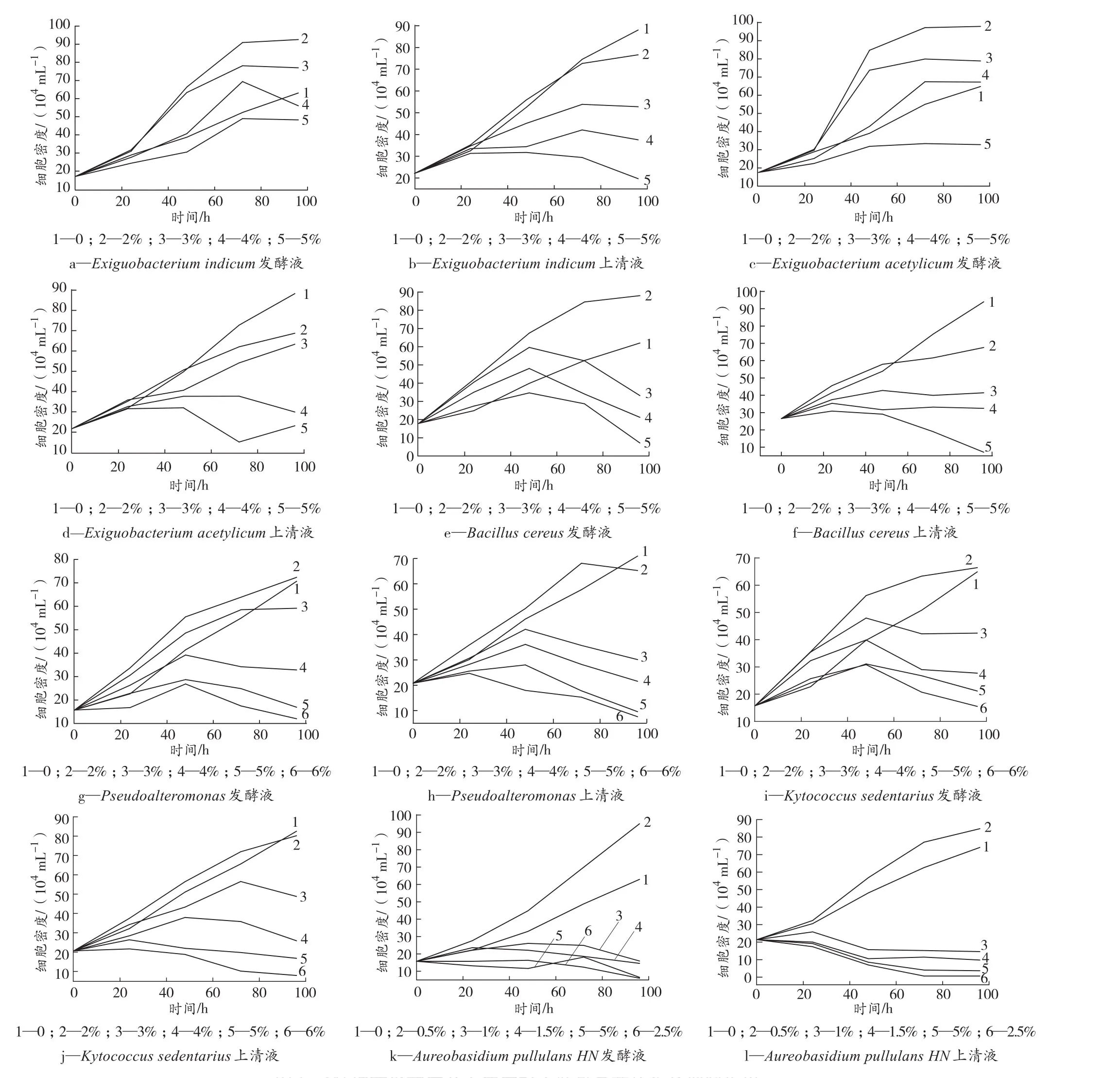
图1 6种细菌发酵液及上清液对中肋骨条藻的生长抑制作用Figure 1 Inhibition to Skeletonema costatum of the fermentation broth and supernatants of six active strains
Exiguobacterium acetylicum发酵液(图1c)浓度低于3%时,促进中肋骨条藻的生长;浓度为4%且35 h内抑制中肋骨条藻的生长,之后又促进了藻的生长;而浓度高于5%时抑制藻的生长;Exiguobacterium acetylicum上清液(图1d)在浓度2%时的前50 h促进藻生长到最大值后开始抑制藻生长;浓度高于2%时均处于抑制中肋骨条藻生长阶段。
Bacillus cereus发酵液(图1e)在浓度低于2%时,促进中肋骨条藻生长;浓度为3%和4%时,开始促进藻生长到最大值后开始抑制藻生长;浓度高于5%时,抑制藻生长;Bacillus cereus上清液(图1f)浓度为2%时,开始促进藻生长之后抑制其生长;浓度高于3%时,抑制藻生长。
Pseudoalteromonas发酵液(图1g)浓度低于2%时,促进中肋骨条藻的生长;浓度为3%和4%时,开始促进藻生长之后抑制藻生长;浓度高于5%时,抑制藻生长。Pseudoalteromonas上清液(图1h)浓度在2%时,先促进藻生长到最大值后抑制藻生长;浓度高于3%时,始终处于抑制藻生长的状态。
Kytococcus sedentarius发酵液(图1i)浓度在2%时,促进中肋骨条藻生长;浓度为3%~4%时先促进生长再抑制生长;浓度高于5%时,抑制藻生长。Kytococcus sedentarius上清液(图1j)浓度在2%时,先促进生长后抑制生长;浓度高于3%时,抑制藻生长。
Aureobasidium pullulans HN发酵液(图1k)浓度为0.5%时,促进中肋骨条藻生长;当其浓度高于1%时,抑制藻生长;Aureobasidium pullulans HN上清液(图1l)浓度低于0.5%时,促进藻生长;当浓度高于1%时,抑制藻生长。
对试验结果计算EC50值,结果如表3所示。由表3可见,活性菌株发酵液对中肋骨条藻的抑制作用要稍弱于其上清液,6种细菌对中肋骨条藻表现出的抑制作用大小为:Aureobasidium pullulans HN最强;其次为Bacillus cereus和Pseudoalteromonas;而Kytococcus sedentarius、Exiguobacterium indicum和Exiguobacterium acetylicum抑制作用相差不大。由表3还可知,微生物发酵液的毒性物质主要存在于离心后的上清液中。
5 结语
采用防污漆样板表面获得的6种活性菌株的发酵液及上清液对中肋骨条藻进行藻类生长影响的试验研究。研究结果表明,活性菌株上清液对中肋骨条藻有更好的抑制作用,其抑制作用大小为:Aureobasidium pullulans HN最强;其次为Bacillus cereus和Pseudoalteromonas;而Exiguobacterium indicum、Exiguobacterium acetylicum和Kytococcus sedentarius的抑制作用相差不大,且发酵液对藻类生长的影响结果与上清液类似。微生物发酵液的活性抑藻物质更多地存在于离心后的上清液中。由于活性抑藻物质来源于海洋活性菌株,从而为环境友好型防污剂的获得提供了理论基础。
1 王珊珊,张瑞标,刘振华,等.海洋污损生物附着及防除途径[J].河北渔业,2016(11):42-45.
2 郑纪勇.海洋生物污损与材料腐蚀[J].中国腐蚀与防护学报,2010(2):171-176.
3 张璇.船舶仿生防污沟槽表面减阻性能数值模拟分析[D].湖北武汉:武汉理工大学,2014.
4 Michael P Schultz. Frictional Resistance of Antifouling Coating Systems[J]. J Fluids Eng.,2005,126(6):1 039-1 047.
5 柏芳,王泽华,王国伟,等.防海生物污损材料研究现状[J].腐蚀与防护,2014(5):420-424.
6 严涛,刘姗姗,曹文浩.中国沿海水产设施污损生物特点及防除途径[J].海洋通报,2008,27(1):102-110.
7 张涛,彭飞,闵少松.海洋污损对螺旋桨叶切面性能影响的数值模拟[J].中国舰船研究,2016,11(3):32-36.
8 梁琳.最具威胁性物种半数进入中国[J].生态经济,2015,31(9):10-13.
9 戴宇均,汪鹏程,孙巨福.船舶防污涂料的研究进展[J].安徽化工,2013,39(5):10-12.
10 张金伟,郑纪勇,王利,等.仿生防污材料的研究进展[J].中国材料进展,2014,33(2):86-94.
11 丛巍巍,肖玲,王科,等.天然防污剂的研究现状[J].材料导报,2012,26(1):334-336.
12 Rijstenbil J W. Phytoplankton Composition of Stagnant and Tidal Ecosystems in Relation to Salinity,Nutrients,Light and Turbulence[J]. Netherlands Journal of Sea Research,1987,21(2):113-123.
13 王朝晖,袁美玲,骆育敏,等.海洋卡盾藻与中肋骨条藻和锥状斯氏藻种间竞争研究[J].水生生物学报,2010,34(2):336-34.
14 高敏.海洋微生物和微藻中防污活性物质的提取及其性能研究[D].山东青岛:中国海洋大学,2014.
15 别聪聪,李锋民,李媛媛,等.六种大型藻浸提液对中肋骨条藻的抑制及活性成分分离[J].中国海洋大学学报(自然科学版),2011,41(7/8):107-112.

