石榴枯萎病菌拮抗菌A4的筛选鉴定及定植能力研究
周银丽,郭建伟,杨 伟,胡先奇
(1.红河学院 云南省高校农作物优质高效栽培与安全控制重点实验室,云南 蒙自 661100;2.红河学院 商学院,云南 蒙自 661100;3.云南农业大学 农业生物多样性与病害控制教育部重点实验室,云南 昆明 650201)
云南蒙自万亩石榴园拥有“中国石榴之乡”的美誉,然而随着石榴树龄的增长及栽培集约化管理,石榴连作障碍日渐凸显,各种石榴病害也日益严重[1-2]。其中被果农称为石榴的“癌症”的枯萎病尤其严重。作为土传真菌病害的石榴枯萎病,其病原菌甘薯长喙壳(CeratocystisfimbriataEllis & Halsted)分布广泛,在我国主要引起芋头黑腐病、甘薯黑斑病、石榴枯萎病[3]。我国云南省蒙自县、四川省攀西地区先后发生了石榴枯萎病[4-6],根部伤口是石榴枯萎病菌的主要入侵通道[7]。枯萎病害石榴园再植石榴难以成活,石榴果园面积在不断减少,已成为石榴产业健康持续发展的重要限制因子。
目前防治石榴枯萎病主要还是依赖化学农药,由于化学药剂的长期使用,引起石榴果实和环境污染且导致石榴枯萎病菌产生抗药性,因此从根本上控制该病害的措施是利用生防微生物拮抗病原菌的同时对石榴枯萎病果园衰退土壤进行生物修复,已有的研究表明在石榴枯萎病的防控过程中土著微生物具有良好的应用潜力[8-11]。本研究筛选对石榴枯萎病菌有较强抑菌作用的芽孢杆菌,为环保地控制石榴枯萎病提供一定的参考。
1 材料与方法
1.1 根际土样的采集
采集的土样类型有石榴枯萎病根际土、健康石榴根际土。将石榴园进行区划,采用五点取样法,在每点取样株3株,从每样株周围3处不同的位置采集根系周围1 cm左右的根际土壤,将3样株根际土混合为一个样本,共采集了45份样本。
1.2 石榴枯萎病菌拮抗芽孢杆菌的筛选
拮抗芽孢杆菌粗筛:将培养7 d的石榴枯萎病病原菌配制孢子悬浮液,浓度为1×103CFU/mL,取100 μL涂布于PDA平板上,静置5 h。把从土壤中分离到的芽孢杆菌单菌落用灭菌牙签接种到涂有病原菌的PDA平板上,接种时选取不同菌落形态、不同颜色的芽孢杆菌,以获得更多的拮抗菌株,置于28 ℃恒温培养箱培养3~5 d后,观察并测定其抑菌圈的大小。
拮抗芽孢杆菌复筛:选出初筛对石榴枯萎病菌有明显抑制效果的拮抗芽孢杆菌,再用平板对峙法进行复筛,保存拮抗效果好的芽孢杆菌进行后续试验。
1.3 石榴枯萎病菌拮抗芽孢杆菌的定植能力研究
在温室中准备好无菌土盆栽石榴苗,按期施肥浇水,待石榴苗生长至一年期。对拮抗菌株进行利福平抗性标记,将利福平抗性菌株接种于LB培养液中,摇床中150 r/min和37 ℃条件下培养至浓度达1×107CFU/mL,取菌悬液100 mL,采用浇灌法接种在石榴苗根际土壤中,3个重复,定期浇水施肥,常规管理。
定殖能力的测定 施入菌悬液后,每隔5 d取样1次,共取样7次,即分别于第5、10、15、20、25、30和35天取样调查根部土壤中拮抗菌株的数量。取根际土样,制备土壤样品10-1、10-2、10-3、10-4、10-5和10-6的系列稀释液,选择10-4、10-5和10-6的稀释液,分别移取样品200 μL均匀涂布于含利福平(200 μg/mL)的LB平板上,每个梯度3次重复,37 ℃条件下培养48 h后分别统计平板上的菌落数。定殖密度计算:
定殖密度(CFU/g)=同一稀释度3次重复的平均菌落数×稀释倍数×5
(1)
1.4 石榴枯萎病菌拮抗细菌的生化鉴定
鉴定步骤:(1)菌种活化:将待测菌种放在培养基上活化,33 ℃下培养24 h;(2)菌种纯化:将活化好的菌种在培养基上稀释划线,33 ℃下培养24 h,以获得单个菌落;(3)在Biolog专用的培养基上培养微生物,将获得的纯培养菌种接种至Biolog专用的培养基上,33 ℃培养24 h;(4)准备预期浊度的接种物,在Biolog专用培养基中培养的菌种,沾取一个单菌落即可,将棉签的末端深入装有接种液的接种管的底端,并来回上下晃动,以便将细菌释放到接种液中,且按要求配制一定浊度(细胞浓度)的菌悬液,用浊度仪检测;(5)接种微孔板:将菌悬液倒入V型加样水槽中;使用8道移液器将菌悬液吸入移液器吸头中;按每孔100 μL的量将菌悬液按顺序加入微孔板的所有孔中;(6)孵育微孔板:将微孔板直接放入培养箱中培养3~36 h。培养温度33 ℃,或者如第一步中提到情况下在更适合微生物生长的其他温度下培养;(7)读板并记录:将培养后的鉴定板放入读数仪中读数,软件自动给出鉴定结果。
1.5 石榴枯萎病菌拮抗芽孢杆菌的分子鉴定
用OMEGA细菌基因组试剂盒提取细菌DNA,提取操作步骤按照说明进行,可得到高质量的细菌基因组DNA。用细菌gyrB的引物进行PCR扩增,对扩增片段进行回收、连接、转化、克隆,阳性克隆送北京六合华大基因科技股份有限公司测序。
2 结果与分析
2.1 石榴枯萎病菌拮抗芽孢杆菌的筛选及定植能力
本研究从云南建水石榴园和蒙自万亩石榴园共采集了45个土壤样本,初步筛选得到26株拮抗石榴枯萎病菌的芽孢杆菌,进一步用平板对峙法复筛,共得到对石榴枯萎病菌拮抗活性明显的芽孢杆菌10株,其中拮抗菌A4对石榴枯萎病菌抑制率为55.29%(图1)。
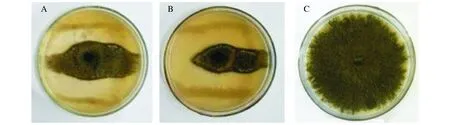
图1 菌株A4对石榴枯萎病菌的拮抗效果Fig.1 Antifungal plate of A4 against Ceratocystis fimbriata(A、B) and the control(C)
利福平抗性标记菌株A4在石榴苗根际第5、10、15、20、25、30和35天的回收菌量为6.5×103、5×104、1.8×104、1.8×104、1.2×103、1×103和1.3×103,利福平抗性菌株A4在石榴根际的定殖密度第1次取样时出现下降,第2次取样时菌量上升,第3次、第4次取样时定殖密度维持稳定,第5次取样时又有下降,之后在石榴根际的定殖密度趋于稳定,表明菌株A4能在石榴根际稳定定植。
2.2 菌株A4的生化鉴定
菌株A4对Biolog板上95种碳底物的利用能力统计结果。单糖:能完全反应的有12种,半反应的有12种,未反应的有2种;磷酸己糖:两种都为半反应;氨基酸:完全反应有4种,半反应有5种;己糖羧酸:完全反应有6种,半反应有3种;酸、酯和脂肪酸:完全反应有4种,半反应的有12种,未反应的有2种(表1)。最后鉴定结果与菌株Bacillusatrophaeus的相似值为:0.674(相似值>0.500为有效鉴定)。
2.3 石榴枯萎病菌拮抗芽孢杆菌的分子鉴定
通过PCR扩增方法得到菌株A4的gyrB基因,对扩增片段进行克隆,测序获得菌株A4的gyrB基因近全长序列。Blast相似性分析表明,菌株A4与萎缩芽孢杆菌B.atrophaeus的gyrB基因序列同源性为99%,建立系统发育树时菌株A4与萎缩芽孢杆菌处于同一分支(图2),结合该菌株在细菌鉴定版上的鉴定结果与菌株B.atrophaeus的相似值为:0.674(相似值>0.500为有效鉴定),将A4菌株鉴定为萎缩芽孢杆菌B.atrophaeus。

表1 菌株A4对Biolog板上95种碳底物的利用能力
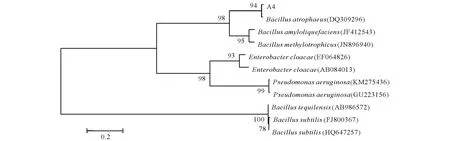
图2 以gyrB基因序列为基础构建的A4菌株系统进化树Fig.2 Phylogenetic tree of A4 based on gyrB gene sequence
3 结论与讨论
石榴枯萎病号称石榴的“癌症”,是一种难防的土传真菌病害,石榴枯萎病现以“蚕食”的形式在危害石榴果园,是影响石榴产业健康发展的一个重要限制因子,而现在生产上使用的化学农药,造成了农药残留及污染环境,无法满足人们对食品安全及环境保护的迫切需求。本研究采用稀释平板涂布及对峙培养法,共筛选到对石榴枯萎病菌有较强抗性的芽孢杆菌10株,其中拮抗芽孢杆菌A4对石榴枯萎病菌的抑制率为55.29%,且该菌株能在石榴根际土壤稳定定植,具有潜在的生防价值。菌株A4与萎缩芽孢杆菌B.atrophaeus的gyrB基因序列同源性为99%,建立系统发育树时菌株A4与萎缩芽孢杆菌处于同一分支,结合A4菌株在细菌生化鉴定版上的鉴定结果,将A4菌株鉴定为萎缩芽孢杆菌B.atrophaeus。
萎缩芽孢杆菌作为拮抗菌有很多报道,刘丁等[12]研究报道了花生抗性、抗病能力提高可在一定程度上被萎缩芽孢杆菌诱导。薛鹏琦等[13]分别从西藏日喀则地区和拉萨地区杂草根围土壤中筛选到对油菜菌核病菌有显著拮抗活性的萎缩芽孢杆菌菌株RJGP16,该菌株对油菜菌核病菌防治效果为50.24%。朱文静等[14]研究报道了大豆发芽及生长可被枯草芽孢杆菌SYST2和萎缩芽孢杆菌LSSC3制备的种衣剂显著促进。温室盆栽试验表明这2种生物种衣剂对大豆进行处理,对大豆根腐病有较好的防治作用。辛海峰等[15]从小麦叶片中筛选获得了一株抗赤霉病菌株XM5,鉴定其为萎缩芽孢杆菌(B.atrophaeus)。本研究表明,萎缩芽孢杆菌A4对石榴枯萎病菌有较好的抑制效果,该菌株能在石榴根际土壤稳定定植,有潜在的开发利用价值。石榴枯萎病的有效防控不可能依赖一两株生防菌,找到更多的生防菌,并将其进行合理组合,在控制石榴枯萎病的同时,改善失衡的土壤微生态环境,是有效防控石榴枯萎病的努力方向。
[1] 周银丽,胡先奇,张国伟.云南石榴根际剑属线虫的记述[J].江西农业大学学报,2007,29(2):194-197.
Zhou Y L,Hu X Q,Zhang G W.A record of pomegranate Xiphinema nematode from Yunnan[J].Acta Agriculturae Universitatis Jiangxiensis,2007,29(2):194-197.
[2] 周银丽,郭亚力,张微,等.云南石榴根际螺旋线虫的种类研究初报[J].江西农业大学学报,2007,29(6):937-939.
Zhou Y L,Guo Y L,Zhang W,et al.Preliminary description on megranate parasitical nematodes in Yunnan[J].Acta Agriculturae Universitatis Jiangxiensis,2007,29(6):937-939.
[3] 郭建伟,郭娟,杨建,等.石榴枯萎病、芋头黑腐病病原拮抗真菌的筛选与鉴定[J].江西农业大学学报,2014,36(4):772-775.
Guo J W,Guo J,Yang J,et al.Screening and identification of antagonistic fungi against the pathogen of pomegranate wilt and taro black rot[J].Acta Agriculturae Universitatis Jiangxiensis,2014,36(4):772-775.
[4] 刘云龙,何永宏,王新志.国内一种果树新病害-石榴枯萎病[J].植物检疫,2003,17(4):206-208.
Liu Y L,He Y H,Wang X Z.A new fruit tree disease in china-the pomegranate wilt disease[J].Plant Quarantine,2003,17(4):206-208.
[5] Huang Q,Zhu Y Y,Chen H R,et al.First report of pomegranate wilt caused byCeratocystisfimbriatain Yunnan,China[J].Plant Disease,2003,87(9):1150.
[6] Xu B,Zheng X H,Guo W X,et al.First report of pomegranate wilt caused byCeratocystisfimbriatain Sichuan Province[J].Plant Disease,2011,95(6):776-777.
[7] 周银丽,胡先奇,王卫疆,等.根结线虫在云南石榴枯萎病发生过程中的作用初探[J].江苏农业科学,2010,38(1):149-150.
Zhou Y L,Hu X Q,Wang W J,et al.The role of root knot nematodes in the pomegranate wilt occurrence process of Yunnan Province[J].Jiangsu Agricultural Sciences,2010,38(1):149-150.
[8] 潘俊,毛忠顺,李霞,等.利用枯草芽孢杆菌和荧光假单胞杆菌防治石榴枯萎病的初步研究[J].云南农业大学学报,2013,28(1):27-31.
Pan J,Mao Z S,Li X,et al.Preliminary study on pomegranate wilt management by employingBacillussubtilisand pseudomonas florescence isolates[J].Journal of Yunnan Agricultural University,2013,28(1):27-31.
[9] 周银丽,杨艳丽,袁绍杰,等.石榴枯萎病菌拮抗放线菌对南方根结线虫的毒力[J].植物保护,2016,5:58-64.
Zhou Y L,Yang Y L,Yuan S J,et al.Nematicidal activity of actinomycete antagonistic to pomegranate wilt pathogen[J].Plant Protection,2016,5:58-64.
[10] 周银丽,袁绍杰,潘云梅,等.放线菌JS2对石榴枯萎病菌及南方根结线虫的毒力研究[J].江西农业大学学报,2016,38(2):268-274.
Zhou Y L,Yuan S J,Pan Y M,et al.Studies on the toxicity of actinomycete JS2 to pomegranate wilt pathogen and root knot nematode[J].Acta Agriculturae Universitatis Jiangxiensis,2016,38(2):268-274.
[11] 周银丽,袁绍杰,杨艳梅,等.石榴枯萎病菌拮抗放线菌MZ11对南方根结线虫的抑卵作用研究[J].云南农业大学学报(自然科学版),2016,31(S1):46-51.
Zhou Y L,Yuan S J,Yang Y M,et al.Studies on pomegranate wilt pathogen antagonism Actinomycete MZ11 nematicidal activity[J].Journal of Yunnan Agricultural University,2016,31(S1):46-51.
[12] 刘丁,秦文.萎缩芽孢杆菌处理提高花生黄曲霉抗性的作用机制[J].食品科学,2013,34(23):266-270.
Liu D,Qin W.Mechanism of action ofBacillusatrophaeusin improvingAspergillusflavusresistance of peanuts[J].Food Science,2013,34(23):266-270.
[13] 薛鹏琦,刘芳,乔俊卿,等.油菜菌核病生防芽孢杆菌的分离鉴定及其脂肽化合物分析[J].植物保护学报,2011,38(2):127-132.
Xue P Q,Liu F,Qiao J Q et al.Screening of Bacillus strains with high inhibition on rape Sclerotinia disease and its lipopeptide compounds detection[J].Acta Phytophylacica Sinica,2011,38(2):127-132.
[14] 朱文静,伍辉军,高学文.芽孢杆菌对大豆根腐病防治效果研究[J].大豆科学,2011,4:621-625.
Zhu W J,Wu H J,Gao X W.Prevention and control effect study of Bacillus on soybean root rot disease[J].Soybean Science,2011,4:621-625.
[15] 辛海峰,孟艳艳,李建宏,等.一株萎缩芽孢杆菌在小麦中的定植及对赤霉病的防治[J].生态学杂志,2013,32(6):1490-1496.
Xin H F,Meng Y Y,Li J H,et al.Bacillusatrophaeusstrain’s colonization in wheat plant and its inhibition efficiency to Fusarium head blight[J].Chinese Journal of Ecology,2013,32(6):1490-1496.

