拉萨传统乳制品酥油的微生物多样性与开发前景研究
次 顿,潘 虎,达娃卓玛,李 颖,魏 娜
(西藏自治区农牧科学院农业质量标准与检测研究所,西藏 拉萨 850032)
【研究意义】酥油是西藏地区重要的传统乳制品。酥油营养价值极高,含有丰富的乳脂肪、微量元素和不饱和脂肪酸,是藏族群众制作酥油茶的主要原料。酥油丰富的营养物质和较高的水分含量为微生物的滋生与繁殖创造了非常适宜的环境条件。酥油微生物的种类和数量直接影响酥油产品的品质和安全性。一方面,酥油在乳酸菌等有益微生物作用下会产生风味物质,从而改善产品品质[1];另一方面,酥油在霉菌等有害微生物作用下,极易引起酸败或产生毒素[2],从而威胁酥油的消费安全。【前人研究进展】目前对酥油的研究主要集中在成分分析3]、贮存条件[4]以及新产品开发[5]等方面,对酥油中微生物的探讨鲜有报道[6]。【本研究切入点】本文以拉萨地区酥油为研究对象,采用PCR-DGGE技术分析酥油中的细菌和真菌群落结构,从而揭示拉萨地区酥油中的主要微生物类群。【拟解决的关键问题】通过本文研究为进一步提高拉萨地区酥油的微生物品质和质量安全提供重要数据基础。
1 材料与方法
1.1 试剂与仪器
仪器:PCR扩增仪(Bio-Rad C1000型),变性梯度凝胶电泳仪(Bio-Rad 1709080型),凝胶成像系统(Bio-Rad Gel-Doc2000型)。

表1 酥油样品采集信息表
试剂: 土壤DNA提取试剂盒(天根公司),DNA Gel Extraction Kit试剂盒(OMEGA公司),Poly-Gel DNA 提取试剂盒(OMEGA公司),PMD18-T载体(天根公司),DH5α感受态细胞(天根公司),丙烯酰胺、双丙烯酰胺、过硫酸铵、硼酸、Trizma碱、EDTA、冰醋酸、硝酸银等试剂均购自天根公司,GC-338F/518、GC-FR1/FF390、338F/518R和FR1/FF390等引物由上海美吉生物公司合成。
1.2 酥油样品的采集
酥油样品于2014年9月采集于拉萨及其周边地区,共采集代表性样品15份,每份样品采集数量为2~3 kg,样品放置于专用无菌采样袋中。具体采样信息见表1。
1.3 酥油微生物总DNA的提取与PCR扩增
按照天根DNA提取试剂盒说明中方法步骤,对酥油样品中微生物总DNA进行提取。然后再分别以提取的各样品微生物总DNA为模板,采用细菌通用引物GC-338F/518R扩增16S rDNA高变区序列;采用真菌通用引物GC-FR1/FF390扩增样品18S rDNA高变区序列。PCR扩增程序参考Dong XL等[7],PCR扩增产物采用OMEGA公司DNA Gel Extraction Kit纯化回收。
1.4 变性梯度凝胶电泳及图像数据分析
取10 μl PCR产物进行变性梯度凝胶电泳(DGGE)分析。16S rDNA高变区序列PCR产物采用变性梯度为35 %~55 %、浓度为7 %的聚丙烯酰胺凝胶在1×TAE缓冲液中150 V 60 ℃下电泳5 h;18S rDNA高变区序列PCR产物采用变性梯度为30 %~50 %、浓度为7 %的聚丙烯酰胺凝胶在1×TAE缓冲液中150 V 60 ℃下电泳7 h。变性梯度凝胶电泳完毕后,采用硝酸银进行染色,染色后用Bio-Rad 公司的Gel-Doc2000 进行扫描成像,进一步利用Quantity One软件读取图像上各条带的强度,根据电泳图谱中样品条带数目及每个条带的强度,计算Shannon-Wiener多样性指数(H’),从而表征酥油微生物的多样性[8]。
其中,pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率,N为DGGE图谱单一泳道上所有条带的丰度,Ni为第i条带的丰度;S是某样品中所有条带数目总和。最后采用UPGAMA算法进行聚类分析。
1.5 序列测定与分析
用灭菌的手术刀切下主要的DGGE优势条带,再采用OMEGA公司Poly-Gel DNA 提取试剂盒回收目的条带。以2 μl回收产物为模板,以338F(CCTACGGGAGGCAGCAG)/518R和FR1(AICCATTCAATCGGTAIT)/FF390为引物分别进行16S rDNA 和18S rDNA可变区序列的再扩增,扩增产物纯化后连接到PMD18-T载体上,并转化至DH5α感受态细胞中,筛选阳性克隆,进行序列测定,测序结果采用DNAstar和Cluster软件进行分析,下载最相似的菌株序列作为系统发育树的参考序列,然后采用MEGA软件和Neighbor-joining法构建系统发育树,自展数(bootstrap)为1000。
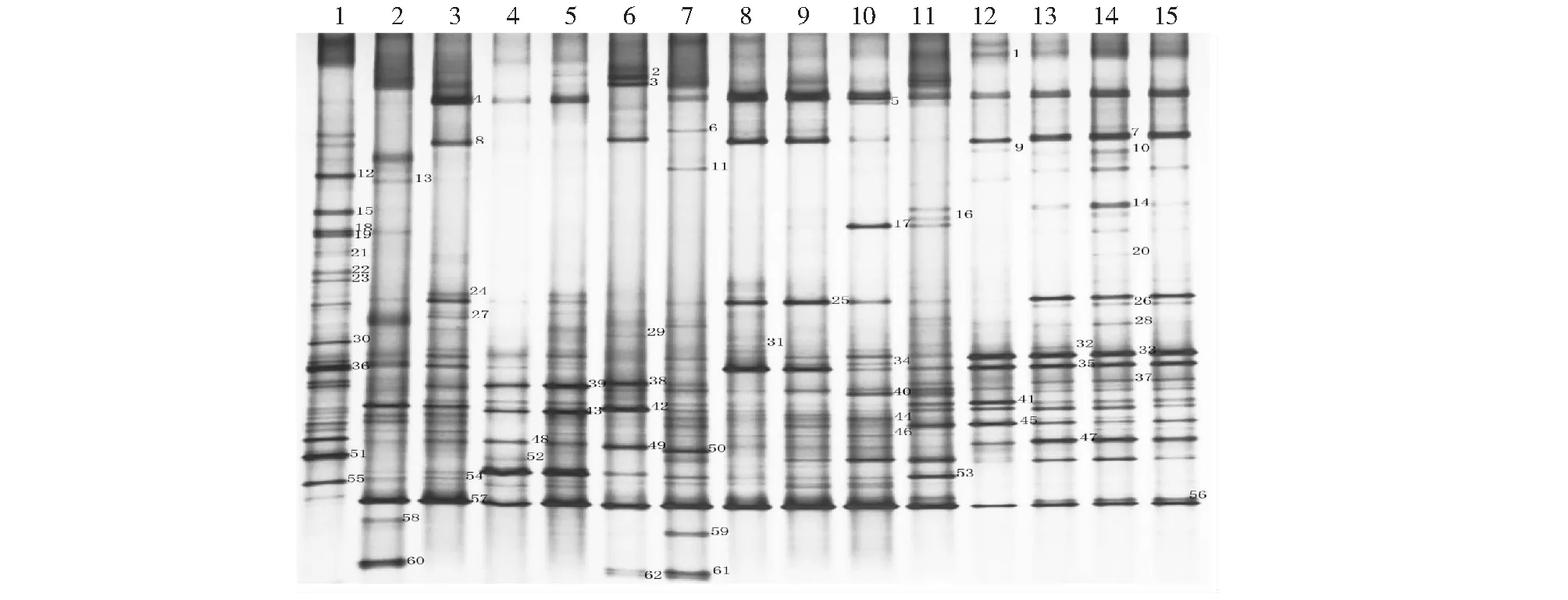
图1 酥油样品16S rDNA可变区DGGE指纹图Fig.1 16S rDNA DGGE fingerprints from butter samples
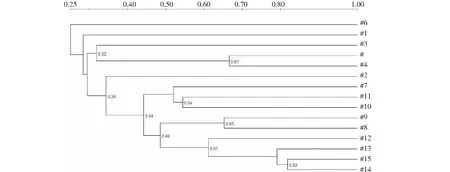
图2 不同酥油样品的细菌DGGE图谱聚类结果Fig.2 Clustering analysis of bacterial DGGE patterns on different butter samples
2 结果与分析
2.1 拉萨市酥油细菌多样性分析
2.1.1 拉萨市酥油细菌DGGE指纹图谱分析 酥油细菌PCR-DGGE多样性分析共得到不同优势条带62条(图1)。依据15个样品间的戴斯系数,构建不同样品的细菌DEEG聚类图(UPGMA),结果表明:14和15号样品的相似度最高,达到0.82;4和5号样品的相似度为0.67;8和9号样品的相似度为0.65;12号和13、14、15号样品的相似度为0.61;10和11号样品的相似度为0.54; 8、9号样品和12、13、14、15号样品的相似度为0.48;7、10、11号样品和8、9、12、13、14、15号样品的相似度为0.44;2号样品和7、8、9、10、11、 12、13、14、15号样品的相似度为0.34;3号样品和4、5号样品的相似度为0.32(图2)。
根据电泳图谱中样品条带数目及每个条带的强度(灰度),对各样品中细菌多样性指数(H)、均匀度(E)和丰富度(S)等指标进行分析,结果表明:1号样本的细菌多样性最高,其次为3、7、11、14号样本,再次为2、5、6、12、15号样本,4号样本的细菌多样性最低(图3)。

图3 拉萨地区不同酥油样品的细菌Shannon-Wiener多样性指数Fig.3 Bacterial Shannon-Wiener diversity index on different butter samples in Lhasa
2.1.2 酥油样品中优势细菌16S rDNA序列分析及属种鉴定 酥油样品DGGE图谱切胶共得到62条优势条带,测序结果表明:拉萨地区酥油样品中的62个优势细菌中37个为厚壁菌门(其中17个为乳球菌属,11个为链球菌属,6个为乳杆菌属,2个为粪肠球菌属,1个为Pilibacter termitis );20个为变形菌门(其中12个为假单胞菌属,4个为不动杆菌属,1个为希瓦氏菌属,1个为拉乌尔菌属,1个为克鲁维菌属,1个为Herminiimonas );5个为拟杆菌门(其中3个为稳杆菌属,1个为黄杆菌属,1个为Epilithonimonas)。由此判断,拉萨地区酥油样品中的优势细菌种群主要为乳球菌、假单胞菌、链球菌以及乳杆菌。
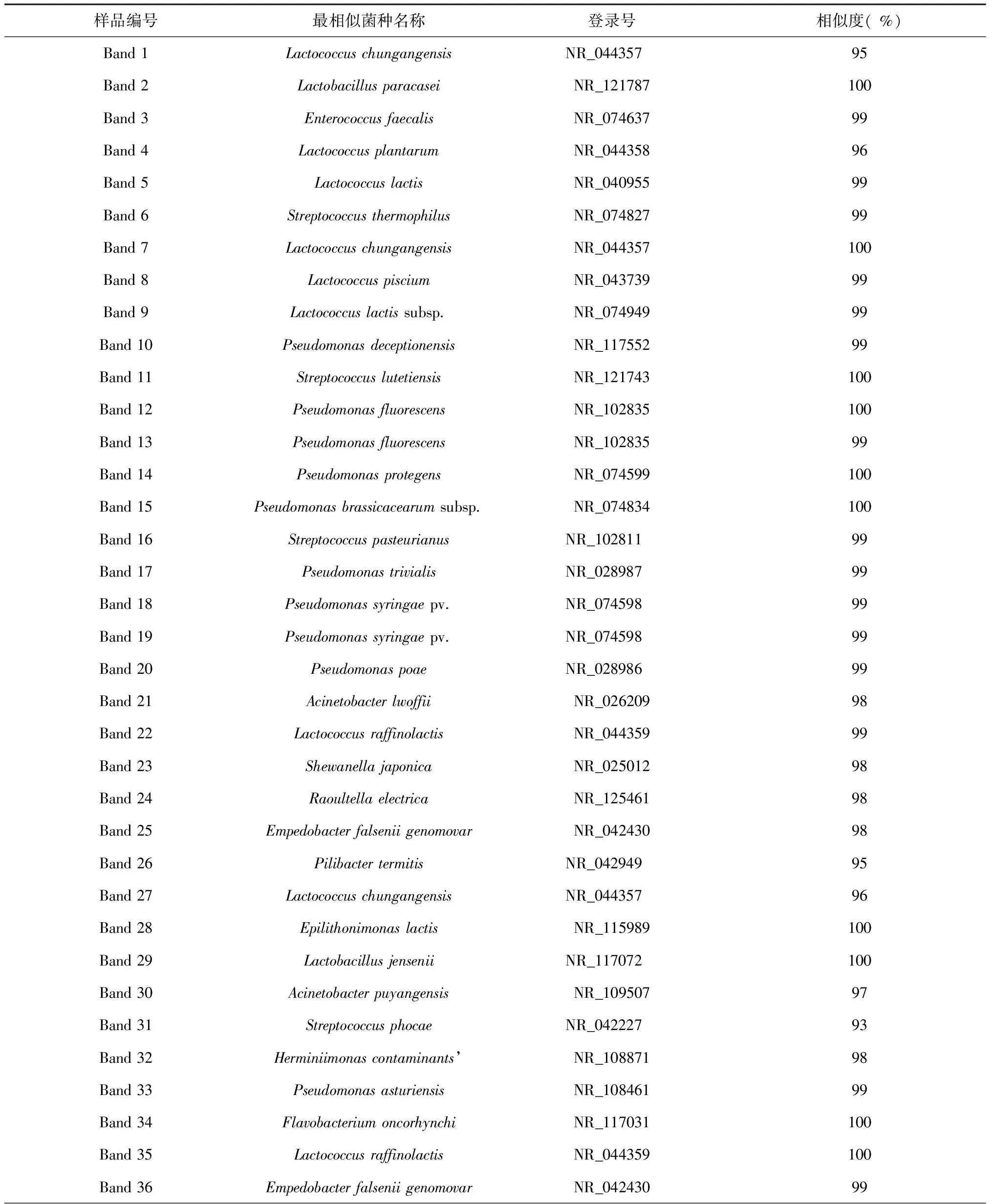
表2 酥油样品优势细菌的序列比对
续表2 Continued table 2

样品编号最相似菌种名称登录号相似度(%)Band37LactococcuspisciumNR_043739 99Band38EnterococcusfaeciumNR_102790 100Band39LactococcusplantarumNR_118903 95Band40PseudomonaskuykendalliiNR_118155100Band41AcinetobacterkyonggiensisNR_11671499Band42LactobacillusacidophilusNR_075045100Band43StreptococcussaliviloxodontaeNR_126178 94Band44StreptococcusloxodontisalivariusNR_126177 94Band45Lactobacillusdelbrueckiisubsp NR_117076100Band46Lactococcuslactissubsp NR_103918100Band47LactococcusraffinolactisNR_118904 98Band48AcinetobacterjohnsoniiNR_04497599Band49LactobacillusacidophilusNR_075045100Band50LactobacilluspsittaciNR_12581199Band51PseudomonascongelansNR_028985 99Band52LactococcusraffinolactisNR_044359 95Band53EmpedobacterfalseniigenomovarNR_042430 98Band54KluyveraintermediaNR_028802100Band55Streptococcusinfantariussubsp NR_102799 99Band56StreptococcusagalactiaeNR_102871 94Band57LactococcuslactisNR_040955100Band58StreptococcusagalactiaeNR_115728 95Band59StreptococcushongkongensisNR_11797494Band60StreptococcusthermophilusNR_074827100Band61Lactococcuslactissubsp CramoisyNR_040954 100Band62LactococcustaiwanensisNR_114327 94
2.2 拉萨市酥油真菌多样性分析
2.2.1 拉萨市酥油真菌DGGE指纹图谱分析 酥油真菌PCR-DGGE多样性分析共得到不同优势条带18条(图4)。依据15个样品间的戴斯系数,构建出不同样品的真菌DEEG聚类图(UPGMA)表明:4号和10号样品的相似度最高,达到0.81;3号和15号样品的相似度为0.75;8号和13号样品的相似度为0.72;5号和12号样品的相似度为0.70;9号和11号样品的相似度为0.62;7号和5、12号样品的相似度为0.61;8、13号样品和3、6、15号样品的相似度为0.61;5、7、12号样品和4、10号样品的相似度为0.58;1号样品和14号样品的相似度为0.56;2号样品和9、11号样品的相似度为0.53;2、9、11号样品和4、5、7、10、12号样品的相似度为0.47;1、4号样品和3、6、8、13、15号样品的相似度为0.45;1、3、6、8、13、14、15号样品和2、4、5、7、9 、10、11、12号样品的相似度为0.40(图5)。根据电泳图谱中样品条带数目及每个条带的强度(灰度),对各样品中真菌多样性指数(H)、均匀度(E)和丰富度(S)等指标分析表明:2号样本的真菌多样性最高,其次为1、6、15号样本,再次为3、4、5、7、8、9、10、11、12、13号样本,14号样本的真菌多样性最低(图6)。
2.2.2 酥油样品中优势真菌的18S rDNA序列分析及属种鉴定 酥油样品DGGE图谱切胶共得到18条优势条带,测序结果表明:拉萨地区酥油样品中有18个优势真菌,包括8个假丝酵母属,4个亚罗酵母属,2个毕赤酵母属,1个酵母菌属,1个克鲁维酵母菌属,1个芽生菌属, 1个Naumovozyma,且相似度都在98 %及以上。由此判断,拉萨市酥油样品中的优势真菌种群主要为酵母菌,其中44.4 %为假丝酵母,22.2 %为亚罗酵母,11.1 %为毕赤酵母。

图4 酥油样品18S rDNA可变区DGGE指纹图Fig.4 18S rDNA DGGE fingerprints from butter samples

图5 拉萨市不同酥油样品中真菌DGGE图谱聚类结果Fig.5 Clustering analysis of the fungi DGGE patterns on different butter samples

图6 拉萨市不同酥油样品的真菌Shannon-Wiener多样性指数Fig.6 Fungi Shannon-Wiener Diversity index on different butter samples in Lhasa
3 讨 论
酥油是西藏地区重要的传统乳制品,其微生物的种类和数量直接影响酥油产品的风味、品质和安全性。本文采用PCR-DGGE分子生物学技术,研究分析了拉萨市酥油微生物的多样性。从拉萨市15份酥油样品中鉴定出62种细菌和18种真菌,酥油样品中的优势细菌种群主要为乳球菌、假单胞菌、链球菌以及乳杆菌,优势真菌种群主要为酵母菌,其中44.4 %为假丝酵母、22.2 %为亚罗酵母、11.1 %为毕赤酵母。Shannon-Wiener多样性指数分析表明,1号样品的细菌多样性最高,2号样品的真菌多样性最高,值得注意的是这2个样品均来自拉萨市堆龙德庆县羊达乡。研究还发现,酥油微生物中能够产生风味物质的主要是乳酸菌和酵母菌,可以在新产品研发中有针对性地加以利用。然而,在酥油中发现的62种细菌中有2种是粪肠球菌(Enterococcusfaecalis),肠球菌普遍存在于自然界,易引起心内膜炎,胆囊炎,脑膜炎,尿路感染及伤口感染等多种疾病,是一种主要的病原微生物,需要在今后的酥油产品质量安全监管中加以重点关注,开展风险评估并研究污染控制技术。
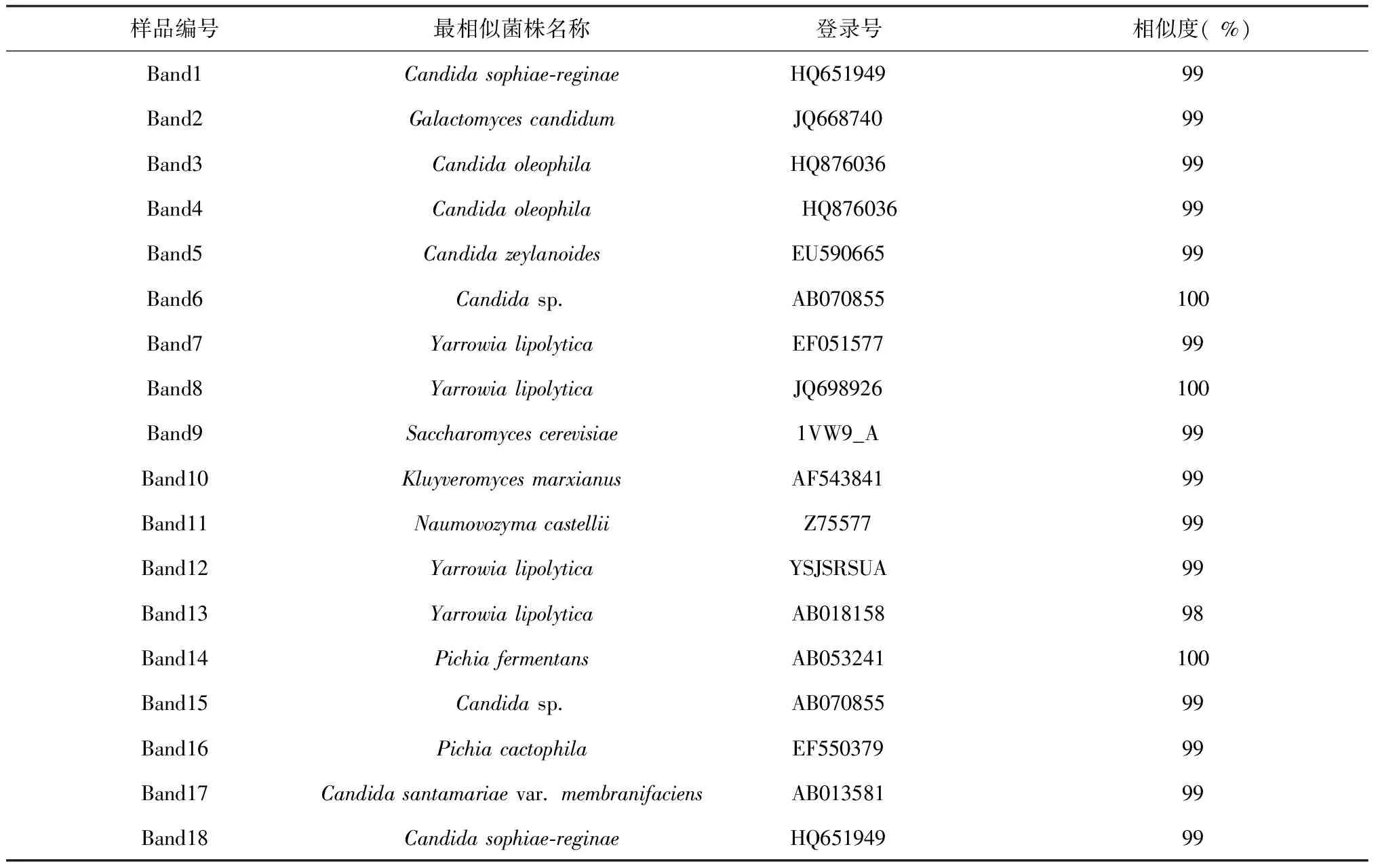
表3 酥油样品中优势真菌的序列比对分析结果
目前有关酥油微生物的研究较少,刘晓棠等[10]早期研究表明西藏地区酥油样品中细菌总数合格率为54.3 %,大肠菌群的合格率为95.0 %,致病菌检出率为3.3 %,霉菌检出率为97.5 %,结核杆菌及布鲁氏杆菌尚未检出。张以芳等[11]从26份云南酥油中共分离到18种49株乳酸菌,并且大部分乳酸菌具有较好的产香产酸性能,乳酸菌是酥油中的优势种群,与本文研究吻合。刘文俊等[12]对西藏地区牦牛乳和乳制品中分离得到6属22种213株乳酸菌株,其中乳杆菌属(Lactobacillus)118株,占分离乳酸菌总数55.40 %;其次为明串珠菌属(Leuconostoc)74株,占34.74 %;同时还分离到链球菌属(Streptococcus)5株,占2.35 %;乳球菌属(Lactococcus)8株,占3.6 %;肠球菌属(Enterococcus)4株,占1.88 %;魏斯氏菌属(Weissella)4株,占1.88 %。本研究中拉萨地区酥油样品中的细菌主要优势种群为乳球菌属、假单胞菌属、链球菌属及乳杆菌肠球菌属等,与刘文俊等西藏地区牦牛乳和乳制品研究结果基本一致。王秋玲等[13]研究指出酥油中真菌种类主要为有益酵母菌,同时还从酥油样品中分离得到金黄色葡萄球菌等病源微生物,而本文鉴定出的病原微生物主要为粪肠球菌(Enterococcusfaecalis),可能是由于金黄色葡萄球菌在酥油中含量较少,粪肠球菌含量较高,PCR-DGGE对含量较少微生物未能检测到,金黄色葡萄球菌需要通过增菌过程大量繁殖后才能检测到。
酥油有益微生物的多样性,说明酥油不只是含有乳脂肪、蛋白、维生素等营养物质的食品,对此,藏民族在长期酥油食用中也积累了丰富经验,比如,腹泻病人、大病患者和孕妇生育后的恢复期,食用新鲜酥油养胃或滋补。酥油有益微生物多样性,有利于肠道微生物平衡和机体正常代谢,提高宿主免疫功能[9],成为有益微生物的重要来源。因此,酥油有别于其他油脂,更有别于植物氢化油,在传统食品现代化中高度重视酥油的这一特征,甚至充分利用这一特点,开发以酥油为原料的营养健康功能食品,市场潜力很大。
4 结 论
拉萨市酥油样品微生物的多样性研究表明:酥油样品中优势细菌种群主要为乳球菌、假单胞菌、链球菌以及乳杆菌,优势真菌种群主要为酵母菌,其中44.4 %为假丝酵母、22.2 %为亚罗酵母、11.1 %为毕赤酵母。本文对产自拉萨市的酥油样品进行了系统的微生物多样性分析研究,上述研究结果对酥油有益微生物资源的开发利用与酥油产品的质量安全、科学监管与防控提供了重要的科学依据。
[1]李 瑶. 酥油中增香型乳酸菌的分离及其产香特性的初步研究[D]. 石河子大学, 2014.
[2]达娃卓玛. 西藏酥油地方标准微生物指标的初步探讨[J]. 西藏农业科技,2015, 37(2):42-45.
[3]喻 峰, 熊 华,吕培蕾. 西藏牦牛酥油脂肪酸成分分析及功能特性评价[J]. 中国油脂, 2006, 31(11):35-38.
[4]张 琦. 酥油贮藏稳定性研究[D]. 天津商业大学, 2014.
[5]喻 峰. 西藏酥油营养成分分析及核桃风味速溶酥油茶产品开发[D]. 南昌大学, 2006.
[6]达娃卓玛. 西藏不同地区酥油微生物指标比较及分析[J]. 西藏科技,2015(8):3-5.
[7]Dong X L, Reddy G B. Soil bacterial communities in constructed wetlands treated with swine wastewater using PCR-DGGE technique[J]. Bioresour Technol, 2010,101(4):1175-1182.
[8]王加鹏, 崔正国, 周 强, 等. 人工湿地净化海水养殖外排水效果与微生物群落分析[J]. 渔业科学进展, 2014, 35:1-8.
[9]石春卫,陈毅秋,胡静涛,等. 肠道微生物群对宿主免疫系统发育和功能的调节[J].中国免疫学杂志, 2016(32):1536-1540.
[10]刘晓堂,边巴卓玛, 陈 虹. 酥油卫生微生物学评价[J].西藏科技, 1994(4):73-74.
[11]张以芳, 向文彬, 刘旭川. 酥油奶渣制品中乳杆菌分离鉴定[J]. 食品科技, 2000(1):54-55.
[12]刘文俊, 扎木苏, 秦艳婷, 等. 应用纯培养和DGGE技术研究西藏地区传统牦牛乳制品中微生物的多样性[C]. 乳酸菌与健康国际研讨会, 2014.
[13]王秋玲. 酥油的西藏地方卫生微生物标准分析与建议[J]. 西藏科技, 2015(8):17-19.

